La lignina es una clase de polímeros orgánicos complejos que forman materiales estructurales clave en los tejidos de sostén de la mayoría de las plantas. [1] Las ligninas son particularmente importantes en la formación de las paredes celulares , especialmente en la madera y la corteza , porque aportan rigidez y no se pudren fácilmente. Químicamente, las ligninas son polímeros formados mediante la reticulación de precursores fenólicos . [2]
La lignina fue mencionada por primera vez en 1813 por el botánico suizo AP de Candolle , quien la describió como un material fibroso, insípido, insoluble en agua y alcohol pero soluble en soluciones alcalinas débiles, y que puede precipitarse de la solución utilizando ácido. [3] Llamó a la sustancia "lignina", que se deriva de la palabra latina lignum , [4] que significa madera. Es uno de los polímeros orgánicos más abundantes en la Tierra , superado solo por la celulosa y la quitina . La lignina constituye el 30% del carbono orgánico no fósil terrestre [5] en la Tierra, y del 20 al 35% de la masa seca de la madera. [6]
La lignina está presente en las algas rojas , lo que sugiere que el ancestro común de las plantas y las algas rojas también sintetizaba lignina. Este hallazgo también sugiere que la función original de la lignina era estructural, ya que desempeña este papel en el alga roja Calliarthron , donde sostiene las uniones entre los segmentos calcificados . [7]
La composición de la lignina varía de una especie a otra. Un ejemplo de composición de una muestra de álamo temblón [8] es 63,4 % de carbono, 5,9 % de hidrógeno, 0,7 % de cenizas (componentes minerales) y 30 % de oxígeno (por diferencia), [9] que corresponde aproximadamente a la fórmula (C 31 H 34 O 11 ) n .
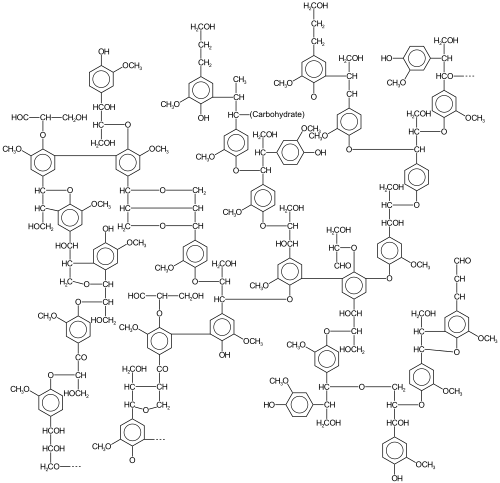
La lignina es un conjunto de polímeros altamente heterogéneos derivados de un puñado de lignol precursores. La heterogeneidad surge de la diversidad y el grado de reticulación entre estos lignol. Los lignol que se reticulan son de tres tipos principales, todos derivados del fenilpropano: alcohol coniferílico (3-metoxi-4-hidroxifenilpropano; su radical, G, a veces se denomina guayacil), alcohol sinapílico (3,5-dimetoxi-4-hidroxifenilpropano; su radical, S, a veces se denomina siringilo) y alcohol paracumarílico (4-hidroxifenilpropano; su radical, H, a veces se denomina 4-hidroxifenil). [ cita requerida ]
Las cantidades relativas de los "monómeros" precursores (lignoles o monolignoles) varían según la fuente vegetal. [5] Las ligninas se clasifican típicamente según su proporción siringilo/guaiacilo (S/G). La lignina de las gimnospermas se deriva del alcohol coniferílico , que da lugar a G tras la pirólisis. En las angiospermas , parte del alcohol coniferílico se convierte en S. Por lo tanto, la lignina en las angiospermas tiene componentes tanto G como S. [10] [11]
La lignina tiene una masa molecular superior a 10.000 u . Es hidrófoba , ya que es rica en subunidades aromáticas . El grado de polimerización es difícil de medir, ya que el material es heterogéneo. Se han descrito diferentes tipos de lignina en función del medio de aislamiento. [12]

Muchas gramíneas tienen principalmente G, mientras que algunas palmas tienen principalmente S. [13] Todas las ligninas contienen pequeñas cantidades de monolignoles incompletos o modificados, y otros monómeros son prominentes en plantas no leñosas. [14]
La lignina llena los espacios en la pared celular entre los componentes de celulosa , hemicelulosa y pectina , especialmente en los tejidos vasculares y de soporte: traqueidas del xilema , elementos vasculares y células esclereidas . [ cita requerida ]
La lignina desempeña un papel crucial en la conducción de agua y nutrientes acuosos en los tallos de las plantas . Los componentes polisacáridos de las paredes celulares de las plantas son altamente hidrófilos y, por lo tanto, permeables al agua, mientras que la lignina es más hidrófoba . La reticulación de los polisacáridos por la lignina es un obstáculo para la absorción de agua en la pared celular. Por lo tanto, la lignina hace posible que el tejido vascular de la planta conduzca el agua de manera eficiente. [15] La lignina está presente en todas las plantas vasculares , pero no en las briofitas , lo que respalda la idea de que la función original de la lignina estaba restringida al transporte de agua.
Está unido covalentemente a la hemicelulosa y por tanto reticula diferentes polisacáridos vegetales , confiriendo resistencia mecánica a la pared celular y por extensión a la planta en su conjunto. [16] Su función más comúnmente señalada es el soporte a través del fortalecimiento de la madera (compuesta principalmente por células de xilema y fibras de esclerénquima lignificadas ) en plantas vasculares. [17] [18] [19]
Por último, la lignina también confiere resistencia a las enfermedades al acumularse en el sitio de infiltración del patógeno, lo que hace que la célula vegetal sea menos accesible a la degradación de la pared celular. [20]

La producción comercial mundial de lignina es una consecuencia de la fabricación de papel. En 1988, se produjeron más de 220 millones de toneladas de papel en todo el mundo. [21] Gran parte de este papel estaba deslignificado; la lignina comprende aproximadamente 1/3 de la masa de la lignocelulosa, el precursor del papel. La lignina es un impedimento para la fabricación de papel, ya que es coloreada, amarillea en el aire y su presencia debilita el papel. Una vez separada de la celulosa, se quema como combustible. Solo una fracción se utiliza en una amplia gama de aplicaciones de bajo volumen donde la forma, pero no la calidad, es importante. [22]
La pulpa mecánica o de alto rendimiento , que se utiliza para fabricar papel de periódico , todavía contiene la mayor parte de la lignina presente originalmente en la madera. Esta lignina es responsable del amarilleo del papel de periódico con el paso del tiempo. [4] El papel de alta calidad requiere la eliminación de la lignina de la pulpa. Estos procesos de deslignificación son tecnologías fundamentales de la industria papelera, así como la fuente de importantes preocupaciones ambientales. [ cita requerida ]
En la pulpa de sulfito , la lignina se elimina de la pulpa de madera como lignosulfonatos , para los cuales se han propuesto muchas aplicaciones. [23] Se utilizan como dispersantes , humectantes , estabilizadores de emulsiones y secuestrantes ( tratamiento de agua ). [24] El lignosulfonato también fue la primera familia de reductores de agua o superplastificantes que se agregó en la década de 1930 como aditivo al hormigón fresco para disminuir la relación agua-cemento ( a/c ), el principal parámetro que controla la porosidad del hormigón y, por lo tanto, su resistencia mecánica , su difusividad y su conductividad hidráulica , todos parámetros esenciales para su durabilidad. Tiene aplicación en agentes de supresión de polvo ambientalmente sostenibles para carreteras. Además, la lignina se puede utilizar para fabricar plástico biodegradable junto con celulosa como una alternativa a los plásticos hechos con hidrocarburos si la extracción de lignina se logra a través de un proceso ambientalmente más viable que la fabricación de plástico genérico. [25]
La lignina extraída mediante el proceso kraft suele quemarse para aprovechar su valor como combustible, lo que proporciona energía para alimentar la fábrica de papel. Existen dos procesos comerciales para eliminar la lignina del licor negro para usos de mayor valor: LignoBoost (Suecia) y LignoForce (Canadá). La lignina de mayor calidad presenta el potencial de convertirse en una fuente renovable de compuestos aromáticos para la industria química, con un mercado potencial de más de 130 000 millones de dólares. [26]
Dado que es el biopolímero más frecuente después de la celulosa , la lignina se ha investigado como materia prima para la producción de biocombustibles y puede convertirse en un extracto vegetal crucial en el desarrollo de una nueva clase de biocombustibles. [27] [28]
La biosíntesis de la lignina comienza en el citosol con la síntesis de monolignoles glicosilados a partir del aminoácido fenilalanina . Estas primeras reacciones se comparten con la vía de los fenilpropanoides . La glucosa adherida los vuelve solubles en agua y menos tóxicos . Una vez transportados a través de la membrana celular hasta el apoplasto , la glucosa se elimina y comienza la polimerización. [29] Gran parte de su anabolismo no se entiende incluso después de más de un siglo de estudio. [5]

La etapa de polimerización , que es un acoplamiento radical-radical, está catalizada por enzimas oxidativas . Tanto las enzimas peroxidasa como lacasa están presentes en las paredes celulares de las plantas , y no se sabe si uno o ambos de estos grupos participan en la polimerización. También podrían estar involucrados oxidantes de bajo peso molecular. La enzima oxidativa cataliza la formación de radicales monolignol . A menudo se dice que estos radicales experimentan un acoplamiento no catalizado para formar el polímero de lignina . [30] Una teoría alternativa invoca un control biológico no especificado. [1]
A diferencia de otros biopolímeros (por ejemplo, proteínas, ADN e incluso celulosa), la lignina resiste la degradación. Es inmune a la hidrólisis catalizada tanto por ácidos como por bases. La degradabilidad varía según la especie y el tipo de tejido vegetal. Por ejemplo, la lignina siringílica (S) es más susceptible a la degradación por descomposición fúngica, ya que tiene menos enlaces arilo-arilo y un potencial redox menor que las unidades de guayacilo. [31] [32] Debido a que está reticulada con los demás componentes de la pared celular, la lignina minimiza la accesibilidad de la celulosa y la hemicelulosa a las enzimas microbianas, lo que conduce a una digestibilidad reducida de la biomasa. [15]
Algunas enzimas ligninolíticas incluyen hemo peroxidasas como las peroxidasas de lignina , peroxidasas de manganeso , peroxidasas versátiles y peroxidasas decolorantes de tintes , así como lacasas a base de cobre . Las peroxidasas de lignina oxidan la lignina no fenólica, mientras que las peroxidasas de manganeso solo oxidan las estructuras fenólicas. Las peroxidasas decolorantes de tintes, o DyPs, exhiben actividad catalítica en una amplia gama de compuestos modelo de lignina, pero su sustrato in vivo es desconocido. En general, las lacasas oxidan sustratos fenólicos, pero se ha demostrado que algunas lacasas fúngicas oxidan sustratos no fenólicos en presencia de mediadores redox sintéticos. [33] [34]
En Phanerochaete chrysosporium [35] y otros hongos de podredumbre blanca se encuentran enzimas ligninolíticas bien estudiadas . Algunos hongos de podredumbre blanca, como Ceriporiopsis subvermispora , pueden degradar la lignina en la lignocelulosa , pero otros carecen de esta capacidad. La mayor parte de la degradación de lignina por hongos implica peroxidasas secretadas . También se secretan muchas lacasas fúngicas , que facilitan la degradación de compuestos fenólicos derivados de la lignina, aunque también se han descrito varias lacasas fúngicas intracelulares. Un aspecto importante de la degradación de lignina por hongos es la actividad de las enzimas accesorias para producir el H 2 O 2 necesario para la función de la peroxidasa de lignina y otras peroxidasas de hemo . [33]
Las bacterias carecen de la mayoría de las enzimas empleadas por los hongos para degradar la lignina, y los derivados de la lignina (ácidos alifáticos, furanos y fenólicos solubilizados) inhiben el crecimiento de las bacterias. [36] Sin embargo, la degradación bacteriana puede ser bastante extensa, [37] especialmente en sistemas acuáticos como lagos, ríos y arroyos, donde los aportes de material terrestre (por ejemplo, hojarasca ) pueden ingresar a los cursos de agua. La actividad ligninolítica de las bacterias no se ha estudiado ampliamente a pesar de que se describió por primera vez en 1930. Se han caracterizado muchas DyP bacterianas. Las bacterias no expresan ninguna de las peroxidasas de tipo vegetal (lignina peroxidasa, Mn peroxidasa o peroxidasas versátiles), pero tres de las cuatro clases de DyP solo se encuentran en bacterias. A diferencia de los hongos, la mayoría de las enzimas bacterianas involucradas en la degradación de la lignina son intracelulares, incluidas dos clases de DyP y la mayoría de las lacasas bacterianas. [34]
En el medio ambiente, la lignina se puede degradar bióticamente a través de bacterias o abióticamente a través de alteración fotoquímica, y muchas veces esta última ayuda en la primera. [38] Además de la presencia o ausencia de luz, varios factores ambientales afectan la biodegradabilidad de la lignina, incluida la composición de la comunidad bacteriana, las asociaciones minerales y el estado redox. [39] [40]
En los gusanos de barco , la lignina que ingieren es digerida por bacterias simbiontes del " subgrupo similar a Alteromonas " en el subórgano tiflosol de su ciego . [41]
La pirólisis de la lignina durante la combustión de madera o la producción de carbón produce una gama de productos, de los cuales los más característicos son los fenoles metoxi -sustituidos . De ellos, los más importantes son el guayacol y el siringol y sus derivados. Su presencia puede utilizarse para rastrear una fuente de humo hasta un fuego de leña. En la cocina , la lignina en forma de madera dura es una fuente importante de estos dos compuestos, que imparten el aroma y el sabor característicos a los alimentos ahumados como la barbacoa . Los principales compuestos de sabor del jamón ahumado son el guayacol y sus derivados 4-, 5- y 6-metil, así como el 2,6-dimetilfenol. Estos compuestos se producen por descomposición térmica de la lignina en la madera utilizada en el ahumadero. [42]
El método convencional para cuantificar la lignina en la industria de la pulpa es la prueba de lignina Klason y lignina soluble en ácido, que son procedimientos estandarizados. La celulosa se digiere térmicamente en presencia de ácido. El residuo se denomina lignina Klason. La lignina soluble en ácido (ASL) se cuantifica por la intensidad de su espectroscopia ultravioleta . La composición de carbohidratos también se puede analizar a partir de los licores Klason, aunque puede haber productos de degradación de azúcar (furfural y 5-hidroximetilfurfural ). [43]
Para la detección de lignina se utiliza una solución de ácido clorhídrico y floroglucinol (prueba de Wiesner). Se desarrolla un color rojo brillante debido a la presencia de grupos coniferaldehído en la lignina. [44]
La tioglicólisis es una técnica analítica para la cuantificación de la lignina . [45] La estructura de la lignina también se puede estudiar mediante simulación computacional. [46]
La termoquimiolisis (descomposición química de una sustancia al vacío y a alta temperatura) con hidróxido de tetrametilamonio (TMAH) u óxido cúprico [47] también se ha utilizado para caracterizar las ligninas. La proporción de siringil lignol (S) a vanillil lignol (V) y de cinamil lignol (C) a vanillil lignol (V) es variable según el tipo de planta y, por lo tanto, se puede utilizar para rastrear las fuentes de las plantas en los sistemas acuáticos (leñosas frente a no leñosas y angiospermas frente a gimnospermas). [48] Las proporciones de las formas de ácido carboxílico (Ad) a aldehído (Al) de los lignol (Ad/Al) revelan información diagenética, y las proporciones más altas indican un material más degradado. [31] [32] Los aumentos en el valor (Ad/Al) indican que se ha producido una reacción de escisión oxidativa en la cadena lateral de lignina alquílica, que se ha demostrado que es un paso en la descomposición de la madera por muchos hongos de podredumbre blanca y algunos hongos de podredumbre blanda . [31] [32] [49] [50] [51]
La lignina y sus modelos han sido bien estudiados mediante espectroscopia de RMN de 1H y 13C . Debido a la complejidad estructural de las ligninas, los espectros tienen una resolución deficiente y la cuantificación es un desafío. [52]