Las epotilonas son una clase de posibles fármacos contra el cáncer. Al igual que los taxanos , impiden que las células cancerosas se dividan al interferir con la tubulina , pero en los primeros ensayos, las epotilonas tienen una mayor eficacia y efectos adversos más leves que los taxanos. [1] [2]
Las epotilonas se identificaron originalmente como metabolitos producidos por la mixobacteria que habita en el suelo Sorangium cellulosum . [3] A partir de septiembre de 2008 [actualizar], se identificaron y caracterizaron las epotilonas A a F. [4]
Los primeros estudios en líneas celulares cancerosas y pacientes humanos con cáncer indican una eficacia superior a la de los taxanos . Su mecanismo de acción es similar, pero su estructura química es más simple. Debido a su mejor solubilidad en agua, no se necesitan cremóforos (agentes solubilizantes utilizados para el paclitaxel que pueden afectar la función cardíaca y causar hipersensibilidad grave). [5] Las propiedades similares a las endotoxinas conocidas del paclitaxel, como la activación de los macrófagos que sintetizan citocinas inflamatorias y óxido nítrico, no se observan en el epotilona B. [6]
La estructura del epotilona A se determinó en 1996 mediante cristalografía de rayos X. [7]
El principal mecanismo de acción de la clase de epotilona es la inhibición de la función de los microtúbulos . [8] Los microtúbulos son esenciales para la división celular y, por lo tanto, las epotilonas impiden que las células se dividan adecuadamente. La epotilona B posee los mismos efectos biológicos que el paclitaxel tanto in vitro como en células cultivadas. Esto se debe a que comparten el mismo sitio de unión, así como la misma afinidad de unión con el microtúbulo. Al igual que el paclitaxel, la epotilona B se une a la subunidad heterodímera de la αβ-tubulina. Una vez unida, la tasa de disociación de la αβ-tubulina disminuye, estabilizando así los microtúbulos. Además, también se ha demostrado que la epotilona B induce la polimerización de la tubulina en microtúbulos sin la presencia de GTP. Esto es causado por la formación de haces de microtúbulos en todo el citoplasma. Finalmente, la epotilona B también provoca la detención del ciclo celular en la fase de transición G2-M, lo que conduce a la citotoxicidad y, finalmente, a la apoptosis celular. [9] La capacidad del epotilona para inhibir la función del huso mitótico se atribuye generalmente a su supresión de la dinámica de los microtúbulos; [10] pero estudios recientes han demostrado que la supresión de la dinámica se produce en concentraciones inferiores a las necesarias para bloquear la mitosis. En concentraciones antimitóticas más altas, el paclitaxel parece actuar suprimiendo el desprendimiento de los microtúbulos de los centrosomas, un proceso que normalmente se activa durante la mitosis. Es muy posible que el epotilona también pueda actuar a través de un mecanismo similar. [11]
La epotilona D, con el nombre genérico de utidelona , fue aprobada en China en 2021 para el tratamiento del cáncer de mama metastásico . [12] [13] La utidelona ha demostrado beneficios en un ensayo de fase III sobre cáncer de mama cuando se agrega a la capecitabina . [14]
En octubre de 2007, la Administración de Alimentos y Medicamentos de los Estados Unidos aprobó un análogo sintético, la ixabepilona , para su uso en el tratamiento del cáncer de mama metastásico agresivo o localmente avanzado que ya no responde a las quimioterapias disponibles en la actualidad. [15] En noviembre de 2008, la EMEA rechazó una autorización de comercialización para la ixabepilona. [16]
Se ha demostrado que la epotilona B, cuyo nombre genérico es patupilona, contiene potentes actividades anticancerígenas in vivo en niveles de dosis tolerados en varios modelos de xenoinjerto humano. [17] Como resultado, la patupilona y varios análogos atravesaron varias fases clínicas.
La patupilona y la sagopilona totalmente sintética se probaron en ensayos de fase II y el BMS-310705 se probó en ensayos de fase I. La patupilona fracasó en un ensayo de fase III para el cáncer de ovario en 2010. [18]
Se han anunciado los resultados de un ensayo de fase III con ixabepilona (BMS-247550) en combinación con capecitabina en el cáncer de mama metastásico (2007, que condujo a la aprobación de la FDA). [19]
Debido a la alta potencia y la necesidad clínica de los tratamientos contra el cáncer, las epotilonas han sido el objetivo de muchas síntesis totales . [20] El primer grupo en publicar la síntesis total de epotilonas fue SJ Danishefsky et al. en 1996. [9] [21] Esta síntesis total de epotilona A se logró mediante una condensación intramolecular de enolato de éster-aldehído. Nicolaou , [22] Schinzer, [23] Mulzer , [24] y Carreira han publicado otras síntesis de epotilonas . [25] En este enfoque, se construyeron bloques de construcción clave aldehído , glicidoles y cetoácido y se acoplaron al precursor de metátesis de olefina mediante una reacción aldólica y luego un acoplamiento de esterificación . Se empleó el catalizador de Grubbs para cerrar la olefina bis terminal del compuesto precursor. Los compuestos resultantes fueron isómeros cis- y trans-macrocíclicos con estereocentros distintos . La epoxidación de olefinas cis y trans produce epotilona A y sus análogos.
A continuación se describe una de las síntesis totales de epotilona B, descrita por el laboratorio de KC Nicolaou . [26] El análisis retrosintético reveló que 1 , 2 y 3 son los bloques de construcción (Figura 1).
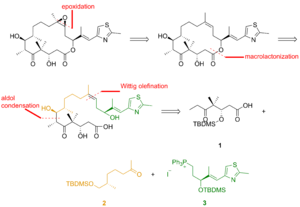
Como se ve en la Figura 2, el ácido ceto 1 se generó a partir del aldehído ceto que se convirtió en el éter sililo a través de la alilboración asimétrica y la sililación del alcohol resultante. La ozonólisis del éter sililo y la oxidación de Lindgren - Pinnick del aldehído proporcionaron el ácido ceto. La cetona 2 se construyó a través de la alquilación de Enders a partir de la hidrazona. La ozonólisis, el último paso de la alquilación de Enders, fue seguida por la reducción del aldehído y la sililación del alcohol resultante. La hidrogenólisis del éter bencílico dio el alcohol, que se oxidó bajo la condición de Swern y se alquiló con el reactivo de Grignard para producir el alcohol secundario. La oxidación de este alcohol con el reactivo de Ley-Griffith dio la cetona deseada. El tiazol 3 se sintetizó a partir del éster, que se redujo con hidruro de diisobutilaluminio , y el aldehído se hizo reaccionar con el iluro estabilizado en la reacción de Wittig . La alilboración asimétrica del aldehído α,β-insaturado y la protección del grupo hidroxilo dieron lugar al éter silícico, cuya olefina terminal se hizo reaccionar con tetróxido de osmio para formar un diol que se escindió con tetraacetato de plomo para formar el aldehído. La reducción, la yodación y el tratamiento con trifenilfosfina dieron lugar a la sal de fosfonio.
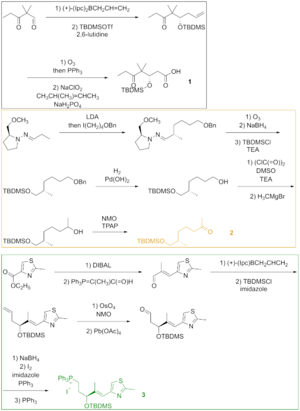
Los fragmentos 1 , 2 y 3 se hicieron reaccionar entre sí para obtener epotilona B mediante un método que incluía la reacción de Wittig , la reacción aldólica y la esterificación de Yamaguchi (Figura 3). Se utilizó cromatografía de capa fina preparativa para separar los diastereómeros.

La epotilona B es una macrolactona policétida de 16 miembros con un grupo metiltiazol conectado al macrociclo por un enlace olefínico. La cadena principal del policétido fue sintetizada por la policétido sintasa tipo I (PKS) y el anillo tiazol se derivó de una cisteína incorporada por una sintetasa de péptidos no ribosómicos (NRPS). En esta biosíntesis, tanto la PKS como la NRPS utilizan proteínas transportadoras , que han sido modificadas postraduccionalmente por grupos fosfopanteteína , para unirse a la cadena en crecimiento. La PKS utiliza el tioéster de la coenzima A para catalizar la reacción y modificar los sustratos reduciendo selectivamente el β carbonilo al hidroxilo (cetorreductasa, KR), el alqueno (deshidratasa, DH) y el alcano (enoil reductasa, ER). La PKS-I también puede metilar el carbono α del sustrato. Por otro lado, la NRPS utiliza aminoácidos activados en la enzima como adenilatos de aminoacilo. A diferencia de la PKS, en la enzima NRPS se produce epimerización , N-metilación y formación de heterociclos. [27]

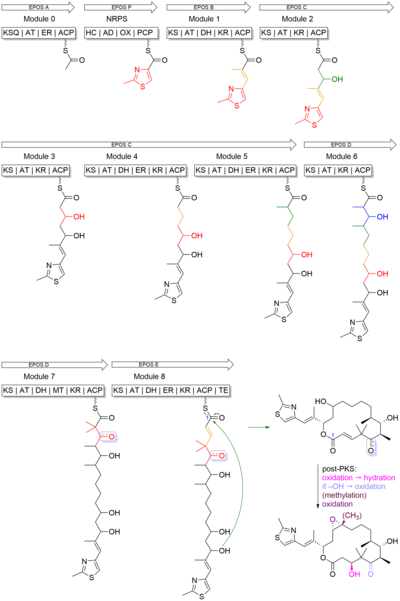
La epotilona B comienza con una unidad de inicio de 2-metil-4-carboxitiazol, que se formó a través del acoplamiento traduccional entre PKS, módulo EPOS A (epoA), y NRPS, módulo EPOS P(epoP). La EPOS A contiene una β-cetoacil-sintasa modificada (malonil-ACP descarboxilasa, KSQ), una aciltransferasa (AT), una enoil reductasa (ER) y un dominio de proteína transportadora de acilo (ACP). Sin embargo, la EPOS P contiene una heterocilación, una adenilación, una oxidasa y un dominio de tiolación. Estos dominios son importantes porque están involucrados en la formación del anillo heterocíclico de cinco miembros del tiazol. Como se ve en la Figura 4 , la EPOS P activa la cisteína y se une a la cisteína activada como un aminoacil-S-PCP. Una vez que se ha unido la cisteína, EPOS A carga una unidad de acetato en el complejo EPOS P, iniciando así la formación del anillo de tiazolina por ciclodeshidratación intramolecular. [27]
Una vez que se ha formado el anillo de 2-metiltiazol, se transfiere a las PKS EPOS B (epoB), EPOS C (epoC), EPOS D (epoD), EPOS E (epoE) y EPOS F (epoF) para su posterior elongación y modificación para generar el enlace olefínico, el anillo de 16 miembros y el epóxido, como se ve en la Figura 5. Una cosa importante a destacar es la síntesis de la unidad gem-dimetil en el módulo 7. Estos dos dimetilos no se sintetizaron mediante dos C-metilaciones sucesivas. En cambio, uno de los grupos metilo se derivó de la unidad extensora propionato, mientras que el segundo grupo metilo se integró mediante un dominio C-metil-transferasa. [27]