
Una célula T citotóxica (también conocida como T C , linfocito T citotóxico , CTL , célula T asesina , célula T citolítica , célula T CD8 + o célula T asesina ) es un linfocito T (un tipo de glóbulo blanco ) que mata células cancerosas , células infectadas por patógenos intracelulares (como virus o bacterias) o células dañadas de otras formas. [1]
La mayoría de las células T citotóxicas expresan receptores de células T (TCR) que pueden reconocer un antígeno específico . Un antígeno es una molécula capaz de estimular una respuesta inmune y, a menudo, es producido por células cancerosas , virus, bacterias o señales intracelulares. Los antígenos dentro de una célula están unidos a moléculas MHC de clase I y la molécula MHC de clase I los lleva a la superficie de la célula, donde pueden ser reconocidos por las células T. Si el TCR es específico para ese antígeno, se une al complejo de la molécula MHC de clase I y el antígeno, y la célula T destruye la célula.
Para que el TCR se una a la molécula del MHC de clase I, el primero debe ir acompañado de una glicoproteína llamada CD8 , que se une a la porción constante de la molécula del MHC de clase I. Por tanto, estas células T se denominan células T CD8 + .
La afinidad entre CD8 y la molécula MHC mantiene la célula T C y la célula diana unidas estrechamente durante la activación específica del antígeno. Las células T CD8 + se reconocen como células T C una vez que se activan y generalmente se clasifican como que tienen una función citotóxica predefinida dentro del sistema inmunológico. Sin embargo, las células T CD8 + también tienen la capacidad de producir algunas citoquinas , como TNF-α e IFN-γ , con efectos antitumorales y antimicrobianos.

El sistema inmunológico debe reconocer millones de antígenos potenciales. Hay menos de 30.000 genes en el cuerpo humano, por lo que es imposible tener un gen para cada antígeno. En cambio, el ADN de millones de glóbulos blancos en la médula ósea se mezcla para crear células con receptores únicos, cada uno de los cuales puede unirse a un antígeno diferente. Algunos receptores se unen a los tejidos del propio cuerpo humano, por lo que para evitar que el cuerpo se ataque a sí mismo, esos glóbulos blancos autorreactivos se destruyen durante el desarrollo posterior en el timo , en el que el yodo es necesario para su desarrollo y actividad. [2]
Los TCR tienen dos partes, normalmente una cadena alfa y una beta. (Algunos TCR tienen una cadena gamma y una delta. Son inherentes a actuar contra el estrés y forman parte de la barrera epitelial [3] ). Las células madre hematopoyéticas de la médula ósea migran al timo , donde se someten a una recombinación V(D)J de su ADN TCR de cadena beta para formar una forma de desarrollo de la proteína TCR, conocida como pre-TCR. Si esa reordenación tiene éxito, las células reorganizan su ADN TCR de cadena alfa para crear un complejo TCR alfa-beta funcional. Este producto de reordenamiento genético altamente variable en los genes TCR ayuda a crear millones de células T diferentes con diferentes TCR, lo que ayuda al sistema inmunológico del cuerpo a responder prácticamente a cualquier proteína de un invasor. La gran mayoría de las células T expresan TCR alfa-beta (células T αβ), pero algunas células T en tejidos epiteliales (como el intestino) expresan TCR gamma-delta ( células T gamma delta ), que reconocen antígenos no proteicos. Estos últimos se caracterizan por su capacidad de reconocer antígenos que no se presentan. Además, pueden reconocer proteínas de choque tóxicas microbianas y proteínas de estrés autocelulares. [4] Las células T γδ poseen una amplia plasticidad funcional después de reconocer células infectadas o transformadas, ya que son capaces de producir citocinas (IFN-γ, TNF-α, IL-17) y quimiocinas (IP-10, linfotactina), desencadenando la citólisis. de células diana (perforinas, granzimas...), e interactúan con otras células, como células epiteliales, monocitos, células dendríticas, neutrófilos y células B. En algunas infecciones, como el citomegalovirus humano , hay una expansión clonal de células T γδ periféricas que tienen TCR específicos, lo que indica la naturaleza adaptativa de la respuesta inmune mediada por estas células. [5]
Las células T con TCR funcionalmente estables expresan los correceptores CD4 y CD8 y, por lo tanto, se denominan células T "doble positivas" (DP) (CD4 + CD8 + ). Las células T doblemente positivas están expuestas a una amplia variedad de autoantígenos en el timo y se someten a dos criterios de selección:
Sólo se seleccionan positivamente aquellas células T que se unen débilmente a los complejos MHC-antígeno propio. Aquellas células que sobreviven a la selección positiva y negativa se diferencian en células T positivas únicas (CD4 + o CD8 + ), dependiendo de si su TCR reconoce un antígeno presentado por el MHC de clase I (CD8) o un antígeno presentado por el MHC de clase II (CD4). ). Son las células T CD8 + las que madurarán y se convertirán en células T citotóxicas tras su activación con un antígeno restringido de clase I.
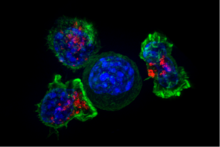
Las células T pasan por diferentes etapas, dependiendo del número de veces que han estado en contacto con el antígeno. En primer lugar, los linfocitos T vírgenes son aquellas células que aún no han encontrado un antígeno en el timo. Luego, los linfocitos T se convierten en células T de memoria. Este tipo de células T son aquellas que han estado en contacto con el antígeno al menos una vez pero han vuelto posteriormente a un estado quiescente o inactivo, listas para responder nuevamente al antígeno contra el que fueron estimuladas. Finalmente, cuando se desencadena la respuesta inmune específica, estas células T vírgenes y de memoria se activan, dando lugar a células T efectoras que tienen capacidad de matar patógenos o células tumorales. [6] [7]
El umbral para la activación de estas células es muy alto y el proceso puede ocurrir a través de dos vías: independiente del timo (por las APC infectadas ) o dependiente del timo (por las células T CD4+ ). En la vía independiente del timo, debido a que la APC está infectada, está altamente activada y expresa una gran cantidad de correceptores para la coactivación. Si las APC no están infectadas, es necesario involucrar a las células CD4: ya sea para activar las APC mediante coestimulación (más común) o para activar directamente las células Tc mediante la secreción de IL-2 .
Si se produce la activación, el linfocito polariza sus gránulos hacia el lugar de la sinapsis y los libera, produciendo un "golpe letal". En este punto, se separa de la celda objetivo y puede pasar a otra y a otra. La célula diana muere en aproximadamente 6 horas, generalmente por apoptosis. [8]
El MHC de clase I lo expresan todas las células huésped , excepto las no nucleadas , como los eritrocitos . Cuando estas células se infectan con un patógeno intracelular , las células degradan proteínas extrañas mediante el procesamiento de antígenos . Estos dan como resultado fragmentos peptídicos, algunos de los cuales son presentados por el MHC Clase I al receptor de antígeno de células T (TCR) en las células T CD8 + .
La activación de las células T citotóxicas depende de varias interacciones simultáneas entre moléculas expresadas en la superficie de las células T y moléculas en la superficie de la célula presentadora de antígeno (APC). Por ejemplo, considere el modelo de dos señales para la activación de células T C.
Una simple activación de células T CD8 + vírgenes requiere la interacción con células presentadoras de antígenos profesionales, principalmente con células dendríticas maduras . Para generar células T con memoria duradera y permitir la estimulación repetitiva de las células T citotóxicas, las células dendríticas tienen que interactuar tanto con las células T auxiliares CD4 + activadas como con las células T CD8 + . [9] [7] Durante este proceso, las células T auxiliares CD4 + "autorizan" a las células dendríticas para dar una potente señal de activación a las células T CD8 + vírgenes . [10]
Además, la maduración de las células T CD8 + está mediada por la señalización de CD40 . [11] Una vez que la célula T CD8 + vírgenes se une a la célula infectada, se activa a la célula infectada para que libere CD40. [11] Esta liberación de CD40, con la ayuda de células T auxiliares, desencadenará la diferenciación de las células T CD8 + vírgenes en células T CD8 + maduras. [11]
Si bien en la mayoría de los casos la activación depende del reconocimiento del antígeno por parte del TCR, se han descrito vías alternativas para la activación. Por ejemplo, se ha demostrado que las células T citotóxicas se activan cuando son atacadas por otras células T CD8, lo que conduce a la tolerización de estas últimas. [12]
Una vez activadas, las células T C experimentan una expansión clonal con la ayuda de la citoquina interleucina 2 (IL-2), que es un factor de crecimiento y diferenciación de las células T. Esto aumenta la cantidad de células específicas para el antígeno objetivo que luego pueden viajar por todo el cuerpo en busca de células somáticas positivas para el antígeno .
Cuando se exponen a células somáticas infectadas/disfuncionales, las células T C liberan citotoxinas perforina , granzimas y granulisina . A través de la acción de la perforina, las granzimas ingresan al citoplasma de la célula diana y su función de serina proteasa desencadena la cascada de caspasas , que es una serie de cisteína proteasas que eventualmente conducen a la apoptosis (muerte celular programada). Esto se denomina "golpe letal" y permite observar una muerte ondulatoria de las células diana. [13] Debido al alto orden de lípidos y a la fosfatidilserina cargada negativamente presente en su membrana plasmática, las células T C son resistentes a los efectos de sus citotoxinas perforina y granzima [14]
Una segunda forma de inducir la apoptosis es mediante la interacción de la superficie celular entre el T C y la célula infectada. Cuando se activa un T C , comienza a expresar el ligando FAS de la proteína de superficie (FasL)(Apo1L)(CD95L), que puede unirse a las moléculas de Fas (Apo1)(CD95) expresadas en la célula diana. Sin embargo, se cree que esta interacción Fas-ligando Fas es más importante para la eliminación de linfocitos T no deseados durante su desarrollo o para la actividad lítica de ciertas células TH que para la actividad citolítica de las células efectoras T C. La interacción de Fas con FasL permite el reclutamiento del complejo de señalización inducida por muerte (DISC). [15] El dominio de muerte asociado a Fas (FADD) se transloca con el DISC, lo que permite el reclutamiento de las procaspasas 8 y 10. [15] Estas caspasas luego activan las caspasas efectoras 3, 6 y 7, lo que lleva a la escisión de sustratos de muerte como lámina A , lámina B1, lámina B2, PARP ( poli ADP ribosa polimerasa ) y ADN-PKcs (proteína quinasa activada por ADN). El resultado final es la apoptosis de la célula que expresó Fas. Las células T CD8 también pueden mostrar muerte celular inducida por activación o AICD, que está mediada por el complejo del receptor CD3. Recientemente, se ha demostrado que una proteína TLT-1 liberada por plaquetas induce la muerte celular similar a AICD en células T CD8 [16]
Se sugiere que el factor de transcripción Eomesodermina desempeña un papel clave en la función de las células T CD8 + , actuando como un gen regulador en la respuesta inmune adaptativa. [17] Los estudios que investigaron el efecto de la pérdida de función de la eomesodermina encontraron que una disminución en la expresión de este factor de transcripción resultó en una disminución de la cantidad de perforina producida por las células T CD8 + . [17]
A diferencia de los anticuerpos , que son eficaces contra infecciones tanto virales como bacterianas , las células T citotóxicas son en su mayoría eficaces contra los virus. [18]
Durante la infección por el virus de la hepatitis B (VHB), las células T citotóxicas matan a las células infectadas y producen citoquinas antivirales capaces de purgar el VHB de los hepatocitos viables. También desempeñan un papel patogénico importante, contribuyendo a casi todas las lesiones hepáticas asociadas con la infección por VHB. [19] Se ha demostrado que las plaquetas facilitan la acumulación de células T citotóxicas específicas del virus en el hígado infectado. [20] En algunos estudios con ratones, la inyección con células T CXCR5+ CD8+ muestra una disminución significativa del HBsAg . Además, un aumento de los niveles de CXCL13 facilitó el reclutamiento de células T intrahepáticas CXCR5+CD8+ y, este tipo de células produjeron altos niveles de interferón-γ específico del VHB (IFN)-γ e IL-21 , lo que puede ayudar a mejorar el control de infección crónica por VHB. [21]
Las células T citotóxicas han sido implicadas en la progresión de la artritis . La principal afectación de la artritis reumatoide es la afectación articular. La membrana sinovial se caracteriza por hiperplasia , aumento de vascularización e infiltración de células inflamatorias; principalmente linfocitos T CD4+, que son los principales organizadores de las respuestas inmunitarias mediadas por células. En diferentes estudios, la artritis reumatoide está fuertemente relacionada con los antígenos de clase II del complejo mayor de histocompatibilidad (MHC). Las únicas células del organismo que expresan antígenos del MHC de clase II son las células constitutivas presentadoras de antígenos . Esto sugiere fuertemente que la artritis reumatoide es causada por antígenos artritogénicos no identificados. El antígeno podría ser cualquier antígeno exógeno, tal como proteínas virales o una proteína endógena. [22] Recientemente, se han identificado varios antígenos endógenos posibles, por ejemplo, la glicoproteína 39 del cartílago humano, la proteína de unión a cadena pesada y la proteína citrulinada. Los linfocitos T CD4+ activados estimulan a los monocitos, macrófagos y fibroblastos sinoviales para elaborar las citocinas interleucina-1 , interleucina-6 y factor de necrosis tumoral alfa (TNFa) y secretar metaloproteinasas. Los tres primeros son clave para impulsar la inflamación en la artritis reumatoide. Estos linfocitos activados también estimulan a las células B para que produzcan inmunoglobulinas, incluido el factor reumatoide. [23] Se desconoce su papel patogénico, pero puede deberse a la activación del complemento a través de la formación de complejos inmunes. Además, varios estudios en animales sugieren que las células T citotóxicas pueden tener un efecto predominantemente proinflamatorio en la enfermedad. También se estudia que la producción de citoquinas por parte de las células CD8+ puede acelerar el progreso de la enfermedad de la artritis. [24]
Se ha descubierto que las células T CD8 + desempeñan un papel en la infección por VIH . Con el tiempo, el VIH ha desarrollado muchas estrategias para evadir el sistema inmunológico de la célula huésped. Por ejemplo, el VIH ha adoptado tasas de mutación muy altas para permitirles escapar al reconocimiento de las células T CD8 + . [25] También son capaces de regular negativamente la expresión de las proteínas MHC Clase I de superficie de las células que infectan, para evadir aún más la destrucción por parte de las células T CD8 + . [25] Si las células T CD8 + no pueden encontrar, reconocer y unirse a las células infectadas, el virus no será destruido y continuará creciendo.
Además, las células T CD8 + pueden estar implicadas en la diabetes tipo 1 . [26] Los estudios en un modelo de ratón diabético demostraron que las células CD4+ son responsables de la infiltración masiva de leucocitos mononucleares en los islotes pancreáticos . Sin embargo, se ha demostrado que las células CD8+ desempeñan un papel efector, responsable de la destrucción final de las células beta de los islotes. Sin embargo, en estudios con ratones NOD que portaban una mutación nula en el locus beta-2 microglobulina (B2M) y, por tanto, carecían de moléculas del complejo mayor de histocompatibilidad de clase I y de células T CD8+, se descubrió que no desarrollaban diabetes. [27]
Las células T CD8 + pueden ser necesarias para resolver la neuropatía periférica inducida por quimioterapia (CIPN). [28] [29] Los ratones sin células T CD8 + muestran CIPN prolongada en comparación con ratones normales y la inyección de células T CD8 + educadas resuelve o previene la CIPN.
Los linfocitos T citotóxicos se han implicado en el desarrollo de diversas enfermedades y trastornos, por ejemplo en el rechazo de trasplantes (los linfocitos T citotóxicos atacan al nuevo órgano tras detectarlo como extraño, debido a la variación de HLA entre donante y receptor); [30] en la producción excesiva de citocinas en la infección grave por SARS-CoV-2 (debido a una respuesta linfocitaria exagerada, se genera una gran cantidad de citocinas proinflamatorias que dañan al sujeto); [31] [32] enfermedades inflamatorias y degenerativas del sistema nervioso central, como la esclerosis múltiple (las células T se sensibilizan a ciertas proteínas, como la mielina , atacando a las células sanas y reclutando más células inmunes, agravando la enfermedad). [33]
Células T auxiliares/CD4+ •expresan glicoproteínas CD4 en su superficie celular, que se activan en presencia de antígenos peptídicos en la superficie de patógenos invasores; •responder inmediatamente para proteger el sistema inmunológico; •secretan diferentes proteínas citoquinas según la respuesta inmune.
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )