La vía de señalización del factor de crecimiento transformante beta (TGFβ) está involucrada en muchos procesos celulares tanto en el organismo adulto como en el embrión en desarrollo, incluyendo el crecimiento celular , la diferenciación celular , la migración celular, la apoptosis , la homeostasis celular y otras funciones celulares. Las vías de señalización de TGFβ están conservadas. [1] A pesar de la amplia gama de procesos celulares que regula la vía de señalización de TGFβ, el proceso es relativamente simple. Los ligandos de la superfamilia TGFβ se unen a un receptor de tipo II, que recluta y fosforila un receptor de tipo I. El receptor de tipo I luego fosforila los SMAD regulados por receptor ( R-SMAD ) que ahora pueden unirse al coSMAD SMAD4 . Los complejos R-SMAD/coSMAD se acumulan en el núcleo donde actúan como factores de transcripción y participan en la regulación de la expresión del gen diana. [2]
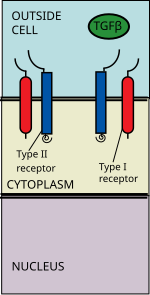
La superfamilia de ligandos TGF beta incluye: proteínas morfogenéticas óseas (BMP) , factores de crecimiento y diferenciación (GDF) , hormona antimülleriana (AMH) , activina , Nodal y TGFβ . [3] La señalización comienza con la unión de un ligando de la superfamilia TGF beta a un receptor TGF beta tipo II. El receptor tipo II es una quinasa del receptor de serina/treonina, que cataliza la fosforilación del receptor tipo I. Cada clase de ligando se une a un receptor tipo II específico. [4] En los mamíferos hay siete receptores tipo I conocidos y cinco receptores tipo II. [5]
Existen tres activinas: Activina A , Activina B y Activina AB . Las activinas participan en la embriogénesis y la osteogénesis. También regulan muchas hormonas, incluidas las hormonas hipofisarias , gonadales e hipotalámicas , así como la insulina . También son factores de supervivencia de las células nerviosas .
Las BMP se unen al receptor de proteína morfogenética ósea tipo 2 (BMPR2) y participan en una multitud de funciones celulares, entre ellas la osteogénesis, la diferenciación celular , la especificación del eje anterior/posterior, el crecimiento y la homeostasis.
La familia TGFβ incluye: TGFβ1 , TGFβ2 , TGFβ3 . Al igual que las BMP, los TGFβ no solo participan en la embriogénesis y la diferenciación celular, sino también en la apoptosis y otras funciones. Se unen al receptor de TGF-beta tipo 2 (TGFβR2).
El nodo se une al receptor de activina A, tipo IIB ( ACVR2B ). Luego puede formar un complejo receptor con el receptor de activina A, tipo IB ( ACVR1B ) o con el receptor de activina A, tipo IC ( ACVR1C ). [5]
Cuando la unión del receptor con el ligando se produce mediante una acción local, esto se clasifica como señalización paracrina .

El ligando TGF beta se une a un dímero de receptor tipo II, que recluta un dímero de receptor tipo I formando un complejo heterotetramérico con el ligando. [6] Estos receptores son receptores de serina/treonina quinasa . Tienen un dominio extracelular rico en cisteína , un dominio transmembrana y un dominio citoplasmático rico en serina/treonina. El dominio GS del receptor tipo I consta de una serie de aproximadamente treinta repeticiones de serina - glicina . [7] La unión de un ligando de la familia TGFβ provoca la rotación de los receptores de modo que sus dominios cinasa citoplasmáticos se disponen en una orientación catalíticamente favorable. El receptor tipo II fosforila residuos de serina del receptor tipo I, lo que activa la proteína.

Hay cinco SMAD regulados por receptores: SMAD1 , SMAD2 , SMAD3 , SMAD5 y SMAD9 (a veces denominado SMAD8). Básicamente, hay dos vías intracelulares que involucran a estos R-SMAD . Los TGFβ, las activinas, los nodales y algunos GDF están mediados por SMAD2 y SMAD3, mientras que las BMP, la AMH y algunos GDF están mediados por SMAD1 , SMAD5 y SMAD9 . La unión del R-SMAD al receptor de tipo I está mediada por una proteína que contiene el dominio FYVE de doble dedo de zinc . Dos de estas proteínas que median la vía TGFβ incluyen SARA (el ancla SMAD para la activación del receptor ) y HGS (sustrato de la tirosina quinasa regulada por el factor de crecimiento de los hepatocitos).
SARA está presente en un endosoma temprano que, por endocitosis mediada por clatrina , internaliza el complejo receptor. [8] SARA recluta un R-SMAD . SARA permite la unión del R-SMAD a la región L45 del receptor tipo I. [9] SARA orienta al R-SMAD de manera que el residuo de serina en su extremo C esté orientado hacia la región catalítica del receptor tipo I. El receptor tipo I fosforila el residuo de serina del R-SMAD. La fosforilación induce un cambio conformacional en el dominio MH2 del R-SMAD y su posterior disociación del complejo receptor y SARA. [10]

El RSMAD ahora fosforilado tiene una alta afinidad por el coSMAD (p. ej., SMAD4 ) y forma un complejo con uno de ellos. El grupo fosfato no actúa como un sitio de acoplamiento para el coSMAD, sino que la fosforilación abre un tramo de aminoácidos que permite la interacción.

El complejo RSMAD/coSMAD fosforilado ingresa al núcleo donde se une a los promotores/cofactores de transcripción y provoca la transcripción del ADN.
Las proteínas morfogenéticas óseas provocan la transcripción de ARNm implicados en la osteogénesis , la neurogénesis y la especificación del mesodermo ventral .
Los TGFβs provocan la transcripción de ARNm implicados en la apoptosis , la neogénesis de la matriz extracelular y la inmunosupresión . También están implicados en el arresto de G1 en el ciclo celular .
La activina provoca la transcripción de ARNm implicados en el crecimiento gonadal , la diferenciación del embrión y la formación de la placenta.
Nodal provoca la transcripción de ARNm implicados en la especificación del eje izquierdo y derecho, la inducción del mesodermo y el endodermo .
La vía de señalización del TGF beta está involucrada en una amplia gama de procesos celulares y, por lo tanto, está muy regulada. Existen diversos mecanismos en los que la vía se modula de forma positiva o negativa, incluidos los agonistas de ligandos y R-SMAD, los receptores señuelo y la ubiquitinación de R-SMAD y receptores.
Tanto la chordin como la noggin son antagonistas de las BMP. Se unen a las BMP impidiendo la unión del ligando al receptor. [11] Se ha demostrado que la chordin y la noggin dorsalizan el mesodermo . Ambas se encuentran en el labio dorsal de Xenopus y convierten tejido específico de la epidermis en tejido neural (ver neurulación ). La noggin desempeña un papel clave en la formación de patrones de cartílago y hueso. Los ratones Noggin-/- tienen exceso de cartílago y carecen de formación de articulaciones. [11]
Los miembros de la familia de proteínas DAN también antagonizan a los miembros de la familia TGF beta. Entre ellos se encuentran Cerberus , DAN y Gremlin . Estas proteínas contienen nueve cisteínas conservadas que pueden formar puentes disulfuro. Se cree que DAN antagoniza a GDF5 , GDF6 y GDF7 .
La folistatina inhibe la activina, a la que se une. Afecta directamente la secreción de la hormona folículo estimulante (FSH). La folistatina también está implicada en los cánceres de próstata, donde las mutaciones en su gen pueden impedir que actúe sobre la activina, que tiene propiedades antiproliferativas. [11]
Lefty es un regulador de TGFβ y está involucrado en la formación de patrones axiales durante la embriogénesis. También es miembro de la superfamilia de proteínas TGF. Se expresa asimétricamente en el lado izquierdo de los embriones murinos y, posteriormente, desempeña un papel en la especificación izquierda-derecha. Lefty actúa impidiendo la fosforilación de R-SMAD. Lo hace a través de un receptor de tipo I de TGFβ constitutivamente activo y a través de un proceso posterior a su activación. [12]
También se han identificado antagonistas basados en fármacos, como SB431542, [13] que inhibe selectivamente ALK4, ALK5 y ALK7.
El receptor 3 del factor de crecimiento transformante (TGFβR3) es el más abundante de los receptores de TGF-β hasta el momento, [14] no tiene un dominio de señalización conocido. [15] Sin embargo, puede servir para mejorar la unión de los ligandos de TGFβ a los receptores de TGFβ tipo II uniéndose a TGFβ y presentándolo a TGFβR2. Uno de los objetivos posteriores de la señalización de TGF β, GIPC , se une a su dominio PDZ, lo que evita su degradación proteosomal, lo que posteriormente aumenta la actividad de TGFβ. También puede servir como un correceptor de inhibina para ActivinRII . [11]
El inhibidor de la membrana de activina y BMP (BAMBI) tiene un dominio extracelular similar al de los receptores de tipo I. Carece de un dominio intracelular de proteína quinasa de serina/treonina y, por lo tanto, es un pseudorreceptor. Se une al receptor de tipo I impidiendo que se active. Actúa como regulador negativo de la señalización de TGFβ y puede limitar la expresión de TGFβ durante la embriogénesis. Requiere la señalización de BMP para su expresión.
FKBP12 se une a la región GS del receptor tipo I, impidiendo la fosforilación del receptor por los receptores tipo II. Se cree que FKBP12 y sus homólogos ayudan a prevenir la activación del receptor tipo I en ausencia de un ligando, ya que la unión del ligando provoca su disociación.
Existen otros dos SMAD que completan la familia SMAD, los SMAD inhibidores (I-SMADS), SMAD6 y SMAD7 . Desempeñan un papel clave en la regulación de la señalización de TGF beta y están involucrados en la retroalimentación negativa. Al igual que otros SMAD, tienen un dominio MH1 y un dominio MH2. SMAD7 compite con otros R-SMAD con el receptor de tipo I y evita su fosforilación. [11] [16] Reside en el núcleo y tras la activación del receptor TGFβ se transloca al citoplasma donde se une al receptor de tipo I. SMAD6 se une a SMAD4 impidiendo la unión de otros R-SMAD con el coSMAD. Los niveles de I-SMAD aumentan con la señalización de TGFβ, lo que sugiere que son objetivos posteriores de la señalización de TGFβ.
Las ligasas de ubiquitina-proteína E3 SMURF1 y SMURF2 regulan los niveles de SMAD. Aceptan la ubiquitina de una enzima conjugadora E2 donde transfieren la ubiquitina a los RSMAD, lo que provoca su ubiquitinación y posterior degradación proteosomal . SMURF1 se une a SMAD1 y SMAD5 mientras que SMURF2 se une a SMAD1 , SMAD2 , SMAD3 , SMAD6 y SMAD7 . [ Aclaración necesaria ] mejora la acción inhibidora de SMAD7 mientras reduce las actividades transcripcionales de SMAD2.
Ligandos TGF-β de H.sapiens resaltados en gris, de D.melanogaster en rosa, de C.elegans en amarillo.