En la mitocondria , la matriz es el espacio dentro de la membrana interna . La palabra "matriz" proviene del hecho de que este espacio es viscoso, en comparación con el citoplasma relativamente acuoso. La matriz mitocondrial contiene el ADN mitocondrial , ribosomas , enzimas solubles , pequeñas moléculas orgánicas, cofactores de nucleótidos e iones inorgánicos . [1] Las enzimas en la matriz facilitan las reacciones responsables de la producción de ATP , como el ciclo del ácido cítrico , la fosforilación oxidativa , la oxidación del piruvato y la beta oxidación de los ácidos grasos . [1]
La composición de la matriz en función de sus estructuras y contenidos produce un entorno que permite que las vías anabólicas y catabólicas avancen favorablemente. La cadena de transporte de electrones y las enzimas de la matriz desempeñan un papel importante en el ciclo del ácido cítrico y la fosforilación oxidativa . El ciclo del ácido cítrico produce NADH y FADH2 mediante oxidación que se reducirán en la fosforilación oxidativa para producir ATP . [2] [3]
El compartimento citosólico, espacio intermembrana , tiene un mayor contenido acuoso:proteico de alrededor de 3,8 μL/mg de proteína en relación con el que ocurre en la matriz mitocondrial, donde dichos niveles típicamente están cerca de 0,8 μL/mg de proteína. [4] No se sabe cómo las mitocondrias mantienen el equilibrio osmótico a través de la membrana mitocondrial interna, aunque la membrana contiene acuaporinas que se cree que son conductos para el transporte regulado de agua. La matriz mitocondrial tiene un pH de aproximadamente 7,8, que es más alto que el pH del espacio intermembrana de las mitocondrias, que oscila entre 7,0 y 7,4. [5] El ADN mitocondrial fue descubierto por Nash y Margit en 1963. En la matriz mitocondrial hay de uno a muchos ADN bicatenario principalmente circular. El ADN mitocondrial es el 1% del ADN total de una célula. Es rico en contenido de guanina y citosina , y en los humanos se deriva de la madre. Las mitocondrias de los mamíferos tienen ribosomas 55s.
La matriz alberga una amplia variedad de metabolitos involucrados en procesos dentro de la matriz. El ciclo del ácido cítrico involucra acil-CoA , piruvato , acetil-CoA , citrato , isocitrato , α-cetoglutarato , succinil-CoA , fumarato , succinato , L -malato y oxaloacetato . [2] El ciclo de la urea utiliza L -ornitina , carbamoil fosfato y L -citrulina . [4] La cadena de transporte de electrones oxida las coenzimas NADH y FADH2 . La síntesis de proteínas utiliza ADN , ARN y ARNt mitocondrial . [5] La regulación de procesos utiliza iones ( Ca 2+ / K + / Mg + ). [ 6 ] Metabolitos adicionales presentes en la matriz son CO 2 , H 2 O , O 2 , ATP , ADP y Pi . [1]
Enzimas de procesos que tienen lugar en la matriz. El ciclo del ácido cítrico es facilitado por la piruvato deshidrogenasa , la citrato sintasa , la aconitasa , la isocitrato deshidrogenasa , la α-cetoglutarato deshidrogenasa , la succinil-CoA sintetasa , la fumarasa y la malato deshidrogenasa . [2] El ciclo de la urea es facilitado por la carbamoil fosfato sintetasa I y la ornitina transcarbamilasa . [4] La β-oxidación utiliza piruvato carboxilasa , acil-CoA deshidrogenasa y β-cetotiolasa . [1] La producción de aminoácidos se ve facilitada por las transaminasas . [7] El metabolismo de los aminoácidos está mediado por proteasas , como la proteasa presecuenciada . [8]
La membrana interna es una bicapa de fosfolípidos que contiene los complejos de fosforilación oxidativa. que contiene la cadena de transporte de electrones que se encuentra en las crestas de la membrana interna y está formada por cuatro complejos proteicos y la ATP sintasa . Estos complejos son el complejo I (NADH:coenzima Q oxidorreductasa), el complejo II (succinato:coenzima Q oxidorreductasa), el complejo III (coenzima Q: citocromo c oxidorreductasa) y el complejo IV (citocromo c oxidasa). [6]
La cadena de transporte de electrones se encarga de establecer un pH y un gradiente electroquímico que facilita la producción de ATP mediante el bombeo de protones. El gradiente también proporciona control de la concentración de iones como Ca 2+ impulsado por el potencial de membrana mitocondrial. [1] La membrana sólo permite que moléculas no polares como CO 2 y O 2 y pequeñas moléculas polares no cargadas como H 2 O entren en la matriz. Las moléculas entran y salen de la matriz mitocondrial a través de proteínas transportadoras y transportadores de iones . Luego, las moléculas pueden salir de las mitocondrias a través de la porina . [9] Estas características atribuidas permiten controlar las concentraciones de iones y metabolitos necesarios para la regulación y determinan la tasa de producción de ATP. [10] [11]
Después de la glucólisis, el ciclo del ácido cítrico se activa mediante la producción de acetil-CoA. La oxidación del piruvato por la piruvato deshidrogenasa en la matriz produce CO 2 , acetil-CoA y NADH. La oxidación beta de los ácidos grasos sirve como una vía catabólica alternativa que produce acetil-CoA, NADH y FADH 2 . [1] La producción de acetil-CoA inicia el ciclo del ácido cítrico mientras que las coenzimas producidas se utilizan en la cadena de transporte de electrones . [11]
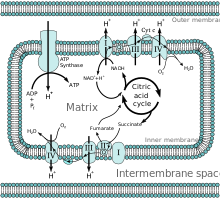
Todas las enzimas para el ciclo del ácido cítrico están en la matriz (p. ej., citrato sintasa , isocitrato deshidrogenasa , α-cetoglutarato deshidrogenasa , fumarasa y malato deshidrogenasa ), excepto la succinato deshidrogenasa que se encuentra en la membrana interna y forma parte del complejo proteico II en la cadena de transporte de electrones . El ciclo produce las coenzimas NADH y FADH 2 mediante la oxidación de carbonos en dos ciclos. La oxidación de NADH y FADH 2 produce GTP a partir de la succinil-CoA sintetasa. [2]
NADH y FADH 2 se producen en la matriz o se transportan a través de porinas y proteínas de transporte para sufrir oxidación mediante fosforilación oxidativa. [1] NADH y FADH 2 se oxidan en la cadena de transporte de electrones transfiriendo electrones para regenerar NAD + y FAD . Los protones son arrastrados hacia el espacio intermembrana por la energía de los electrones que atraviesan la cadena de transporte de electrones. Finalmente, el oxígeno de la matriz acepta cuatro electrones para completar la cadena de transporte de electrones. Los protones regresan a la matriz mitocondrial a través de la proteína ATP sintasa . La energía se utiliza para hacer girar la ATP sintasa, lo que facilita el paso de un protón, produciendo ATP. Una diferencia de pH entre la matriz y el espacio intermembrana crea un gradiente electroquímico mediante el cual la ATP sintasa puede pasar un protón a la matriz favorablemente. [6]
Los dos primeros pasos del ciclo de la urea tienen lugar dentro de la matriz mitocondrial de las células del hígado y el riñón. En el primer paso, el amoníaco se convierte en carbamoil fosfato mediante la inversión de dos moléculas de ATP. Este paso es facilitado por la carbamoil fosfato sintetasa I. El segundo paso, facilitado por la ornitina transcarbamilasa, convierte el carbamoil fosfato y la ornitina en citrulina . Después de estos pasos iniciales, el ciclo de la urea continúa en el espacio de la membrana interna hasta que la ornitina ingresa nuevamente a la matriz a través de un canal de transporte para continuar los primeros pasos dentro de la matriz. [12]
El α-cetoglutarato y el oxaloacetato se pueden convertir en aminoácidos dentro de la matriz mediante el proceso de transaminación . Estas reacciones son facilitadas por las transaminasas para producir aspartato y asparagina a partir de oxaloacetato. La transaminación del α-cetoglutarato produce glutamato , prolina y arginina . Estos aminoácidos luego se utilizan dentro de la matriz o se transportan al citosol para producir proteínas. [7] [13]
La regulación dentro de la matriz está controlada principalmente por la concentración de iones, la concentración de metabolitos y la carga de energía. La disponibilidad de iones como Ca 2+ controla diversas funciones del ciclo del ácido cítrico. en la matriz activa la piruvato deshidrogenasa , la isocitrato deshidrogenasa y la α-cetoglutarato deshidrogenasa, lo que aumenta la velocidad de reacción en el ciclo. [14] La concentración de intermediarios y coenzimas en la matriz también aumenta o disminuye la tasa de producción de ATP debido a efectos anapleróticos y catapleróticos. El NADH puede actuar como inhibidor de la α-cetoglutarato , la isocitrato deshidrogenasa , la citrato sintasa y la piruvato deshidrogenasa. La concentración de oxalacetato en particular se mantiene baja, por lo que cualquier fluctuación en esta concentración sirve para impulsar el ciclo del ácido cítrico. [2] La producción de ATP también sirve como medio de regulación al actuar como inhibidor de la isocitrato deshidrogenasa, la piruvato deshidrogenasa, los complejos proteicos de la cadena de transporte de electrones y la ATP sintasa. El ADP actúa como activador . [1]
La mitocondria contiene su propio conjunto de ADN que se utiliza para producir proteínas que se encuentran en la cadena de transporte de electrones. El ADN mitocondrial sólo codifica unas trece proteínas que se utilizan en el procesamiento de transcripciones mitocondriales, proteínas ribosómicas , ARN ribosomal , ARN de transferencia y subunidades proteicas que se encuentran en los complejos proteicos de la cadena de transporte de electrones. [15] [16]