
La interacción catión-π es una interacción molecular no covalente entre la cara de un sistema π rico en electrones (p. ej. , benceno , etileno , acetileno ) y un catión adyacente (p. ej., Li + , Na + ). Esta interacción es un ejemplo de enlace no covalente entre un monopolo (catión) y un cuadrupolo (sistema π). Las energías de enlace son significativas, y los valores en fase de solución caen dentro del mismo orden de magnitud que los enlaces de hidrógeno y los puentes salinos . De manera similar a estos otros enlaces no covalentes, las interacciones catión-π desempeñan un papel importante en la naturaleza, particularmente en la estructura de proteínas , el reconocimiento molecular y la catálisis enzimática . El efecto también se ha observado y se ha puesto en uso en sistemas sintéticos. [1] [2]

El benceno , el sistema π modelo, no tiene un momento dipolar permanente , ya que las contribuciones de los enlaces carbono-hidrógeno débilmente polares se cancelan debido a la simetría molecular . Sin embargo, el sistema π rico en electrones por encima y por debajo del anillo de benceno alberga una carga negativa parcial. Una carga positiva de contrapeso está asociada con el plano de los átomos de benceno, lo que da como resultado un cuadrupolo eléctrico (un par de dipolos, alineados como un paralelogramo, de modo que no hay un momento dipolar molecular neto). La región cargada negativamente del cuadrupolo puede entonces interactuar favorablemente con especies cargadas positivamente; se observa un efecto particularmente fuerte con cationes de alta densidad de carga . [2]
Las interacciones catión-π más estudiadas implican la unión entre un sistema π aromático y un catión de metal alcalino o nitrogenado . La geometría de interacción óptima coloca al catión en contacto de van der Waals con el anillo aromático, centrado en la parte superior de la cara π a lo largo del eje de 6 pliegues. [3] Los estudios han demostrado que la electrostática domina las interacciones en sistemas simples y que las energías de enlace relativas se correlacionan bien con la energía potencial electrostática . [4] [5]
El modelo electrostático desarrollado por Dougherty y colaboradores describe las tendencias en la energía de enlace basándose en las diferencias en la atracción electrostática. Se descubrió que las energías de interacción de los pares catión-π se correlacionan bien con el potencial electrostático por encima de la cara π de los arenos: para once aductos aromáticos de Na + , la variación en la energía de enlace entre los diferentes aductos podría racionalizarse completamente mediante diferencias electrostáticas. En la práctica, esto permite predecir las tendencias de forma cualitativa basándose en representaciones visuales de mapas de potencial electrostático para una serie de arenos. La atracción electrostática no es el único componente del enlace catión-π. Por ejemplo, el 1,3,5-trifluorobenceno interactúa con los cationes a pesar de tener un momento cuadrupolar despreciable. Si bien existen fuerzas no electrostáticas, estos componentes siguen siendo similares en una amplia variedad de arenos, lo que hace que el modelo electrostático sea una herramienta útil para predecir las energías de enlace relativas. Los otros "efectos" que contribuyen al enlace no se comprenden bien. Se han implicado interacciones de polarización , donante-aceptor [ enlace muerto permanente ] y transferencia de carga ; sin embargo, las tendencias energéticas no se corresponden bien con la capacidad de los arenos y los cationes para aprovechar estos efectos. Por ejemplo, si el dipolo inducido fuera un efecto controlador, los compuestos alifáticos como el ciclohexano deberían ser buenos socios catión-π (pero no lo son). [4]
La interacción catión-π no es covalente y, por lo tanto, es fundamentalmente diferente del enlace entre metales de transición y sistemas π. Los metales de transición tienen la capacidad de compartir densidad electrónica con sistemas π a través de orbitales d , lo que crea enlaces que son altamente covalentes en carácter y no se pueden modelar como una interacción catión-π.
Varios criterios influyen en la fuerza del enlace: la naturaleza del catión, los efectos de solvatación , la naturaleza del sistema π y la geometría de la interacción.
Según la electrostática ( ley de Coulomb ), los cationes más pequeños y con carga más positiva generan una mayor atracción electrostática. Como las interacciones catión-π se predicen mediante la electrostática, se deduce que los cationes con mayor densidad de carga interactúan más fuertemente con los sistemas π.
La siguiente tabla muestra una serie de energías libres de Gibbs de enlace entre el benceno y varios cationes en la fase gaseosa. [2] [6] Para una especie con carga simple, la energía de interacción en fase gaseosa se correlaciona con el radio iónico ( los radios iónicos no esféricos son aproximados). [7] [8]
Esta tendencia apoya la idea de que las fuerzas coulombianas juegan un papel central en la fuerza de interacción, ya que para otros tipos de enlace se esperaría que los iones más grandes y más polarizables tuvieran mayores energías de enlace.
La naturaleza del disolvente también determina la fuerza absoluta y relativa del enlace. La mayoría de los datos sobre la interacción catión-π se obtienen en fase gaseosa , ya que la atracción es más pronunciada en ese caso. Cualquier molécula de disolvente intermediaria atenuará el efecto, porque la energía ganada por la interacción catión-π se compensa parcialmente con la pérdida de energía de solvatación.
Para un aducto de catión-π dado, la energía de interacción disminuye con el aumento de la polaridad del disolvente . Esto se puede observar mediante las siguientes energías de interacción calculadas de metilamonio y benceno en una variedad de disolventes. [9]

Además, el equilibrio entre la solvatación y el efecto catión-π da como resultado una reorganización del orden de fuerza de interacción para una serie de cationes. Mientras que en la fase gaseosa los cationes más densamente cargados tienen la interacción catión-π más fuerte, estos iones también tienen una alta penalización por desolvatación. Esto se demuestra por las fuerzas relativas de los enlaces catión-π en agua para metales alcalinos: [10]
Comparar el momento cuadrupolar de diferentes arenos es una herramienta cualitativa útil para predecir tendencias en la unión de cationes y π, ya que se correlaciona aproximadamente con la fuerza de la interacción. Los arenos con momentos cuadrupolares más grandes son generalmente mejores para unir cationes.
Sin embargo, un sistema modelo cuadrupolar-ion no se puede utilizar para modelar cuantitativamente las interacciones catión-π. Dichos modelos suponen cargas puntuales y, por lo tanto, no son válidos dada la corta distancia de enlace catión-π. Para utilizar la electrostática para predecir energías, se debe considerar la superficie de potencial electrostático completa, en lugar de solo el momento cuadrupolar como una carga puntual. [2]

Las propiedades electrónicas de los sustituyentes también influyen en la fuerza de la atracción. [11] Los grupos atractores de electrones (por ejemplo, ciano −CN) debilitan la interacción, mientras que los sustituyentes donadores de electrones (por ejemplo, amino −NH 2 ) fortalecen la unión catión-π. Esta relación se ilustra cuantitativamente en el margen para varios sustituyentes.
Las tendencias electrónicas en la energía de enlace catión-π no son exactamente análogas a las tendencias en la reactividad del arilo. De hecho, el efecto de la participación de resonancia por un sustituyente no contribuye sustancialmente al enlace catión-π, a pesar de ser muy importante en muchas reacciones químicas con arenos. Esto fue demostrado por la observación de que la fuerza de interacción catión-π para una variedad de arenos sustituidos se correlaciona con el parámetro de Hammett σ meta . Este parámetro tiene como objetivo ilustrar los efectos inductivos de los grupos funcionales en un anillo arilo. [4]
El origen de los efectos de los sustituyentes en las interacciones catión-π se ha atribuido a menudo a la polarización por donación o retirada de electrones dentro o fuera del sistema π. [12] Esta explicación tiene sentido intuitivo, pero estudios posteriores han indicado que es errónea. Trabajos computacionales recientes de Wheeler y Houk indican firmemente que el efecto se debe principalmente a la interacción directa a través del espacio entre el catión y el dipolo sustituyente. En este estudio, los cálculos que modelaron el benceno no sustituido más la interacción con una molécula de "HX" situada donde estaría un sustituyente (corregido para átomos de hidrógeno adicionales) explicaron casi toda la tendencia de unión catión-π. Para donantes o aceptores pi muy fuertes, este modelo no fue capaz de explicar toda la interacción; en estos casos, la polarización puede ser un factor más significativo. [5]
Los heterociclos suelen activarse hacia la unión catión-π cuando el par solitario del heteroátomo está incorporado al sistema aromático (p. ej., indol , pirrol ). Por el contrario, cuando el par solitario no contribuye a la aromaticidad (p. ej. , piridina ), la electronegatividad del heteroátomo gana y debilita la capacidad de unión catión-π.
Dado que varios heterociclos clásicos "ricos en electrones" son malos donantes en lo que respecta a la unión catión-π, no se pueden predecir las tendencias de catión-π basándose en las tendencias de reactividad del heterociclo. Afortunadamente, las sutilezas mencionadas anteriormente se manifiestan en las superficies de potencial electrostático de los heterociclos relevantes. [2]

La interacción catión-heterociclo no siempre es una interacción catión-π; en algunos casos es más favorable que el ion se una directamente a un par solitario. Por ejemplo, se cree que este es el caso de los complejos de piridina-Na + .
Las interacciones catión-π tienen una dependencia aproximada de la distancia de 1/r n donde n<2. La interacción es menos sensible a la distancia que una interacción simple ion-cuadrupolo que tiene una dependencia de 1/r 3. [13]
Un estudio de Sherrill y colaboradores investigó más a fondo la geometría de la interacción, confirmando que las interacciones catión-π son más fuertes cuando el catión está situado perpendicular al plano de los átomos (θ = 0 grados en la imagen de abajo). Las variaciones de esta geometría aún muestran una interacción significativa que se debilita a medida que el ángulo θ se acerca a los 90 grados. Para interacciones fuera del eje, el ϕ preferido coloca al catión entre dos átomos de H. Las distancias de enlace de equilibrio también aumentan con el ángulo fuera del eje. Las energías donde el catión es coplanar con el anillo de carbono son puntos de silla en la superficie de energía potencial , lo que es consistente con la idea de que la interacción entre un catión y la región positiva del cuadrupolo no es ideal. [14]

Los cálculos teóricos sugieren que la interacción catión-π es comparable a (y potencialmente más fuerte que) los puentes de sal de amonio-carboxilato en medios acuosos . Los valores calculados a continuación muestran que a medida que aumenta la polaridad del disolvente, la fuerza del complejo catión-π disminuye de forma menos drástica. Esta tendencia se puede racionalizar mediante los efectos de desolvatación: la formación de puentes salinos tiene una alta penalización por desolvatación para ambas especies cargadas, mientras que el complejo catión-π solo pagaría una penalización significativa por el catión. [9]

Los bloques de construcción de la naturaleza contienen fracciones aromáticas en gran abundancia. Recientemente, se ha vuelto claro que muchas características estructurales que alguna vez se creyeron que eran puramente hidrófobas en la naturaleza, de hecho participan en interacciones catión-π. Las cadenas laterales de aminoácidos de fenilalanina , triptófano , tirosina , histidina , son capaces de unirse a especies catiónicas como cadenas laterales de aminoácidos cargadas, iones metálicos, neurotransmisores de moléculas pequeñas y agentes farmacéuticos. De hecho, se ha descubierto que los sitios de unión macromoleculares que se suponía que incluían grupos aniónicos (basados en la afinidad por los cationes) consisten en residuos aromáticos en múltiples casos. Las interacciones catión-π pueden ajustar el pKa de las cadenas laterales nitrogenadas, aumentando la abundancia de la forma protonada; esto tiene implicaciones para la estructura y función de las proteínas . [15] Si bien se han estudiado menos en este contexto, las bases de ADN también pueden participar en interacciones catión-π. [16] [17]
La primera evidencia de que las interacciones catión-π desempeñaban un papel en la estructura de las proteínas fue la observación de que en los datos cristalográficos, las cadenas laterales aromáticas aparecen en estrecho contacto con cadenas laterales que contienen nitrógeno (que pueden existir como especies catiónicas protonadas) con una frecuencia desproporcionada.
En un estudio publicado en 1986 por Burley y Petsko se analizó un conjunto diverso de proteínas y se descubrió que aproximadamente el 50 % de los residuos aromáticos Phe, Tyr y Trp se encontraban a 6 Å de los grupos amino. Además, aproximadamente el 25 % de las cadenas laterales que contienen nitrógeno Lys, Asn, Gln e His estaban en contacto de van der Waals con aromáticos y el 50 % de Arg en contacto con múltiples residuos aromáticos (2 en promedio). [18]
Estudios sobre conjuntos de datos más grandes encontraron tendencias similares, incluyendo algunas formaciones dramáticas de pilas alternadas de cadenas laterales catiónicas y aromáticas. En algunos casos, los hidrógenos del NH estaban alineados hacia residuos aromáticos, y en otros, la fracción catiónica estaba apilada sobre el sistema π. Se encontró una tendencia particularmente fuerte para los contactos cercanos entre Arg y Trp. La fracción de guanidinio de Arg en particular tiene una alta propensión a apilarse sobre residuos aromáticos mientras también forma enlaces de hidrógeno con átomos de oxígeno cercanos. [19] [20] [21]

Un ejemplo de interacciones catión-π en el reconocimiento molecular se observa en el receptor nicotínico de acetilcolina (nAChR), que une su ligando endógeno , la acetilcolina (una molécula con carga positiva), a través de una interacción catión-π al amonio cuaternario. El neurorreceptor nAChR es un canal iónico controlado por ligando bien estudiado que se abre con la unión de la acetilcolina. Los receptores de acetilcolina son objetivos terapéuticos para una gran cantidad de trastornos neurológicos, entre ellos la enfermedad de Parkinson , la enfermedad de Alzheimer , la esquizofrenia , la depresión y el autismo . Los estudios de Dougherty y colaboradores confirmaron que las interacciones catión-π son importantes para la unión y activación del nAChR al realizar variaciones estructurales específicas en un residuo clave de triptófano y correlacionar los resultados de la actividad con la capacidad de unión del catión-π. [22]
El nAChR es especialmente importante en la unión de la nicotina en el cerebro y desempeña un papel clave en la adicción a la nicotina . La nicotina tiene un farmacóforo similar a la acetilcolina, especialmente cuando está protonada. Hay pruebas sólidas que respaldan que las interacciones catión-π son fundamentales para la capacidad de la nicotina de activar selectivamente los receptores cerebrales sin afectar la actividad muscular. [23] [24]

Otro ejemplo se observa en la proteína UVR8 , que detecta la radiación UV-B en las plantas . Varios residuos de triptófano interactúan a través de interacciones catión-π con residuos de arginina que, a su vez, forman puentes salinos con residuos ácidos en una segunda copia de la proteína. Se ha propuesto [25] que la absorción de un fotón por los residuos de triptófano interrumpe esta interacción y conduce a la disociación del dímero proteico.
También se cree que la unión del catión π es importante en el reconocimiento de la superficie celular [2] [26]
Las interacciones catión-π pueden catalizar reacciones químicas al estabilizar la acumulación de carga positiva en los estados de transición . Este tipo de efecto se observa en sistemas enzimáticos. Por ejemplo, la acetilcolinesterasa contiene grupos aromáticos importantes que se unen al amonio cuaternario en su sitio activo. [2]
Las enzimas de policiclación también dependen de las interacciones catión-π. Dado que las policiclaciones del escualeno desencadenadas por protones se producen a través de una cascada catiónica (potencialmente concertada), las interacciones catión-π son ideales para estabilizar esta carga positiva dispersa. La estructura cristalina de la ciclasa de escualeno-hopeno muestra que el sitio activo está revestido de residuos aromáticos. [27]

También se han observado interacciones catión-π en los cristales de moléculas sintéticas. Por ejemplo, Aoki y colaboradores compararon las estructuras en estado sólido del éster de colina del ácido indol-3-acético y un análogo sin carga. En las especies cargadas, se observa una interacción catión-π intramolecular con el indol, así como una interacción con la fracción indólica de la molécula vecina en la red. En el cristal del compuesto neutro isostérico no se observa el mismo plegamiento y no hay interacciones entre el grupo terc -butilo y los indoles vecinos. [28]

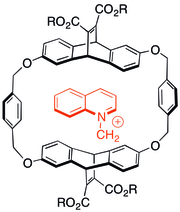
Algunos de los primeros estudios sobre la interacción catión-π implicaron observar las interacciones de moléculas nitrogenadas cargadas en la química huésped-anfitrión de ciclofanos . Se descubrió que incluso cuando se añadían grupos solubilizantes aniónicos a cápsulas huésped aromáticas, los huéspedes catiónicos preferían asociarse con el sistema π en muchos casos. El tipo de huésped que se muestra a la derecha también era capaz de catalizar reacciones de N-alquilación para formar productos catiónicos. [29]
Más recientemente, la unión y catálisis del sustrato centrado en el catión π se ha visto implicada en los sistemas catalíticos supramoleculares de grupos metal-ligando desarrollados por Raymond y Bergman. [30]
Los sistemas π son componentes básicos importantes en el ensamblaje supramolecular debido a sus interacciones no covalentes versátiles con diversos grupos funcionales. En particular, las interacciones π-π, CH-π y π-catión se utilizan ampliamente en el ensamblaje y reconocimiento supramolecular.

La interacción π-π se refiere a las interacciones directas entre dos sistemas π; y la interacción catión-π surge de la interacción electrostática de un catión con la cara del sistema π. A diferencia de estas dos interacciones, la interacción CH-π surge principalmente de la transferencia de carga entre el orbital CH y el sistema π.
Un ejemplo notable de la aplicación de interacciones π-π en el ensamblaje supramolecular es la síntesis de catenano . El principal desafío para la síntesis de catenano es entrelazar moléculas de manera controlada. Stoddart y sus colaboradores desarrollaron una serie de sistemas que utilizan las fuertes interacciones π-π entre derivados de benceno ricos en electrones y anillos de piridinio pobres en electrones . [31] [2]El catanano se sintetizó haciendo reaccionar bis(piridinio) (A), bisparafenileno-34-corona-10 (B) y 1, 4-bis(bromometil)benceno C (Fig. 2). La interacción π-π entre A y B dirigió la formación de un intermediario de plantilla entrelazado que se cicló aún más mediante una reacción de sustitución con el compuesto C para generar el producto [2]catenano.

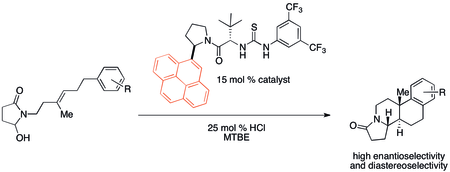
Las interacciones catión-π probablemente han sido importantes, aunque inadvertidas, en una multitud de reacciones orgánicas a lo largo de la historia. Sin embargo, recientemente se ha llamado la atención sobre posibles aplicaciones en el diseño de catalizadores. En particular, se ha descubierto que los organocatalizadores no covalentes a veces exhiben tendencias de reactividad y selectividad que se correlacionan con las propiedades de unión catión-π. Una policiclación desarrollada por Jacobsen y colaboradores muestra un efecto catión-π particularmente fuerte utilizando el catalizador que se muestra a continuación. [32]

En muchos aspectos, la interacción anión -π es opuesta a la interacción catión-π, aunque los principios subyacentes son idénticos. Hasta la fecha se conocen significativamente menos ejemplos. Para atraer una carga negativa, la distribución de carga del sistema π debe invertirse. Esto se logra colocando varios sustituyentes que atraen electrones fuertes a lo largo del sistema π ( por ejemplo , hexafluorobenceno ). [33] El efecto anión-π se explota ventajosamente en sensores químicos para aniones específicos. [34]