
El Western blot (a veces llamado inmunotransferencia de proteínas ), o Western blotting , es una técnica analítica ampliamente utilizada en biología molecular e inmunogenética para detectar proteínas específicas en una muestra de homogeneizado o extracto de tejido. [1] Además de detectar las proteínas, esta técnica también se utiliza para visualizar, distinguir y cuantificar las diferentes proteínas en una combinación de proteínas complicada. [2]
La técnica Western blot utiliza tres elementos para lograr su tarea de separar una proteína específica de un complejo: separación por tamaño, transferencia de proteína a un soporte sólido y marcaje de la proteína diana utilizando un anticuerpo primario y secundario para visualizar. [1] Se crea un anticuerpo sintético o derivado de animales (conocido como anticuerpo primario ) que reconoce y se une a una proteína diana específica. La membrana de electroforesis se lava en una solución que contiene el anticuerpo primario, antes de lavar el exceso de anticuerpo. [3] Se agrega un anticuerpo secundario que reconoce y se une al anticuerpo primario. El anticuerpo secundario se visualiza a través de varios métodos como tinción , inmunofluorescencia y radioactividad, lo que permite la detección indirecta de la proteína diana específica. [3]
Otras técnicas relacionadas incluyen el análisis dot blot , el dot blot cuantitativo , la inmunohistoquímica y la inmunocitoquímica , donde se utilizan anticuerpos para detectar proteínas en tejidos y células mediante inmunotinción , y el ensayo inmunoabsorbente ligado a enzimas (ELISA).
El nombre western blot es un juego de palabras con Southern blot , una técnica para la detección de ADN que lleva el nombre de su inventor, el biólogo inglés Edwin Southern . De manera similar, la detección de ARN se denomina northern blot . [4] El término "western blot" fue dado por W. Neal Burnette en 1981, [5] aunque el método en sí fue inventado independientemente en 1979 por Jaime Renart, Jakob Reiser y George Stark en la Universidad de Stanford , [6] y por Harry Towbin, Theophil Staehelin y Julian Gordon en el Instituto Friedrich Miescher en Basilea , Suiza . [7] El grupo de Towbin también utilizó anticuerpos secundarios para la detección, asemejándose así al método real que se utiliza casi universalmente en la actualidad. Entre 1979 y 2019 "se ha mencionado en los títulos, resúmenes y palabras clave de más de 400.000 publicaciones listadas en PubMed " y puede que todavía sea la técnica de análisis de proteínas más utilizada. [8]

El Western blot se utiliza ampliamente en bioquímica para la detección cualitativa de proteínas individuales y modificaciones de proteínas (como modificaciones postraduccionales ). Se estima que al menos el 8-9% de todas las publicaciones relacionadas con las proteínas aplican Western blots. [8] Se utiliza como un método general para identificar la presencia de una proteína única específica dentro de una mezcla compleja de proteínas. Se puede derivar una estimación semicuantitativa de una proteína a partir del tamaño y la intensidad del color de una banda de proteína en la membrana de la transferencia. Además, se puede utilizar la aplicación de una serie de diluciones de una proteína purificada de concentraciones conocidas para permitir una estimación más precisa de la concentración de proteína. El Western blot se utiliza rutinariamente para la verificación de la producción de proteínas después de la clonación . También se utiliza en diagnósticos médicos, por ejemplo, en la prueba del VIH o la prueba de la EEB . [9]
La prueba confirmatoria del VIH emplea un Western blot para detectar anticuerpos anti-VIH en una muestra de suero humano . Las proteínas de células infectadas por el VIH se separan y se transfieren a una membrana como se indicó anteriormente. Luego, el suero que se va a analizar se aplica en el paso de incubación del anticuerpo primario; el anticuerpo libre se elimina por lavado y se agrega un anticuerpo antihumano secundario vinculado a una señal enzimática. Las bandas teñidas indican entonces las proteínas para las que el suero del paciente contiene anticuerpos. [10] Un Western blot también se utiliza como prueba definitiva para la variante de la enfermedad de Creutzfeldt-Jakob , un tipo de enfermedad priónica vinculada al consumo de carne contaminada de ganado con encefalopatía espongiforme bovina (EEB, comúnmente conocida como "enfermedad de las vacas locas"). [11] Otra aplicación es en el diagnóstico de la tularemia . Una evaluación de la capacidad del Western blot para detectar anticuerpos contra F. tularensis reveló que su sensibilidad es de casi el 100% y la especificidad es del 99,6%. [12] Algunas formas de prueba de la enfermedad de Lyme emplean la técnica Western blot. [13] La técnica Western blot también se puede utilizar como prueba confirmatoria de la infección por hepatitis B y HSV-2 (herpes tipo 2). [14] [15] En medicina veterinaria, a veces se utiliza la técnica Western blot para confirmar el estado de FIV + en gatos. [16]
Otras aplicaciones de la técnica Western blot incluyen su uso por parte de la Agencia Mundial Antidopaje (AMA). El dopaje sanguíneo es el uso indebido de ciertas técnicas y/o sustancias para aumentar la masa de glóbulos rojos, lo que permite al cuerpo transportar más oxígeno a los músculos y, por lo tanto, aumentar la resistencia y el rendimiento. Hay tres sustancias o métodos ampliamente conocidos que se utilizan para el dopaje sanguíneo, a saber, la eritropoyetina (EPO), los transportadores sintéticos de oxígeno y las transfusiones de sangre. Cada uno está prohibido según la Lista de Sustancias y Métodos Prohibidos de la AMA. La técnica Western blot se utilizó durante la Copa Mundial de la FIFA 2014 en la campaña antidopaje para ese evento. [17] En total, Reichel, et al. [18] recogieron y analizaron más de 1000 muestras en el laboratorio acreditado por la AMA de Lausana, Suiza . Una investigación reciente que utilizó la técnica Western blot mostró una detección mejorada de EPO en sangre y orina basada en nuevos geles horizontales prefabricados Velum SAR optimizados para análisis de rutina. [19] Con la adopción de la SAR-PAGE horizontal en combinación con los geles Velum SAR soportados en película prefabricada, la capacidad discriminatoria de la aplicación de microdosis de rEPO mejoró significativamente.
Además de la aplicación del Western blot en la investigación científica, también se utiliza en áreas de investigación clínica. Dado que se puede aplicar al proceso de identificación directa de proteínas, el Western blot se considera una poderosa herramienta de diagnóstico que se utiliza con frecuencia en el ámbito clínico. Las técnicas de detección de proteínas y WB se pueden utilizar para encontrar biomarcadores de enfermedades como proteínas o anticuerpos específicos. Se cree que es un método viable para identificar proteínas particulares durante el diagnóstico de enfermedades como el cáncer, las enfermedades autoinmunes y los trastornos priónicos. La detección de varios biomarcadores utilizados en el diagnóstico de enfermedades neurológicas y oncológicas mediante Western blot es un procedimiento común. [2] [20] [21] Por ejemplo, se cree ampliamente que la llegada de la resistencia a múltiples fármacos (MDR) ha hecho que la terapia eficaz contra el cáncer sea extremadamente desafiante. Por lo tanto, el descubrimiento temprano, preciso y sensible del mecanismo de MDR es esencial, como lo es la búsqueda de enfoques quimioterapéuticos más efectivos para su aplicación en entornos clínicos. Se examina la expresión de MDR1/P-glicoproteína en las líneas celulares P388/ADR, P388 y HCT-15 utilizando la técnica WB. WB también ha identificado los niveles de MRP1. [2] [22] [23]
Por otro lado, como el Western blot tiene el potencial de distinguir diferentes isoformas de proteínas, puede usarse para diagnosticar enfermedades relacionadas con priones e isoformas de proteínas, como el cáncer. Por ejemplo, el análisis Western blot del patrón de isoformas de las proteínas 14-3-3 en el líquido cerebral puede identificar la enfermedad de Creutzfeldt-Jakob. [2] [24] Además, la enfermedad pulmonar del granjero es una afección pulmonar provocada por la respiración de partículas antigénicas, y los estudios han indicado que el Western blot puede ser una opción útil para identificar proteínas inmunorreactivas relacionadas con la enfermedad pulmonar del granjero. [2] Además, el Western blot también se utiliza para identificar proteínas en el líquido sinovial y el suero, lo que permite el diagnóstico de los síntomas clínicos de la osteoartritis y la artritis reumatoide. [2] [25] El Western blot se utiliza para evaluar los niveles de expresión de la proteína FSTL1 en personas con osteoartritis de rodilla, que sirve como un posible biomarcador de daño articular. [2] [26] Además, se utiliza para identificar proteínas en el líquido sinovial y el suero, lo que permite el diagnóstico de los síntomas clínicos de la osteoartritis y la artritis reumatoide. Se utiliza para evaluar los niveles de expresión de la proteína FSTL1 en individuos con osteoartritis de rodilla, que sirve como un posible biomarcador de daño articular. [2] [27] [28]
Para el desarrollo de medicamentos, la identificación de objetivos terapéuticos y la investigación biológica, es esencial comprender dónde se encuentran las proteínas dentro de una célula. [2] [29] Las ubicaciones subcelulares de las proteínas dentro de la célula y sus funciones están estrechamente relacionadas. La relación entre la función de la proteína y la localización sugiere que cuando las proteínas se mueven, sus funciones pueden cambiar o adquirir nuevas características. La ubicación subcelular de una proteína se puede determinar utilizando una variedad de métodos. Se han creado y utilizado numerosas herramientas y estrategias computacionales eficientes y confiables para identificar la localización subcelular de las proteínas. [30] Con la ayuda de los métodos de fraccionamiento subcelular, WB continúa siendo un método fundamental importante para la investigación y comprensión de la localización de las proteínas. [2]
Debido a sus diversos epítopos, los anticuerpos han ganado interés tanto en la investigación básica como en la clínica. La base de la caracterización y validación de anticuerpos es el mapeo de epítopos. El procedimiento de identificación de los sitios de unión de un anticuerpo (epítopos) en la proteína objetivo se conoce como "mapeo de epítopos". Encontrar el epítopo de unión de un anticuerpo es esencial para el descubrimiento y la creación de nuevas vacunas, diagnósticos y terapias. [2] Como resultado, se han creado varios métodos para mapear epítopos de anticuerpos. En este punto, la especificidad del Western blot es la característica principal que lo distingue de otras técnicas de mapeo de epítopos. Hay varias aplicaciones del Western blot para el mapeo de epítopos en muestras de piel humana, virus de la enfermedad hemorrágica. [2] [31] [32]

El método Western blot se compone de electroforesis en gel para separar proteínas nativas por estructura 3-D o proteínas desnaturalizadas por la longitud del polipéptido, seguido de una transferencia electroforética a una membrana (principalmente PVDF o nitrocelulosa ) y un procedimiento de inmunotinción para visualizar una determinada proteína en la membrana de transferencia.
La electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE) se utiliza generalmente para la separación electroforética desnaturalizante de proteínas. El dodecil sulfato de sodio (SDS) se utiliza generalmente como tampón (así como en el gel) para dar a todas las proteínas presentes una carga negativa uniforme, ya que las proteínas pueden tener carga positiva, negativa o neutra. Antes de la electroforesis, las muestras de proteínas suelen hervirse para desnaturalizar las proteínas presentes. Esto garantiza que las proteínas se separen en función del tamaño y evita que las proteasas (enzimas que descomponen las proteínas) degraden las muestras. Después de la separación electroforética, las proteínas se transfieren a una membrana (normalmente nitrocelulosa o PVDF). A menudo, la membrana se tiñe con Ponceau S para visualizar las proteínas en la mancha y garantizar que se haya producido una transferencia adecuada. A continuación, las proteínas se bloquean con leche (u otros agentes bloqueantes) para evitar la unión de anticuerpos no específicos y, a continuación, se tiñen con anticuerpos específicos para la proteína diana. [7] [6] Por último, la membrana se tiñe con un anticuerpo secundario que reconoce la tinción del primer anticuerpo, que luego se puede utilizar para la detección mediante una variedad de métodos. El paso de electroforesis en gel se incluye en el análisis de transferencia Western para resolver el problema de la reactividad cruzada de los anticuerpos.
Como un paso importante en la realización de un Western blot, la preparación de la muestra debe realizarse de manera efectiva ya que la interpretación de este ensayo está influenciada por la preparación de la proteína, que se compone de procesos de extracción y purificación de proteínas. [33] [3] Para lograr una extracción de proteína eficiente, se debe elegir un método de homogeneización adecuado debido al hecho de que es responsable de romper la membrana celular y liberar los componentes intracelulares. [3] [34] Además de eso, se necesita el tampón de lisis ideal para adquirir cantidades sustanciales de contenido de proteína objetivo porque el tampón lidera el proceso de solubilización de proteínas y previene la degradación de proteínas. Después de completar la preparación de la muestra, el contenido de proteína está listo para ser separado mediante el uso de electroforesis en gel. [3]

Las proteínas de la muestra se separan mediante electroforesis en gel . La separación de proteínas puede realizarse por punto isoeléctrico (pI), peso molecular , carga eléctrica o una combinación de estos factores. La naturaleza de la separación depende del tratamiento de la muestra y de la naturaleza del gel.
El tipo más común de electroforesis en gel emplea geles de poliacrilamida y tampones cargados con dodecil sulfato de sodio (SDS). La SDS-PAGE (electroforesis en gel de poliacrilamida con SDS) mantiene los polipéptidos en un estado desnaturalizado una vez que han sido tratados con agentes reductores fuertes para eliminar la estructura secundaria y terciaria (por ejemplo, enlaces disulfuro [SS] a grupos sulfhidrilo [SH y SH]) y, por lo tanto, permite la separación de proteínas por su masa molecular . Las proteínas muestreadas se cubren en el SDS cargado negativamente, volviéndose efectivamente aniónicas , y migran hacia el ánodo cargado positivamente (voltaje más alto) (que generalmente tiene un cable rojo) a través de la malla de acrilamida del gel. Las proteínas más pequeñas migran más rápido a través de esta malla y, por lo tanto, las proteínas se separan según el tamaño (generalmente medido en kilodaltons, kDa ). La concentración de acrilamida determina la resolución del gel: cuanto mayor sea la concentración de acrilamida, mejor será la resolución de las proteínas de menor peso molecular. Cuanto menor sea la concentración de acrilamida, mejor será la resolución de las proteínas de mayor peso molecular. Las proteínas se desplazan solo en una dimensión a lo largo del gel en la mayoría de las transferencias.
Las muestras se cargan en pocillos en el gel. Normalmente, se reserva un carril para un marcador o escalera , que es una mezcla disponible comercialmente de proteínas de pesos moleculares conocidos, normalmente teñidas para formar bandas visibles y coloreadas. Cuando se aplica voltaje a lo largo del gel, las proteínas migran a través de él a diferentes velocidades según su tamaño. Estas diferentes velocidades de avance (diferentes movilidades electroforéticas ) se separan en bandas dentro de cada carril . Las bandas de proteínas se pueden comparar luego con las bandas de escalera, lo que permite estimar el peso molecular de la proteína.
También es posible utilizar un gel bidimensional que esparce las proteínas de una sola muestra en dos dimensiones. Las proteínas se separan según el punto isoeléctrico ( pH en el que tienen una carga neta neutra) en la primera dimensión, y según su peso molecular en la segunda dimensión.

Para que las proteínas sean accesibles a la detección de anticuerpos, se trasladan desde el interior del gel a una membrana, un soporte sólido, que es una parte esencial del proceso. Hay dos tipos de membrana: nitrocelulosa (NC) o difluoruro de polivinilideno (PVDF ). La membrana NC tiene una alta afinidad por las proteínas y sus capacidades de retención. Sin embargo, la NC es frágil y no permite que la mancha se utilice para volver a sondear, mientras que la membrana PVDF permite volver a sondear la mancha. [1] El método más comúnmente utilizado para transferir las proteínas se llama electrotransferencia . La electrotransferencia utiliza una corriente eléctrica para extraer las proteínas cargadas negativamente del gel hacia el ánodo cargado positivamente y hacia la membrana PVDF o NC. Las proteínas se mueven desde el interior del gel hacia la membrana mientras mantienen la organización que tenían dentro del gel. Un método más antiguo de transferencia implica colocar una membrana sobre el gel y una pila de papeles de filtro encima. Toda la pila se coloca en una solución tampón que se desplaza por el papel por acción capilar , arrastrando consigo las proteínas. En la práctica, este método no se utiliza habitualmente debido al largo tiempo que lleva el procedimiento.
Como resultado de cualquiera de los dos procesos de transferencia, las proteínas quedan expuestas a una fina capa de membrana para su detección. Ambas variedades de membrana se eligen por sus propiedades de unión a proteínas no específicas (es decir, se unen a todas las proteínas por igual). La unión a proteínas se basa en interacciones hidrofóbicas, así como en interacciones cargadas entre la membrana y la proteína. Las membranas de nitrocelulosa son más económicas que las de PVDF, pero son mucho más frágiles y no pueden soportar sondajes repetidos.
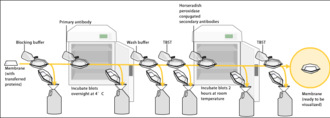
La tinción de proteínas totales permite visualizar la proteína total que se ha transferido con éxito a la membrana, lo que permite al usuario verificar la uniformidad de la transferencia de proteínas y realizar una normalización posterior de la proteína objetivo con la cantidad real de proteína por carril. La normalización con el llamado "control de carga" se basaba en la inmunotinción de proteínas de mantenimiento en el procedimiento clásico, pero recientemente se está orientando hacia la tinción de proteínas totales, debido a múltiples beneficios. [35] Se han descrito al menos siete enfoques diferentes para la tinción de proteínas totales para la normalización de transferencia Western: Ponceau S , técnicas sin tinción, Sypro Ruby, Epicocconone , Coomassie R-350 , Amido Black y Cy5 . [35] Para evitar el ruido de la señal, la tinción de proteínas totales debe realizarse antes del bloqueo de la membrana. Sin embargo, también se han descrito tinciones posteriores a la administración de anticuerpos. [36]
Dado que la membrana ha sido elegida por su capacidad para unirse a proteínas y como tanto los anticuerpos como el objetivo son proteínas, se deben tomar medidas para evitar las interacciones entre la membrana y el anticuerpo utilizado para la detección de la proteína objetivo. El bloqueo de la unión no específica se logra colocando la membrana en una solución diluida de proteína, generalmente 3-5% de albúmina de suero bovino (BSA) o leche en polvo descremada (ambas son económicas) en solución salina tamponada con tris (TBS) o I-Block, con un porcentaje mínimo (0,1%) de detergente como Tween 20 o Triton X-100 . Aunque se prefiere la leche en polvo descremada debido a su disponibilidad, se necesita una solución de bloqueo adecuada ya que no todas las proteínas de la leche son compatibles con todas las bandas de detección. [1] La proteína en la solución diluida se adhiere a la membrana en todos los lugares donde las proteínas objetivo no se han unido. Por lo tanto, cuando se agrega el anticuerpo, no puede unirse a la membrana y, por lo tanto, el único sitio de unión disponible es la proteína objetivo específica. Esto reduce el fondo en el producto final del Western blot, lo que produce resultados más claros y elimina los falsos positivos.

Durante el proceso de detección, se "sonda" la membrana en busca de la proteína de interés con un anticuerpo modificado que está unido a una enzima indicadora; cuando se expone a un sustrato adecuado, esta enzima desencadena una reacción colorimétrica y produce un color. Por diversas razones, esto se lleva a cabo tradicionalmente en un proceso de dos pasos, aunque ahora hay métodos de detección de un solo paso disponibles para ciertas aplicaciones.
Los anticuerpos primarios se generan cuando una especie huésped o un cultivo de células inmunitarias se expone a la proteína de interés (o a una parte de ella). Normalmente, esto forma parte de la respuesta inmunitaria, mientras que en este caso se obtienen y se utilizan como herramientas de detección sensibles y específicas que se unen directamente a la proteína.
Después del bloqueo, se incuba una solución de anticuerpo primario (generalmente entre 0,5 y 5 microgramos/ml) diluida en tampón de lavado PBS o TBST con la membrana bajo agitación suave durante una hora a temperatura ambiente, o durante la noche a 4 ° C. También se puede incubar a diferentes temperaturas, y las temperaturas más bajas se asocian con una mayor unión, tanto específica (a la proteína diana, la "señal") como no específica ("ruido"). Después de la incubación, la membrana se lava varias veces en tampón de lavado para eliminar el anticuerpo primario no unido y, de ese modo, minimizar el fondo. [1] Normalmente, la solución tampón de lavado está compuesta de solución salina tamponada con un pequeño porcentaje de detergente y, a veces, con leche en polvo o BSA.
Después de enjuagar la membrana para eliminar el anticuerpo primario no unido, la membrana se expone a otro anticuerpo conocido como anticuerpo secundario . Los anticuerpos provienen de fuentes animales (o cultivos de hibridomas de origen animal ). El anticuerpo secundario reconoce y se une a la porción específica de la especie del anticuerpo primario. Por lo tanto, un anticuerpo secundario anti-ratón se unirá a casi cualquier anticuerpo primario de origen de ratón, y puede denominarse anticuerpo "anti-especie" (por ejemplo, anti-ratón, anti-cabra, etc.). Para permitir la detección de la proteína objetivo, el anticuerpo secundario se une comúnmente a la biotina o una enzima reportera como la fosfatasa alcalina o la peroxidasa de rábano picante . Esto significa que varios anticuerpos secundarios se unirán a un anticuerpo primario y mejorarán la señal, lo que permitirá la detección de proteínas de una concentración mucho menor de la que sería visible solo mediante SDS-PAGE.
La peroxidasa de rábano picante se une comúnmente a anticuerpos secundarios para permitir la detección de la proteína objetivo por quimioluminiscencia . El sustrato quimioluminiscente es escindido por la peroxidasa de rábano picante, lo que da como resultado la producción de luminiscencia . Por lo tanto, la producción de luminiscencia es proporcional a la cantidad de anticuerpo secundario conjugado con peroxidasa de rábano picante y, por lo tanto, mide indirectamente la presencia de la proteína objetivo. Se coloca una hoja sensible de película fotográfica contra la membrana y la exposición a la luz de la reacción crea una imagen de los anticuerpos unidos a la mancha. Un enfoque más económico pero menos sensible utiliza una tinción de 4-cloronaftol con peróxido de hidrógeno al 1 % ; la reacción de los radicales de peróxido con 4-cloronaftol produce una tinción de color púrpura oscuro que se puede fotografiar sin utilizar una película fotográfica especializada.
Al igual que con los procedimientos ELISPOT y ELISA , se puede proporcionar a la enzima una molécula de sustrato que será convertida por la enzima en un producto de reacción coloreado que será visible en la membrana (ver la figura a continuación con bandas azules).
Otro método de detección de anticuerpos secundarios utiliza un anticuerpo ligado a un fluoróforo en el infrarrojo cercano. La luz producida a partir de la excitación de un colorante fluorescente es estática, lo que hace que la detección fluorescente sea una medida más precisa y exacta de la diferencia en la señal producida por los anticuerpos marcados unidos a las proteínas en una prueba Western blot. Las proteínas se pueden cuantificar con precisión porque la señal generada por las diferentes cantidades de proteínas en las membranas se mide en un estado estático, en comparación con la quimioluminiscencia, en la que la luz se mide en un estado dinámico. [37]
Una tercera alternativa es utilizar un marcador radiactivo en lugar de una enzima acoplada al anticuerpo secundario, como el marcado de una proteína que se une al anticuerpo, como la proteína A de Staphylococcus o la estreptavidina, con un isótopo radiactivo de yodo. Dado que otros métodos son más seguros, rápidos y económicos, este método rara vez se utiliza en la actualidad; sin embargo, una ventaja de este enfoque es la sensibilidad de las imágenes basadas en autorradiografía, que permiten una cuantificación de proteínas de alta precisión cuando se combinan con software óptico (por ejemplo, Optiquant).
Históricamente, el proceso de sondeo se realizaba en dos pasos debido a la relativa facilidad de producir anticuerpos primarios y secundarios en procesos separados. Esto ofrece a los investigadores y a las empresas enormes ventajas en términos de flexibilidad, reducción de costes y añade un paso de amplificación al proceso de detección. Sin embargo, dada la llegada del análisis de proteínas de alto rendimiento y los límites de detección más bajos, ha habido interés en desarrollar sistemas de sondeo de un solo paso que permitan que el proceso se realice más rápido y con menos consumibles. Esto requiere un anticuerpo de sonda que reconozca la proteína de interés y contenga una etiqueta detectable, sondas que suelen estar disponibles para etiquetas de proteínas conocidas . La sonda primaria se incuba con la membrana de una manera similar a la del anticuerpo primario en un proceso de dos pasos, y luego está lista para la detección directa después de una serie de pasos de lavado.

Una vez que se eliminan las sondas no unidas, el Western blot está listo para la detección de las sondas que están marcadas y unidas a la proteína de interés. En términos prácticos, no todos los Western blot revelan proteína solo en una banda en una membrana. Se toman aproximaciones de tamaño comparando las bandas teñidas con las del marcador o escalera cargada durante la electroforesis. El proceso se repite comúnmente para una proteína estructural, como actina o tubulina , que no debería cambiar entre muestras. La cantidad de proteína objetivo se normaliza a la proteína estructural para controlar entre grupos. Una estrategia superior es la normalización a la proteína total visualizada con tricloroetanol [38] [39] o epicocconona [40] . Esta práctica asegura la corrección de la cantidad de proteína total en la membrana en caso de errores o transferencias incompletas. (ver normalización de Western blot )
El método de detección colorimétrica depende de la incubación del Western blot con un sustrato que reacciona con la enzima reportera (como la peroxidasa ) que está unida al anticuerpo secundario. Esto convierte el colorante soluble en una forma insoluble de un color diferente que precipita junto a la enzima y, por lo tanto, tiñe la membrana. Luego, se detiene el desarrollo del blot lavando el colorante soluble. Los niveles de proteína se evalúan mediante densitometría (qué tan intensa es la tinción) o espectrofotometría .
Los métodos de detección por quimioluminiscencia dependen de la incubación del Western blot con un sustrato que emitirá luminiscencia cuando se exponga al marcador del anticuerpo secundario. Luego, la luz se detecta mediante cámaras CCD que capturan una imagen digital del Western blot o película fotográfica. El uso de película para la detección por Western blot está desapareciendo lentamente debido a la no linealidad de la imagen (cuantificación no precisa). La imagen se analiza mediante densitometría, que evalúa la cantidad relativa de tinción de proteínas y cuantifica los resultados en términos de densidad óptica. El software más nuevo permite realizar más análisis de datos, como el análisis del peso molecular, si se utilizan los estándares adecuados.
Las etiquetas radiactivas no requieren sustratos enzimáticos, sino que permiten la colocación de una película de rayos X médica directamente contra el Western blot, que se revela a medida que se expone a la etiqueta y crea regiones oscuras que corresponden a las bandas de proteína de interés (ver imagen de arriba). La importancia de los métodos de detección radiactiva está disminuyendo debido a su radiación peligrosa [ cita requerida ] , porque es muy cara, los riesgos para la salud y la seguridad son altos y la ECL (quimioluminiscencia mejorada) proporciona una alternativa útil.

La sonda marcada con fluorescencia se excita con luz y la emisión de la excitación se detecta luego mediante un fotosensor, como una cámara CCD equipada con filtros de emisión adecuados, que captura una imagen digital del Western blot y permite un análisis posterior de los datos, como el análisis del peso molecular y un análisis cuantitativo del Western blot. La fluorescencia se considera uno de los mejores métodos de cuantificación, pero es menos sensible que la quimioluminiscencia. [41]
Una diferencia importante entre las membranas de nitrocelulosa y PVDF se relaciona con la capacidad de cada una de ellas para permitir la "extracción" de anticuerpos y la reutilización de la membrana para posteriores sondas de anticuerpos. Si bien existen protocolos bien establecidos para la extracción de membranas de nitrocelulosa, el PVDF, más resistente, permite una extracción más sencilla y una mayor reutilización antes de que el ruido de fondo limite los experimentos. Otra diferencia es que, a diferencia de la nitrocelulosa, el PVDF debe empaparse en etanol al 95 %, isopropanol o metanol antes de su uso. Las membranas de PVDF también tienden a ser más gruesas y más resistentes a los daños durante el uso. [42]
Para garantizar que los resultados de los Western blots sean reproducibles, es importante informar los diversos parámetros mencionados anteriormente, incluida la preparación de la muestra, la concentración de proteína utilizada para la carga, el porcentaje de gel y las condiciones de funcionamiento, los diversos métodos de transferencia, las condiciones de intento de bloqueo, la concentración de anticuerpos y los métodos de identificación y determinación cuantitativa. Muchos de los artículos que se han publicado no cubren todas estas variables. Por lo tanto, es crucial describir diferentes circunstancias o parámetros experimentales para aumentar la repetibilidad y precisión del Western blot. Para aumentar la repetibilidad del Western blot, se requiere un criterio mínimo de informe. [2] [43]
La electroforesis en gel de poliacrilamida bidimensional (SDS-PAGE) utiliza los principios y técnicas descritos anteriormente. La electroforesis en gel de poliacrilamida bidimensional (SDS-PAGE) implica la migración de polipéptidos en dos dimensiones. Por ejemplo, en la primera dimensión, los polipéptidos se separan según su punto isoeléctrico , mientras que en la segunda dimensión, los polipéptidos se separan según su peso molecular . El punto isoeléctrico de una proteína determinada se determina por el número relativo de aminoácidos con carga positiva (p. ej., lisina, arginina) y negativa (p. ej., glutamato, aspartato), y los aminoácidos con carga negativa contribuyen a un punto isoeléctrico bajo y los aminoácidos con carga positiva contribuyen a un punto isoeléctrico alto. Las muestras también se pueden separar primero en condiciones no reductoras mediante SDS-PAGE, y en condiciones reductoras en la segunda dimensión, lo que rompe los enlaces disulfuro que mantienen unidas las subunidades. La electroforesis en gel de poliacrilamida bidimensional (SDS-PAGE) también se puede combinar con la electroforesis en gel de poliacrilamida con urea para obtener un gel bidimensional.
En principio, este método permite la separación de todas las proteínas celulares en un único gel de gran tamaño. Una de las principales ventajas de este método es que a menudo permite distinguir entre diferentes isoformas de una proteína concreta, por ejemplo, una proteína que ha sido fosforilada (mediante la adición de un grupo con carga negativa). Las proteínas que se han separado se pueden extraer del gel y luego analizar mediante espectrometría de masas , que identifica su peso molecular.
Puede haber una señal débil o ausente en la banda por diversas razones relacionadas con la cantidad de anticuerpo y antígeno utilizado. Este problema se puede resolver utilizando las concentraciones y diluciones ideales de antígeno y anticuerpo especificadas en la hoja de datos del proveedor. Aumentar el período de exposición en el software del sistema de detección puede solucionar las bandas débiles causadas por concentraciones más bajas de muestra y anticuerpo. [2]
Cuando las proteasas degradan la proteína, pueden aparecer varias bandas distintas a las bandas previstas de bajo peso molecular. El desarrollo de numerosas bandas se puede prevenir preparando adecuadamente las muestras de proteínas con suficientes inhibidores de proteasas. Pueden aparecer múltiples bandas en la región de alto peso molecular porque algunas proteínas forman dímeros, trímeros y multímeros; este problema se puede resolver calentando la muestra durante períodos de tiempo más prolongados. Las proteínas con modificaciones postraduccionales (PTM) o numerosas isoformas hacen que aparezcan varias bandas en varias áreas de peso molecular. Las PTM se pueden eliminar de una muestra utilizando productos químicos específicos, que también eliminan las bandas adicionales. [2]
Las concentraciones elevadas de anticuerpos, el bloqueo inadecuado, el lavado inadecuado y el tiempo de exposición excesivo durante la obtención de imágenes pueden dar lugar a un fondo alto en las manchas. Un fondo alto en las manchas se podría evitar solucionando estos problemas. [2]
Se ha afirmado que se han producido diversas bandas desiguales e irregulares, incluidos puntos negros, manchas o bandas blancas y bandas curvas. Los puntos en bloque se eliminan de las manchas mediante un bloqueo eficaz. Las manchas blancas se desarrollan como resultado de las burbujas entre la membrana y el gel. Las bandas blancas aparecen en las manchas cuando los anticuerpos principales y secundarios están presentes en concentraciones significativas. Debido al alto voltaje utilizado durante la ejecución del gel y la rápida migración de proteínas, aparecen bandas sonrientes en las manchas. Las bandas extrañas en la mancha se resuelven resolviendo estos problemas. [2]
Durante el Western blotting, pueden surgir varios problemas relacionados con los diferentes pasos de este procedimiento. Esos problemas pueden originarse en un paso de análisis de proteínas, como la detección de proteínas poco modificadas o postraduccionalmente modificadas. Además, pueden basarse en la selección de anticuerpos, ya que la calidad de los anticuerpos juega un papel importante en la detección de proteínas específicamente. [3] Debido a la presencia de este tipo de problemas, se están produciendo diversas mejoras en los campos de preparación de lisados celulares y procedimientos de transferencia para generar resultados confiables. Además, para lograr un análisis más sensible y superar los problemas asociados con el Western blotting, se han desarrollado y utilizado varias técnicas diferentes, como el Western blotting lejano , el Western blotting de difusión, el Western blotting de resolución de células individuales y el Western blotting microfluídico automatizado. [3]
Los investigadores utilizan distintos programas para procesar y alinear secciones de imágenes para una presentación elegante de los resultados de la prueba Western blot. Entre las herramientas más populares se encuentran Sciugo, Microsoft PowerPoint , Adobe Illustrator y GIMP .
Desde 1980, el método Western blot se ha convertido en el más utilizado en biología molecular para determinar la presencia y cantidad de una determinada proteína. A lo largo de los años, se han desarrollado numerosos métodos sistemáticos "avanzados" y "optimizados". Estos avances proporcionan resultados avanzados y más sensibles, con la ayuda de tecnologías de imagen más avanzadas y métodos modernos de marcaje fluorescente. [2]
El método con la tasa de adopción más alta para determinar las proteínas que se unen al ADN y las interacciones proteína-ADN es la prueba de desplazamiento de la movilidad electroforética. Los complejos proteína-ADN se analizan mediante el método de desplazamiento de la movilidad electroforética. Se crea mediante la transferencia de complejos proteína-ADN, en los que el ADN en la membrana cargada se coloca debajo de la membrana de nitrocelulosa mientras que las proteínas se mantienen en la membrana. Luego, se utilizan anticuerpos específicos para identificar las proteínas y se utiliza una etiqueta radiactiva para identificar el ADN. Además, las proteínas y el ADN transmitidos se pueden recuperar y examinar con mayor detalle. [2] [44]
El análisis de sangre de células individuales (scWB), además del análisis de sangre convencional, se considera un gran avance en el estudio de la localización subcelular de proteínas y en la evaluación de proteínas de células individuales. Se utiliza para medir los niveles y las condiciones de expresión de proteínas de una célula a la siguiente. Con la ayuda del análisis de sangre de células individuales, la selectividad y especificidad del análisis Western blot se ampliaron para incluir el análisis de proteínas de células individuales. Las limitaciones de precisión y sensibilidad de los anticuerpos se superan con esta técnica. Además, debido a su versatilidad, se puede utilizar para medir numerosas proteínas objetivo simultáneamente de diferentes líneas celulares y células individuales. [2] [45]
El desarrollo conocido como WB cuantificable basado en fluorescencia (QFWB) permite a los investigadores realizar análisis comparativos de expresión con una mayor sensibilidad y precisión que nunca. Cuantificable en QFWB se refiere a genuinamente cuantitativo con mayor sensibilidad. Este método se emplea para identificar las variaciones de expresión mínimas entre varias muestras. Con la ayuda de un anticuerpo secundario que ha sido marcado con fluorescencia, QFWB produce un perfil de detección lineal. Las técnicas modernas de QFWB permiten el etiquetado dual simultáneo y son más sensibles para identificar variaciones mínimas. [2] [46]
El Western blot cuantitativo computarizado analiza la reactividad de anticuerpos individuales a antígenos específicos para identificar determinantes inmunodominantes e inmunorecesivos utilizando dos medidas, como la intensidad de banda neta y la intensidad de carril total del WB. La creación de pruebas serodiagnósticas rápidas y vacunas eficientes es posible gracias a la identificación de ciertos antígenos inmunodominantes. El estudio busca marcadores serológicos para el diagnóstico temprano de cáncer, enfermedades virales y autoinmunes mediante Western blot cuantitativo computarizado. [2] [47]
Se trata de una técnica que combina la resolución de proteínas mediante electroforesis en gel de poliacrilamida con una plataforma de microarrays basada en microesferas que inmoviliza las proteínas en microesferas. Esta combinación de separación de proteínas, uniformidad y sensibilidad permite la cuantificación rápida de una serie de diferentes dianas proteicas, así como de sus cambios. La ventaja de DigiWest es que el Western blot se lleva a cabo utilizando microarrays basados en microesferas, lo que permite la detección y el análisis simultáneos de cientos de proteínas distintas y sus cambios utilizando una amplia gama de anticuerpos variados. [2] [48]
Para detectar muchas proteínas en un único chip microfluídico, se lleva a cabo un Western blot microfluídico mediante una serie de procesos, que incluyen el enriquecimiento de la muestra, el tamaño de la proteína, la deposición de la proteína y, a continuación, el sondeo de anticuerpos in situ. Un gel de poliacrilamida fotorreactivo (luz ultravioleta) y una superficie fotopatternable (luz azul) son la base de este procedimiento de varios pasos. Debido a las mejoras en el rendimiento analítico, el Western blot ahora se puede completar en 10 a 60 minutos, manteniendo al mismo tiempo los límites de detección de alta sensibilidad (50 picomoles) y los niveles de detección de componentes multiplexados (femtogramos). Por lo tanto, al fusionar una excelente especificidad y los beneficios de alto rendimiento de la multiplexación, el Western blot crea una piedra angular para la proteómica rápida. [2] [49]
Una técnica de WB mejorada, denominada WB multistrip, se basa en la transferencia simultánea de diferentes proteínas desde varias tiras de gel de poliacrilamida a una única membrana de difluoruro de polivinilideno o nitrocelulosa. La WB multistrip permite el seguimiento simultáneo de hasta nueve proteínas independientes a partir de la misma carga de la muestra y un aumento de hasta diez veces en la salida de datos para un único ciclo de WB. La biología de sistemas, la investigación de la señalización celular y los diagnósticos biomédicos se beneficiarían del uso de esta técnica. [2] [50]
La electroforesis capilar y en microchip basada en Western blot se creó para reducir la cantidad de muestras de proteínas y el tiempo que lleva ejecutar la electroforesis. Contribuye a una medición más sensible y precisa de varios objetivos proteicos a partir de cualquier lisado de una sola célula realizado en un microchip. 400 nanogramos de lisado celular son todo lo que se necesita para identificar y cuantificar once proteínas diferentes. [2] [51]
{{cite journal}}: CS1 maint: DOI inactivo a partir de julio de 2024 ( enlace ){{cite journal}}: CS1 maint: DOI inactivo a partir de julio de 2024 ( enlace )