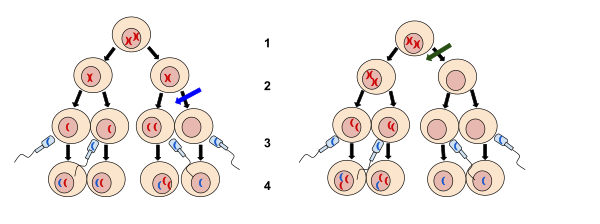
La no disyunción es la falla de los cromosomas homólogos o cromátidas hermanas para separarse adecuadamente durante la división celular ( mitosis / meiosis ). Hay tres formas de no disyunción: falla de un par de cromosomas homólogos para separarse en la meiosis I , falla de las cromátidas hermanas para separarse durante la meiosis II y falla de las cromátidas hermanas para separarse durante la mitosis . [1] [2] [3] La no disyunción da como resultado células hijas con números cromosómicos anormales ( aneuploidía ).
A Calvin Bridges y Thomas Hunt Morgan se les atribuye el descubrimiento de la no disyunción en los cromosomas sexuales de Drosophila melanogaster en la primavera de 1910, mientras trabajaban en el Laboratorio Zoológico de la Universidad de Columbia. [4]
En general, la no disyunción puede ocurrir en cualquier forma de división celular que implique una distribución ordenada de material cromosómico. Los animales superiores tienen tres formas distintas de división celular: la meiosis I y la meiosis II son formas especializadas de división celular que ocurren durante la generación de gametos (óvulos y espermatozoides) para la reproducción sexual; la mitosis es la forma de división celular utilizada por todas las demás células del cuerpo.
Los óvulos ovulados quedan detenidos en la metafase II hasta que la fertilización desencadena la segunda división meiótica. [5] De manera similar a los eventos de segregación de la mitosis , los pares de cromátidas hermanas resultantes de la separación de bivalentes en la meiosis I se separan aún más en la anafase de la meiosis II . En los ovocitos, una cromátida hermana se segrega en el segundo cuerpo polar, mientras que la otra permanece dentro del óvulo. Durante la espermatogénesis , cada división meiótica es simétrica de modo que cada espermatocito primario da lugar a 2 espermatocitos secundarios después de la meiosis I y, finalmente, a 4 espermátidas después de la meiosis II. La no disyunción de la meiosis II también puede dar lugar a síndromes de aneuploidía , pero sólo en mucha menor medida que los fallos de segregación en la meiosis I. [6]

La división de las células somáticas mediante mitosis está precedida por la replicación del material genético en la fase S. Como resultado, cada cromosoma consta de dos cromátidas hermanas unidas por el centrómero . En la anafase de la mitosis , las cromátidas hermanas se separan y migran a polos celulares opuestos antes de que la célula se divida. La no disyunción durante la mitosis hace que una hija reciba ambas cromátidas hermanas del cromosoma afectado mientras que la otra no recibe ninguna. [2] [3] Esto se conoce como puente de cromatina o puente de anafase. La no disyunción mitótica da como resultado un mosaicismo somático , ya que sólo las células hijas que se originan a partir de la célula donde se produjo el evento de no disyunción tendrán un número anormal de cromosomas . [3] La falta de disyunción durante la mitosis puede contribuir al desarrollo de algunas formas de cáncer , por ejemplo, retinoblastoma (ver más abajo). [7] La no disyunción cromosómica en la mitosis se puede atribuir a la inactivación de la topoisomerasa II , la condensina o la separasa . [8] La no disyunción meiótica ha sido bien estudiada en Saccharomyces cerevisiae . Esta levadura sufre mitosis de manera similar a otros eucariotas . Los puentes cromosómicos se producen cuando las cromátidas hermanas se mantienen unidas después de la replicación mediante el entrelazamiento topológico ADN-ADN y el complejo de cohesión . [9] Durante la anafase, la cohesina es escindida por la separasa. [10] La topoisomerasa II y la condensina son responsables de eliminar las catenaciones . [11]
El punto de control del ensamblaje del huso (SAC) es un mecanismo de protección molecular que gobierna la segregación cromosómica adecuada en las células eucariotas. [12] SAC inhibe la progresión a anafase hasta que todos los cromosomas homólogos (bivalentes o tétradas) estén correctamente alineados con el aparato del huso . Sólo entonces, SAC libera su inhibición del complejo promotor de la anafase (APC), que a su vez desencadena de forma irreversible la progresión a través de la anafase.
Los estudios de casos de síndromes de aneuploidía humana han demostrado que la mayoría de ellos son de origen materno. [5] Esto plantea la pregunta: ¿Por qué la meiosis femenina es más propensa a errores? La diferencia más obvia entre la ovogénesis femenina y la espermatogénesis masculina es la detención prolongada de los ovocitos en las últimas etapas de la profase I durante muchos años hasta varias décadas. Los gametos masculinos, por otro lado, pasan rápidamente por todas las etapas de la meiosis I y II. Otra diferencia importante entre la meiosis masculina y femenina se refiere a la frecuencia de recombinación entre cromosomas homólogos: en el hombre, casi todos los pares de cromosomas están unidos por al menos un cruce , mientras que más del 10% de los ovocitos humanos contienen al menos un bivalente sin ningún evento de cruce. . Se ha documentado bien que las fallas de recombinación o los cruces ubicados de manera inapropiada contribuyen a la aparición de no disyunción en humanos. [5]
Debido a la detención prolongada de los ovocitos humanos, el debilitamiento de los vínculos cohesivos que mantienen unidos a los cromosomas y la actividad reducida del SAC pueden contribuir a errores maternos relacionados con la edad en el control de la segregación . [6] [13] El complejo de cohesina es responsable de mantener unidas las cromátidas hermanas y proporciona sitios de unión para la unión del huso. La cohesina se carga en cromosomas recién replicados en oogonias durante el desarrollo fetal. Los ovocitos maduros sólo tienen una capacidad limitada para recargar cohesina una vez completada la fase S. Por tanto, la detención prolongada de ovocitos humanos antes de que se complete la meiosis I puede provocar una pérdida considerable de cohesina con el tiempo. Se supone que la pérdida de cohesina contribuye a errores incorrectos en la unión de microtúbulos y cinetocoros y en la segregación cromosómica durante las divisiones meióticas. [6]
El resultado de este error es una célula con un desequilibrio de cromosomas. Se dice que dicha célula es aneuploide . La pérdida de un solo cromosoma (2n-1), en la que a las células hijas con el defecto les faltará un cromosoma de uno de sus pares, se conoce como monosomía . La obtención de un solo cromosoma, en el que las células hijas con el defecto tendrán un cromosoma además de sus pares, se denomina trisomía . [3] En el caso de que se fertilice un gameto aneuploídico, pueden producirse varios síndromes.
La única monosomía conocida que puede sobrevivir en humanos es el síndrome de Turner , en el que el individuo afectado es monosómico para el cromosoma X (ver más abajo). Otras monosomías suelen ser letales durante el desarrollo fetal temprano, y la supervivencia sólo es posible si no todas las células del cuerpo se ven afectadas en caso de un mosaicismo (ver más abajo), o si se restablece el número normal de cromosomas mediante la duplicación de un único cromosoma. cromosoma ("rescate cromosómico"). [2]

La pérdida completa de un cromosoma X completo representa aproximadamente la mitad de los casos de síndrome de Turner . La importancia de ambos cromosomas X durante el desarrollo embrionario queda subrayada por la observación de que la abrumadora mayoría (>99%) de los fetos con un solo cromosoma X ( cariotipo 45, X0) son abortados espontáneamente. [14]
El término trisomía autosómica significa que un cromosoma distinto de los cromosomas sexuales X e Y está presente en 3 copias en lugar del número normal de 2 en las células diploides.

El síndrome de Down , una trisomía del cromosoma 21, es la anomalía más común del número de cromosomas en humanos. [2] La mayoría de los casos resultan de la no disyunción durante la meiosis materna I. [14] La trisomía ocurre en al menos el 0,3% de los recién nacidos y en casi el 25% de los abortos espontáneos . Es la principal causa de pérdida del embarazo y es la causa más común conocida de discapacidad intelectual . [15] Está bien documentado que la edad materna avanzada se asocia con un mayor riesgo de no disyunción meiótica que conduce al síndrome de Down. Esto puede estar asociado con la detención meiótica prolongada de los ovocitos humanos que podría durar más de cuatro décadas. [13]
Las trisomías autosómicas humanas compatibles con nacidos vivos, distintas del síndrome de Down (trisomía 21), son el síndrome de Edwards (trisomía 18) y el síndrome de Patau (trisomía 13). [1] [2] Las trisomías completas de otros cromosomas generalmente no son viables y representan una causa relativamente frecuente de aborto espontáneo. Sólo en casos raros de mosaicismo , la presencia de una línea celular normal, además de la línea celular trisómica, puede favorecer el desarrollo de una trisomía viable de los otros cromosomas. [2]
El término aneuploidía de los cromosomas sexuales resume las condiciones con un número anormal de cromosomas sexuales, es decir, distintos de XX (femenino) o XY (masculino). Formalmente, la monosomía del cromosoma X ( síndrome de Turner , ver arriba) también puede clasificarse como una forma de aneuploidía del cromosoma sexual.
El síndrome de Klinefelter es la aneuploidía de los cromosomas sexuales más común en humanos. Representa la causa más frecuente de hipogonadismo e infertilidad en los hombres. La mayoría de los casos son causados por errores de no disyunción en la meiosis paterna I. [2] Aproximadamente el ochenta por ciento de las personas con este síndrome tienen un cromosoma X adicional que da como resultado el cariotipo XXY. Los casos restantes tienen múltiples cromosomas sexuales adicionales (48,XXXY; 48,XXYY; 49,XXXXY), mosaicismo (46,XY/47,XXY) o anomalías cromosómicas estructurales. [2]
La incidencia del síndrome XYY es aproximadamente de 1 en 800 a 1000 nacimientos de varones. Muchos casos permanecen sin diagnosticar debido a su apariencia y fertilidad normales y a la ausencia de síntomas graves. El cromosoma Y adicional suele ser el resultado de la no disyunción durante la meiosis II paterna. [2]
La trisomía X es una forma de aneuploidía de los cromosomas sexuales en la que las mujeres tienen tres cromosomas X en lugar de dos. La mayoría de los pacientes sólo se ven levemente afectados por síntomas físicos y neuropsicológicos. Los estudios que examinaron el origen del cromosoma X extra observaron que alrededor del 58-63% de los casos fueron causados por la no disyunción en la meiosis materna I, el 16-18% por la no disyunción en la meiosis materna II, y los casos restantes por la meiosis postcigótica, es decir, mitótica. , no disyunción. [dieciséis]
La disomía uniparental denota la situación en la que ambos cromosomas de un par de cromosomas se heredan del mismo padre y, por tanto, son idénticos. Lo más probable es que este fenómeno sea el resultado de un embarazo que comenzó como una trisomía debido a la falta de disyunción. Como la mayoría de las trisomías son letales, el feto sólo sobrevive porque pierde uno de los tres cromosomas y se vuelve disómico. La disomía uniparental del cromosoma 15 se observa, por ejemplo, en algunos casos de síndrome de Prader-Willi y síndrome de Angelman . [14]
Los síndromes de mosaicismo pueden ser causados por una falta de disyunción mitótica en el desarrollo fetal temprano. Como consecuencia, el organismo evoluciona como una mezcla de líneas celulares con diferente ploidía (número de cromosomas). El mosaicismo puede estar presente en algunos tejidos, pero no en otros. Los individuos afectados pueden tener una apariencia irregular o asimétrica. Ejemplos de síndromes de mosaicismo incluyen el síndrome de Pallister-Killian y la hipomelanosis de Ito . [14]

El desarrollo del cáncer implica a menudo múltiples alteraciones del genoma celular ( hipótesis de Knudson ). El retinoblastoma humano es un ejemplo bien estudiado de un tipo de cáncer en el que la no disyunción mitótica puede contribuir a la transformación maligna: las mutaciones del gen RB1, que se encuentra en el cromosoma 13 y codifica la proteína supresora de tumores del retinoblastoma , pueden detectarse mediante análisis citogenético en muchos casos de retinoblastoma. Las mutaciones del locus RB1 en una copia del cromosoma 13 a veces van acompañadas de la pérdida del otro cromosoma 13 de tipo salvaje debido a la no disyunción mitótica. Debido a esta combinación de lesiones, las células afectadas pierden por completo la expresión de la proteína supresora de tumores funcional. [7]
El diagnóstico genético preimplantacional (PGD o PIGD) es una técnica utilizada para identificar embriones genéticamente normales y es útil para parejas que tienen antecedentes familiares de trastornos genéticos. Esta es una opción para las personas que eligen procrear mediante FIV . El PGD se considera difícil debido a que requiere mucho tiempo y tiene tasas de éxito sólo comparables a las de la FIV de rutina. [17]
El cariotipo implica realizar una amniocentesis para estudiar las células de un feto por nacer durante la metafase 1. La microscopía óptica se puede utilizar para determinar visualmente si la aneuploidía es un problema. [18]
El diagnóstico de cuerpos polares (PBD) se puede utilizar para detectar aneuploidías cromosómicas de origen materno, así como translocaciones en ovocitos. La ventaja del PBD sobre el PGD es que se puede lograr en poco tiempo. Esto se logra mediante perforación zonal o perforación láser. [19]
La biopsia de blastómeros es una técnica en la que se extraen blastómeros de la zona pelúcida . Se utiliza comúnmente para detectar aneuploidías. [20] El análisis genético se realiza una vez finalizado el procedimiento. Se necesitan estudios adicionales para evaluar el riesgo asociado con el procedimiento. [21]
La exposición de los espermatozoides a riesgos relacionados con el estilo de vida, el medio ambiente y/o el trabajo puede aumentar el riesgo de aneuploidía. El humo del cigarrillo es un conocido aneugen ( agente inductor de aneuploidía ). Se asocia con aumentos de la aneuploidía que oscilan entre 1,5 y 3,0 veces. [22] [23] Otros estudios indican que factores como el consumo de alcohol, [24] la exposición ocupacional al benceno , [25] y la exposición a los insecticidas fenvalerato [26] y carbarilo [27] también aumentan la aneuploidía.
{{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )