La cromatografía de exclusión por tamaño , también conocida como cromatografía de tamiz molecular , [1] es un método cromatográfico en el que las moléculas en solución se separan por su forma y, en algunos casos, por su tamaño . [2] Por lo general, se aplica a moléculas grandes o complejos macromoleculares como proteínas y polímeros industriales . [3] Normalmente, cuando se utiliza una solución acuosa para transportar la muestra a través de la columna, la técnica se conoce como cromatografía de filtración en gel , frente al nombre de cromatografía de permeación en gel , que se utiliza cuando se utiliza un disolvente orgánico como fase móvil. La columna de cromatografía está llena de perlas finas y porosas que comúnmente están compuestas de polímeros de dextrano , agarosa o poliacrilamida . Los tamaños de poro de estas perlas se utilizan para estimar las dimensiones de las macromoléculas . [1] La SEC es un método de caracterización de polímeros ampliamente utilizado debido a su capacidad para proporcionar buenos resultados de distribución de masa molar (Mw) para polímeros.
La cromatografía de exclusión por tamaño (SEC) es fundamentalmente diferente de todas las demás técnicas cromatográficas en que la separación se basa en un procedimiento simple de clasificación de tamaños de moléculas en lugar de cualquier tipo de interacción. [4]
La principal aplicación de la cromatografía de exclusión por tamaño es el fraccionamiento de proteínas y otros polímeros solubles en agua, mientras que la cromatografía de permeación en gel se utiliza para analizar la distribución del peso molecular de polímeros solubles en materia orgánica. Ninguna de las técnicas debe confundirse con la electroforesis en gel , donde se utiliza un campo eléctrico para "tirar" de las moléculas a través del gel en función de sus cargas eléctricas. La cantidad de tiempo que un soluto permanece dentro de un poro depende del tamaño del poro. Los solutos más grandes tendrán acceso a un volumen más pequeño y viceversa. Por lo tanto, un soluto más pequeño permanecerá dentro del poro durante un período de tiempo más largo en comparación con un soluto más grande. [5]
Aunque la cromatografía de exclusión por tamaño se utiliza ampliamente para estudiar material orgánico natural, existen limitaciones. Una de estas limitaciones es que no existe un marcador de peso molecular estándar; [6] por lo tanto, no hay nada con qué comparar los resultados. Si se requiere un peso molecular preciso, se deben utilizar otros métodos.
Las ventajas de este método incluyen una buena separación de moléculas grandes de las moléculas pequeñas con un volumen mínimo de eluato [7], y que se pueden aplicar varias soluciones sin interferir con el proceso de filtración, todo ello preservando la actividad biológica de las partículas a separar. La técnica generalmente se combina con otras que separan aún más las moléculas mediante otras características, como la acidez, la basicidad, la carga y la afinidad por ciertos compuestos. Con la cromatografía de exclusión por tamaño, hay tiempos de separación cortos y bien definidos y bandas estrechas, lo que conduce a una buena sensibilidad. Tampoco hay pérdida de muestra porque los solutos no interactúan con la fase estacionaria.
La otra ventaja de este método experimental es que en ciertos casos es posible determinar el peso molecular aproximado de un compuesto. La forma y el tamaño del compuesto (eluyente) determinan cómo interactúa el compuesto con el gel (fase estacionaria). Para determinar el peso molecular aproximado, se obtienen los volúmenes de elución de los compuestos con sus pesos moleculares correspondientes y luego se realiza un gráfico de “K av ” vs “log(Mw)”, donde y Mw es la masa molecular. Este gráfico actúa como una curva de calibración, que se utiliza para aproximar el peso molecular del compuesto deseado. El componente V e representa el volumen en el que eluyen las moléculas intermedias, como las moléculas que tienen acceso parcial a las perlas de la columna. Además, V t es la suma del volumen total entre las perlas y el volumen dentro de las perlas. El componente V o representa el volumen en el que eluyen las moléculas más grandes, que eluyen al principio. [8] [9] Las desventajas son, por ejemplo, que sólo se puede acomodar un número limitado de bandas porque la escala de tiempo del cromatograma es corta y, en general, debe haber una diferencia del 10% en la masa molecular para tener una buena resolución. [7]
La técnica fue inventada en 1955 por Grant Henry Lathe y Colin R Ruthven, que trabajaban en el Hospital Queen Charlotte de Londres. [10] [11] Más tarde recibieron el premio John Scott por esta invención. [12] Mientras que Lathe y Ruthven utilizaron geles de almidón como matriz, Jerker Porath y Per Flodin introdujeron más tarde geles de dextrano; [13] otros geles con propiedades de fraccionamiento por tamaño incluyen la agarosa y la poliacrilamida. Se ha publicado una breve revisión de estos desarrollos. [14]
También hubo intentos de fraccionar polímeros sintéticos de alto peso molecular; sin embargo, no fue hasta 1964, cuando JC Moore de la Dow Chemical Company publicó su trabajo sobre la preparación de columnas de cromatografía de permeación en gel (GPC) basadas en poliestireno reticulado con tamaño de poro controlado, [15] que comenzó un rápido aumento de la actividad de investigación en este campo. Se reconoció casi de inmediato que con una calibración adecuada, la GPC era capaz de proporcionar información sobre la masa molar y la distribución de la masa molar de los polímeros sintéticos. Debido a que esta última información era difícil de obtener por otros métodos, la GPC se utilizó rápidamente de forma extensiva. [16]

La SEC se utiliza principalmente para el análisis de moléculas grandes, como proteínas o polímeros. La SEC funciona atrapando moléculas más pequeñas en los poros del adsorbente ("fase estacionaria"). Este proceso se realiza normalmente dentro de una columna, que normalmente consta de un tubo hueco repleto de microesferas de polímero a escala micrométrica que contienen poros de diferentes tamaños. Estos poros pueden ser depresiones en la superficie o canales a través de la microesfera. A medida que la solución se desplaza por la columna, algunas partículas entran en los poros. Las partículas más grandes no pueden entrar en tantos poros. Cuanto más grandes sean las partículas, más rápida será la elución. Las moléculas más grandes simplemente pasan por los poros porque esas moléculas son demasiado grandes para entrar en ellos. Por lo tanto, las moléculas más grandes fluyen a través de la columna más rápidamente que las moléculas más pequeñas, es decir, cuanto más pequeña sea la molécula, mayor será el tiempo de retención.
Un requisito para la SEC es que el analito no interactúe con la superficie de las fases estacionarias, y las diferencias en el tiempo de elución entre analitos idealmente se basan únicamente en el volumen de soluto en el que pueden ingresar los analitos, en lugar de en interacciones químicas o electrostáticas con las fases estacionarias. Por lo tanto, una molécula pequeña que puede penetrar cada región del sistema de poros de la fase estacionaria puede ingresar en un volumen total igual a la suma del volumen total de poros y el volumen entre partículas. Esta molécula pequeña eluye tarde (después de que la molécula ha penetrado todo el volumen de poros e interpartículas, aproximadamente el 80% del volumen de la columna). En el otro extremo, una molécula muy grande que no puede penetrar ninguno de los poros más pequeños puede ingresar solo en el volumen entre partículas (~35% del volumen de la columna) y eluye antes cuando este volumen de fase móvil ha pasado a través de la columna. El principio subyacente de la SEC es que las partículas de diferentes tamaños eluyen (filtran) a través de una fase estacionaria a diferentes velocidades. Esto da como resultado la separación de una solución de partículas en función del tamaño. Siempre que todas las partículas se carguen simultáneamente o casi simultáneamente, las partículas del mismo tamaño deberían eluirse juntas.
Sin embargo, como existen varias medidas del tamaño de una macromolécula (por ejemplo, el radio de giro y el radio hidrodinámico), un problema fundamental en la teoría de SEC ha sido la elección de un parámetro de tamaño molecular adecuado por el cual se separan las moléculas de diferentes tipos. Experimentalmente, Benoit y sus colaboradores encontraron una excelente correlación entre el volumen de elución y un tamaño molecular basado dinámicamente, el volumen hidrodinámico , para varias arquitecturas de cadena y composiciones químicas diferentes. [17] La correlación observada basada en el volumen hidrodinámico se aceptó como la base de la calibración universal de SEC.
Sin embargo, el uso del volumen hidrodinámico, un tamaño basado en propiedades dinámicas, en la interpretación de los datos SEC no se entiende completamente. [18] Esto se debe a que SEC generalmente se ejecuta en condiciones de bajo caudal donde el factor hidrodinámico debería tener poco efecto en la separación. De hecho, tanto la teoría como las simulaciones por computadora suponen un principio de separación termodinámica: el proceso de separación está determinado por la distribución de equilibrio (partición) de macromoléculas de soluto entre dos fases: una fase de solución a granel diluida ubicada en el espacio intersticial y fases de solución confinadas dentro de los poros del material de relleno de la columna. Con base en esta teoría, se ha demostrado que el parámetro de tamaño relevante para la partición de polímeros en poros es la dimensión media del tramo (proyección máxima media sobre una línea). [19] Aunque este problema no se ha resuelto por completo, es probable que la dimensión media del tramo y el volumen hidrodinámico estén fuertemente correlacionados.

Cada columna de exclusión por tamaño tiene un rango de pesos moleculares que se pueden separar. El límite de exclusión define el peso molecular en el extremo superior del rango de "trabajo" de la columna y es donde las moléculas son demasiado grandes para quedar atrapadas en la fase estacionaria. El extremo inferior del rango está definido por el límite de permeación, que define el peso molecular de una molécula que es lo suficientemente pequeña como para penetrar todos los poros de la fase estacionaria. Todas las moléculas por debajo de esta masa molecular son tan pequeñas que eluyen como una sola banda. [7]
La solución filtrada que se recoge al final se conoce como eluato . El volumen vacío incluye todas las partículas demasiado grandes para entrar en el medio y el volumen del disolvente se conoce como volumen de la columna .
A continuación se presentan los materiales que se utilizan comúnmente para las perlas de gel porosas en la cromatografía de exclusión por tamaño [20]

En situaciones de la vida real, las partículas en solución no tienen un tamaño fijo, lo que da como resultado la probabilidad de que una partícula que de otro modo se vería obstaculizada por un poro que pasa justo por encima de ella. Además, las partículas de la fase estacionaria no están definidas de manera ideal; tanto las partículas como los poros pueden variar en tamaño. Por lo tanto, las curvas de elución se parecen a las distribuciones gaussianas . La fase estacionaria también puede interactuar de formas indeseables con una partícula e influir en los tiempos de retención, aunque los fabricantes de columnas tienen mucho cuidado de utilizar fases estacionarias que sean inertes y minimicen este problema.
Al igual que otras formas de cromatografía, aumentar la longitud de la columna mejora la resolución, y aumentar el diámetro de la columna aumenta la capacidad de la columna. El empaquetamiento adecuado de la columna es importante para obtener la máxima resolución: una columna demasiado empaquetada puede colapsar los poros de las perlas, lo que da como resultado una pérdida de resolución. Una columna poco empaquetada puede reducir el área de superficie relativa de la fase estacionaria accesible a especies más pequeñas, lo que hace que esas especies pasen menos tiempo atrapadas en los poros. A diferencia de las técnicas de cromatografía de afinidad, un cabezal de disolvente en la parte superior de la columna puede disminuir drásticamente la resolución a medida que la muestra se difunde antes de la carga, lo que amplía la elución posterior.
En columnas manuales sencillas, el eluyente se recoge en volúmenes constantes, conocidos como fracciones. Cuanto más similares sean las partículas en tamaño, más probable es que se encuentren en la misma fracción y no se detecten por separado. Las columnas más avanzadas superan este problema controlando constantemente el eluyente.

Las fracciones recolectadas se examinan a menudo mediante técnicas espectroscópicas para determinar la concentración de las partículas eluidas. Las técnicas de detección espectroscópica más comunes son el índice de refracción (IR) y la luz ultravioleta (UV). Cuando se eluyen especies espectroscópicamente similares (como durante la purificación biológica), pueden ser necesarias otras técnicas para identificar el contenido de cada fracción. También es posible analizar el flujo de eluyente de forma continua con mediciones de IR, LALLS , dispersión de luz láser multiángulo (MALS), UV y/o viscosidad.
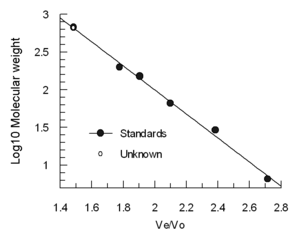
El volumen de elución (Ve) disminuye aproximadamente de manera lineal con el logaritmo del volumen hidrodinámico molecular . Las columnas se calibran a menudo utilizando 4-5 muestras estándar (por ejemplo, proteínas plegadas de peso molecular conocido) y una muestra que contiene una molécula muy grande como la tiroglobulina para determinar el volumen vacío. (No se recomienda el dextrano azul para la determinación de Vo porque es heterogéneo y puede dar resultados variables) Los volúmenes de elución de los estándares se dividen por el volumen de elución de la tiroglobulina (Ve/Vo) y se grafican contra el logaritmo de los pesos moleculares de los estándares.
En general, la SEC se considera una cromatografía de baja resolución, ya que no distingue muy bien las especies similares y, por lo tanto, a menudo se reserva para el paso final de una purificación. La técnica puede determinar la estructura cuaternaria de las proteínas purificadas que tienen tiempos de intercambio lentos, ya que se puede llevar a cabo en condiciones de solución nativa, preservando las interacciones macromoleculares. La SEC también puede ensayar la estructura terciaria de las proteínas , ya que mide el volumen hidrodinámico (no el peso molecular), lo que permite distinguir las versiones plegadas y desplegadas de la misma proteína. Por ejemplo, el radio hidrodinámico aparente de un dominio proteico típico podría ser de 14 Å y 36 Å para las formas plegadas y desplegadas, respectivamente. La SEC permite la separación de estas dos formas, ya que la forma plegada eluye mucho más tarde debido a su menor tamaño.
La SEC se puede utilizar como medida tanto del tamaño como de la polidispersidad de un polímero sintetizado , es decir, la capacidad de encontrar la distribución de los tamaños de las moléculas de polímero. Si se ejecutan previamente estándares de un tamaño conocido, se puede crear una curva de calibración para determinar los tamaños de las moléculas de polímero de interés en el disolvente elegido para el análisis (a menudo THF ). De manera alternativa, se pueden utilizar técnicas como la dispersión de la luz y/o la viscosimetría en línea con SEC para producir pesos moleculares absolutos que no dependen de la calibración con estándares de peso molecular conocido. Debido a la diferencia de tamaño de dos polímeros con pesos moleculares idénticos, los métodos de determinación absoluta son, en general, más deseables. Un sistema SEC típico puede proporcionar rápidamente (en aproximadamente media hora) a los químicos de polímeros información sobre el tamaño y la polidispersidad de la muestra. La SEC preparativa se puede utilizar para el fraccionamiento de polímeros a escala analítica.
En SEC, no se mide tanto la masa como el volumen hidrodinámico de las moléculas de polímero, es decir, cuánto espacio ocupa una molécula de polímero particular cuando está en solución. Sin embargo, el peso molecular aproximado se puede calcular a partir de los datos de SEC porque se puede encontrar la relación exacta entre el peso molecular y el volumen hidrodinámico para el poliestireno. Para esto, se utiliza el poliestireno como estándar. Pero la relación entre el volumen hidrodinámico y el peso molecular no es la misma para todos los polímeros, por lo que solo se puede obtener una medición aproximada. [21] Otro inconveniente es la posibilidad de interacción entre la fase estacionaria y el analito. Cualquier interacción conduce a un tiempo de elución posterior y, por lo tanto, imita un tamaño de analito más pequeño.
Al realizar este método, las bandas de las moléculas eluyentes pueden ensancharse. Esto puede ocurrir por la turbulencia causada por el flujo de las moléculas de la fase móvil que pasan a través de las moléculas de la fase estacionaria. Además, la difusión térmica molecular y la fricción entre las moléculas de las paredes de vidrio y las moléculas del eluyente contribuyen al ensanchamiento de las bandas. Además del ensanchamiento, las bandas también se superponen entre sí. Como resultado, el eluyente generalmente se diluye considerablemente. Se pueden tomar algunas precauciones para evitar la probabilidad de ensanchamiento de las bandas. Por ejemplo, se puede aplicar la muestra en una banda estrecha y altamente concentrada en la parte superior de la columna. Cuanto más concentrado esté el eluyente, más eficiente será el procedimiento. Sin embargo, no siempre es posible concentrar el eluyente, lo que puede considerarse como una desventaja más. [9]
La cromatografía de exclusión por tamaño absoluta (ASEC) es una técnica que acopla un instrumento de dispersión de luz, más comúnmente dispersión de luz multiángulo (MALS) u otra forma de dispersión de luz estática (SLS), pero posiblemente un instrumento de dispersión de luz dinámica (DLS), a un sistema de cromatografía de exclusión por tamaño para mediciones de masa molar absoluta y/o tamaño de proteínas y macromoléculas a medida que eluyen del sistema de cromatografía. [22]
La definición de “absoluto” en este caso es que no se requiere la calibración del tiempo de retención en la columna con un conjunto de estándares de referencia para obtener la masa molar o el tamaño hidrodinámico, a menudo denominado diámetro hidrodinámico (D H en unidades de nm). Las interacciones de columna no ideales, como las interacciones de superficie electrostáticas o hidrofóbicas que modulan el tiempo de retención en relación con los estándares, no afectan el resultado final. Asimismo, las diferencias entre la conformación del analito y el estándar no tienen efecto en una medición absoluta; por ejemplo, con el análisis MALS, la masa molar de las proteínas inherentemente desordenadas se caracteriza con precisión aunque eluyan en tiempos mucho más tempranos que las proteínas globulares con la misma masa molar, y lo mismo es cierto para los polímeros ramificados que eluyen tarde en comparación con los estándares de referencia lineales con la misma masa molar. [22] [23] [24] Otro beneficio de ASEC es que la masa molar y/o el tamaño se determinan en cada punto en un pico de elución y, por lo tanto, indican homogeneidad o polidispersidad dentro del pico. Por ejemplo, el análisis SEC-MALS de una proteína monodispersa mostrará que todo el pico está formado por moléculas con la misma masa molar, algo que no es posible con el análisis SEC estándar.
La determinación de la masa molar con SLS requiere combinar las mediciones de dispersión de luz con las mediciones de concentración. Por lo tanto, SEC-MALS normalmente incluye el detector de dispersión de luz y un refractómetro diferencial o un detector de absorbancia UV/Vis. Además, MALS determina el radio rms R g de las moléculas por encima de un cierto límite de tamaño, normalmente 10 nm. Por lo tanto, SEC-MALS puede analizar la conformación de polímeros a través de la relación de la masa molar con R g . Para moléculas más pequeñas, se agrega DLS o, más comúnmente, un viscosímetro diferencial para determinar el radio hidrodinámico y evaluar la conformación molecular de la misma manera.
En SEC-DLS, los tamaños de las macromoléculas se miden a medida que se eluyen en la celda de flujo del instrumento DLS desde el conjunto de columnas de exclusión por tamaño. Se mide el tamaño hidrodinámico de las moléculas o partículas y no sus pesos moleculares. En el caso de las proteínas, se puede utilizar un cálculo de tipo Mark-Houwink para estimar el peso molecular a partir del tamaño hidrodinámico.
Una ventaja importante de la DLS acoplada con SEC es la capacidad de obtener una resolución DLS mejorada. [25] La DLS por lotes es rápida y sencilla y proporciona una medida directa del tamaño promedio, pero la resolución de referencia de la DLS es una relación de 3:1 en diámetro. Usando SEC, las proteínas y los oligómeros de proteínas se separan, lo que permite la resolución oligomérica. Los estudios de agregación también se pueden realizar usando ASEC. Aunque la concentración de agregados no se puede calcular con dispersión de luz (un detector de concentración en línea como el que se usa en SEC-MALS para la medición de masa molar también determina la concentración de agregados), el tamaño del agregado se puede medir, solo limitado por el tamaño máximo que eluye de las columnas SEC.
Las limitaciones de la detección ASEC con DLS incluyen el caudal, la concentración y la precisión. Debido a que una función de correlación requiere entre 3 y 7 segundos para generarse correctamente, se puede recopilar una cantidad limitada de puntos de datos en todo el pico. La detección ASEC con SLS no está limitada por el caudal y el tiempo de medición es esencialmente instantáneo, y el rango de concentración es varios órdenes de magnitud mayor que para DLS. Sin embargo, el análisis de masa molar con SEC-MALS requiere mediciones de concentración precisas. Los detectores MALS y DLS a menudo se combinan en un solo instrumento para un análisis absoluto más completo después de la separación por SEC.