La clorofila a es una forma específica de clorofila utilizada en la fotosíntesis oxigénica . Absorbe la mayor parte de la energía de las longitudes de onda de la luz violeta-azul y naranja-roja, y es un pobre absorbente de las porciones verdes y casi verdes del espectro. [3] La clorofila no refleja la luz, pero los tejidos que contienen clorofila parecen verdes porque la luz verde se refleja de forma difusa en estructuras como las paredes celulares. [4] Este pigmento fotosintético es esencial para la fotosíntesis en eucariotas , cianobacterias y proclorofitas debido a su papel como donante primario de electrones en la cadena de transporte de electrones . [5] La clorofila a también transfiere energía de resonancia en el complejo de antena , que termina en el centro de reacción donde se encuentran las clorofilas específicas P680 y P700 . [6]
La clorofila a es esencial para que la mayoría de los organismos fotosintéticos liberen energía química , pero no es el único pigmento que se puede utilizar para la fotosíntesis. Todos los organismos fotosintéticos oxigénicos utilizan clorofila a , pero difieren en pigmentos accesorios como la clorofila b . [5] La clorofila a también se puede encontrar en cantidades muy pequeñas en las bacterias verdes del azufre , un fotoautótrofo anaeróbico . [7] Estos organismos utilizan bacterioclorofila y algo de clorofila a , pero no producen oxígeno. [7] La fotosíntesis anoxigénica es el término que se aplica a este proceso, a diferencia de la fotosíntesis oxigénica , donde el oxígeno se produce durante las reacciones luminosas de la fotosíntesis .
La estructura molecular de la clorofila a consiste en un anillo de clorina , cuyos cuatro átomos de nitrógeno rodean un átomo central de magnesio , y tiene varias otras cadenas laterales unidas y una cola de hidrocarburo formada por un éster de fitol .
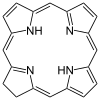
La clorofila a contiene un ion magnesio encerrado en una gran estructura de anillo conocida como clorina . El anillo de clorina es un compuesto heterocíclico derivado del pirrol . Cuatro átomos de nitrógeno de la clorina rodean y unen el átomo de magnesio. El centro de magnesio define de forma única la estructura como una molécula de clorofila. [8] El anillo de porfirina de la bacterioclorofila está saturado y carece de alternancia de enlaces dobles y simples, lo que provoca variaciones en la absorción de la luz. [9]

Las cadenas laterales están unidas al anillo de clorina de las distintas moléculas de clorofila. Diferentes cadenas laterales caracterizan cada tipo de molécula de clorofila y alteran el espectro de absorción de la luz. [10] [11] Por ejemplo, la única diferencia entre la clorofila a y la clorofila b es que la clorofila b tiene un aldehído en lugar de un grupo metilo en la posición C-7. [11]
El éster fitol de la clorofila a (R en el diagrama) es una larga cola hidrófoba que ancla la molécula a otras proteínas hidrófobas en la membrana tilacoide del cloroplasto . [5] Una vez separado del anillo de porfirina, el fitol se convierte en el precursor de dos biomarcadores , el pristano y el fitano , que son importantes en el estudio de la geoquímica y la determinación de las fuentes de petróleo. [12]
La vía biosintética de la clorofila a utiliza una variedad de enzimas . [13] En la mayoría de las plantas, la clorofila se deriva del glutamato y se sintetiza a lo largo de una vía ramificada que se comparte con el hemo y el sirohemo . [14] [15] [16] Los pasos iniciales incorporan ácido glutámico en ácido 5-aminolevulínico (ALA); luego, dos moléculas de ALA se reducen a porfobilinógeno (PBG) y cuatro moléculas de PBG se acoplan, formando protoporfirina IX. [8]
La clorofila sintasa [17] es la enzima que completa la biosíntesis de la clorofila a [18] [19] catalizando la reacción EC 2.5.1.62
Esto forma un éster del grupo de ácido carboxílico en clorofilida a con el alcohol diterpénico de 20 carbonos fitol .

La clorofila a absorbe la luz en las longitudes de onda violeta , azul y roja . Los pigmentos fotosintéticos accesorios amplían el espectro de luz absorbida, aumentando el rango de longitudes de onda que se pueden utilizar en la fotosíntesis. [5] La adición de clorofila b junto a la clorofila a extiende el espectro de absorción . En condiciones de poca luz, las plantas producen una mayor proporción de moléculas de clorofila b respecto a clorofila a , lo que aumenta el rendimiento fotosintético. [10]

La absorción de luz por los pigmentos fotosintéticos convierte los fotones en energía química. La energía luminosa que irradia el cloroplasto incide en los pigmentos de la membrana del tilacoide y excita sus electrones. Dado que las moléculas de clorofila a solo captan ciertas longitudes de onda, los organismos pueden utilizar pigmentos accesorios para captar una gama más amplia de energía luminosa, que se muestra como círculos amarillos. [6] Luego transfiere la luz captada de un pigmento al siguiente como energía de resonancia, pasando energía de un pigmento al otro hasta llegar a las moléculas especiales de clorofila a en el centro de reacción. [10] Estas moléculas especiales de clorofila a se encuentran tanto en el fotosistema II como en el fotosistema I. Se conocen como P680 para el fotosistema II y P700 para el fotosistema I. [20] P680 y P700 son los principales donantes de electrones a la cadena de transporte de electrones. Estos dos sistemas son diferentes en sus potenciales redox para la oxidación de un electrón. La E m para P700 es de aproximadamente 500 mV, mientras que la E m para P680 es de aproximadamente 1100-1200 mV. [20]
La clorofila a es muy importante en la fase energética de la fotosíntesis. Para que se lleve a cabo el proceso de fotosíntesis, es necesario que dos electrones pasen a un aceptor de electrones . [5] Dentro de los centros de reacción de ambos fotosistemas hay un par de moléculas de clorofila a que pasan electrones a la cadena de transporte a través de reacciones redox . [20]
La concentración de clorofila A se utiliza como índice de la biomasa del fitoplancton. En el océano, todo el fitoplancton contiene el pigmento clorofila, que tiene un color verdoso.
El fitoplancton está formado por organismos microscópicos que viven en ambientes acuáticos y los cambios en la cantidad de fitoplancton indican cambios en la productividad del océano. El fitoplancton puede verse afectado indirectamente por factores climáticos, como cambios en la temperatura del agua y vientos superficiales. [21]