En bioquímica , las isomerasas son una clase general de enzimas que convierten una molécula de un isómero a otro. Las isomerasas facilitan los reordenamientos intramoleculares en los que se rompen y forman enlaces . La forma general de una reacción de este tipo es la siguiente:
Solo hay un sustrato que produce un producto. Este producto tiene la misma fórmula molecular que el sustrato, pero difiere en la conectividad de los enlaces o la disposición espacial. Las isomerasas catalizan reacciones en muchos procesos biológicos, como la glucólisis y el metabolismo de los carbohidratos .
Las isomerasas catalizan cambios dentro de una molécula. [1] Convierten un isómero en otro, lo que significa que el producto final tiene la misma fórmula molecular pero una estructura física diferente. Los isómeros en sí mismos existen en muchas variedades, pero generalmente se pueden clasificar como isómeros estructurales o estereoisómeros . Los isómeros estructurales tienen un orden diferente de enlaces y/o diferente conectividad de enlaces entre sí, como en el caso del hexano y sus otras cuatro formas isoméricas ( 2-metilpentano , 3-metilpentano , 2,2-dimetilbutano y 2,3-dimetilbutano ).
Los estereoisómeros tienen el mismo orden de enlaces individuales y la misma conectividad, pero la disposición tridimensional de los átomos enlazados difiere. Por ejemplo, el 2-buteno existe en dos formas isoméricas: cis -2-buteno y trans -2-buteno. [2] Las subcategorías de isomerasas que contienen racemasas, epimerasas e isómeros cis-trans son ejemplos de enzimas que catalizan la interconversión de estereoisómeros. Las liasas intramoleculares, oxidorreductasas y transferasas catalizan la interconversión de isómeros estructurales.
La prevalencia de cada isómero en la naturaleza depende en parte de la energía de isomerización , la diferencia de energía entre isómeros. Los isómeros cercanos en energía pueden interconvertirse fácilmente y a menudo se ven en proporciones comparables. La energía de isomerización, por ejemplo, para convertir de un isómero cis estable al isómero trans menos estable es mayor que para la reacción inversa, lo que explica por qué en ausencia de isomerasas o una fuente de energía externa como la radiación ultravioleta un isómero cis dado tiende a estar presente en mayores cantidades que el isómero trans . Las isomerasas pueden aumentar la velocidad de reacción al reducir la energía de isomerización. [3]
Calcular la cinética de la isomerasa a partir de datos experimentales puede ser más difícil que para otras enzimas porque el uso de experimentos de inhibición del producto es poco práctico. [4] Es decir, la isomerización no es una reacción irreversible ya que un recipiente de reacción contendrá un sustrato y un producto, por lo que el modelo simplificado típico para calcular la cinética de la reacción no se sostiene. También existen dificultades prácticas para determinar el paso determinante de la velocidad a altas concentraciones en una sola isomerización. En cambio, la perturbación del trazador puede superar estas dificultades técnicas si hay dos formas de la enzima no unida. Esta técnica utiliza el intercambio de isótopos para medir indirectamente la interconversión de la enzima libre entre sus dos formas. El sustrato y el producto radiomarcados se difunden de manera dependiente del tiempo. Cuando el sistema alcanza el equilibrio, la adición de sustrato no marcado lo perturba o desequilibra. A medida que se establece el equilibrio nuevamente, se rastrea el sustrato y el producto radiomarcados para determinar la información energética. [5]
El uso más temprano de esta técnica dilucidó la cinética y el mecanismo subyacente a la acción de la fosfoglucomutasa , favoreciendo el modelo de transferencia indirecta de fosfato con un intermediario y la transferencia directa de glucosa . [6] Esta técnica se adoptó luego para estudiar el perfil de la prolina racemasa y sus dos estados: la forma que isomeriza L- prolina y la otra para D-prolina. A altas concentraciones se demostró que el estado de transición en esta interconversión es limitante de la velocidad y que estas formas enzimáticas pueden diferir solo en la protonación en los grupos ácidos y básicos del sitio activo . [5]
Generalmente, "los nombres de las isomerasas se forman como " isomerasa de sustrato " (por ejemplo, enoil CoA isomerasa ), o como " tipo de sustrato de isomerasa " (por ejemplo, fosfoglucomutasa )." [7]
Cada reacción catalizada por enzimas tiene un número de clasificación asignado de forma exclusiva. Las reacciones catalizadas por isomerasas tienen su propia categoría EC : EC 5. [8] Las isomerasas se clasifican además en seis subclases:
Esta categoría (EC 5.1) incluye ( racemasas ) y epimerasas ). Estas isomerasas invierten la estereoquímica en el carbono quiral objetivo . Las racemasas actúan sobre moléculas con un carbono quiral para la inversión de la estereoquímica, mientras que las epimerasas se dirigen a moléculas con múltiples carbonos quirales y actúan sobre uno de ellos. Una molécula con un solo carbono quiral tiene dos formas enantioméricas , como la serina que tiene las isoformas D-serina y L-serina que difieren solo en la configuración absoluta sobre el carbono quiral. Una molécula con múltiples carbonos quirales tiene dos formas en cada carbono quiral. La isomerización en un carbono quiral de varios produce epímeros , que difieren entre sí en la configuración absoluta en solo un carbono quiral. [2] Por ejemplo, D- glucosa y D- manosa difieren en la configuración en solo un carbono quiral. Esta clase se desglosa aún más por el grupo sobre el que actúa la enzima:
Esta categoría (EC 5.2) incluye enzimas que catalizan la isomerización de isómeros cis-trans . Los alquenos y cicloalcanos pueden tener estereoisómeros cis-trans. Estos isómeros no se distinguen por la configuración absoluta sino por la posición de los grupos sustituyentes en relación con un plano de referencia, como a través de un doble enlace o en relación con una estructura de anillo. Los isómeros cis tienen grupos sustituyentes en el mismo lado y los isómeros trans tienen grupos en lados opuestos. [2]
Esta categoría no se divide en más categorías. Todas las entradas actuales incluyen:

Esta categoría (EC 5.3) incluye las oxidorreductasas intramoleculares . Estas isomerasas catalizan la transferencia de electrones de una parte de la molécula a otra. En otras palabras, catalizan la oxidación de una parte de la molécula y la reducción concurrente de otra parte. [8] Las subcategorías de esta clase son:
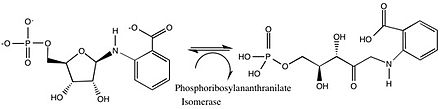
Esta categoría (EC 5.4) incluye transferasas intramoleculares ( mutasas ). Estas isomerasas catalizan la transferencia de grupos funcionales de una parte de una molécula a otra. [8] Las fosfotransferasas (EC 5.4.2) se categorizaron como transferasas (EC 2.7.5) con regeneración de donantes hasta 1983. [9] Esta subclase se puede dividir según el grupo funcional que transfiere la enzima:

Esta categoría (EC 5.5) incluye las liasas intramoleculares . Estas enzimas catalizan "reacciones en las que un grupo puede considerarse eliminado de una parte de una molécula, dejando un doble enlace, mientras permanece unido covalentemente a la molécula". [8] Algunas de estas reacciones catalizadas implican la ruptura de una estructura de anillo.
Esta categoría no se divide en más categorías. Todas las entradas actuales incluyen:


Un ejemplo clásico de apertura y contracción de anillo es la isomerización de la glucosa (un aldehído con un anillo de seis miembros) a fructosa (una cetona con un anillo de cinco miembros). La conversión de D-glucosa-6-fosfato a D-fructosa-6-fosfato es catalizada por la glucosa-6-fosfato isomerasa , una oxidorreductasa intramolecular . La reacción general implica la apertura del anillo para formar una aldosa mediante catálisis ácido/base y la posterior formación de un intermediario cis-endiol. Luego se forma una cetosa y el anillo se cierra nuevamente.
La glucosa-6-fosfato se une primero al sitio activo de la isomerasa. La isomerasa abre el anillo: su residuo His388 protona el oxígeno en el anillo de glucosa (y, por lo tanto, rompe el enlace O5-C1) junto con Lys518 que desprotona el oxígeno del hidroxilo C1. El anillo se abre para formar una aldosa de cadena lineal con un protón C2 ácido. El enlace C3-C4 rota y Glu357 (con la ayuda de His388) desprona C2 para formar un doble enlace entre C1 y C2. Se crea un intermediario cis-endiol y el oxígeno C1 es protonado por el residuo catalítico, acompañado por la desprotonación del oxígeno C2 del endiol. Se forma la cetosa de cadena lineal . Para cerrar el anillo de fructosa, ocurre lo inverso de la apertura del anillo y la cetosa es protonada. [10]

Un ejemplo de epimerización se encuentra en el ciclo de Calvin cuando la D-ribulosa-5-fosfato se convierte en D-xilulosa-5-fosfato por la ribulosa-fosfato 3-epimerasa . El sustrato y el producto difieren solo en la estereoquímica en el tercer carbono de la cadena. El mecanismo subyacente implica la desprotonación de ese tercer carbono para formar un intermediario enolato reactivo . El sitio activo de la enzima contiene dos residuos Asp . Después de que el sustrato se une a la enzima, el primer Asp desprotona el tercer carbono de un lado de la molécula. Esto deja un intermediario hibridado sp 2 planar . El segundo Asp se encuentra en el lado opuesto del lado activo y protona la molécula, agregando efectivamente un protón desde el lado posterior. Estos pasos acoplados invierten la estereoquímica en el tercer carbono. [11]

La corismato mutasa es una transferasa intramolecular y cataliza la conversión de corismato en prefenato , utilizado como precursor de la L-tirosina y la L-fenilalanina en algunas plantas y bacterias. Esta reacción es un reordenamiento de Claisen que puede realizarse con o sin la isomerasa, aunque la velocidad aumenta 10 6 veces en presencia de la corismato mutasa. La reacción pasa por un estado de transición de silla con el sustrato en una posición transdiaxial. [12] La evidencia experimental indica que la isomerasa se une selectivamente al estado de transición de silla, aunque no se conoce el mecanismo exacto de catálisis . Se cree que esta unión estabiliza el estado de transición a través de efectos electrostáticos, lo que explica el aumento dramático en la velocidad de reacción en presencia de la mutasa o tras la adición de un catión colocado específicamente en el sitio activo. [13]

La isopentenil-difosfato delta isomerasa tipo I (también conocida como IPP isomerasa) se observa en la síntesis de colesterol y, en particular, cataliza la conversión de isopentenil difosfato (IPP) a dimetilalil difosfato (DMAPP). En esta reacción de isomerización, un doble enlace carbono-carbono estable se reorganiza para crear un isómero alílico altamente electrofílico . La IPP isomerasa cataliza esta reacción mediante la transposición antarafacial estereoselectiva de un solo protón. El doble enlace se protona en C4 para formar un carbocatión terciario intermedio en C3. El carbono adyacente, C2, se desprotona de la cara opuesta para producir un doble enlace. [14] En efecto, el doble enlace se desplaza.
La isomerasa desempeña un papel en las enfermedades humanas. Las deficiencias de esta enzima pueden provocar trastornos en los seres humanos.
La deficiencia de fosfohexosa isomerasa (PHI) también se conoce como deficiencia de fosfoglucosa isomerasa o deficiencia de glucosa-6-fosfato isomerasa, y es una deficiencia enzimática hereditaria. La PHI es la segunda ertoenziopatía más frecuente en la glucólisis después de la deficiencia de piruvato quinasa , y se asocia con anemia hemolítica no esferocítica de gravedad variable. [15] [16] Esta enfermedad se centra en la proteína glucosa-6-fosfato. Esta proteína se puede encontrar en la secreción de algunas células cancerosas. [17] La PHI es el resultado de una enzima dimérica que cataliza la interconversión reversible de fructosa-6-fosfato y glucosa-6-fosfato. [15]
La PHI es una enfermedad muy rara, con sólo 50 casos reportados en la literatura hasta la fecha. [15]
El diagnóstico se realiza sobre la base del cuadro clínico asociado a estudios bioquímicos que revelan deficiencia de GPI eritrocitario (entre 7 y 60% de lo normal) e identificación de una mutación en el gen GPI mediante análisis molecular. [15]
La deficiencia de fosfohexosa isomerasa puede provocar una afección denominada síndrome hemolítico. Al igual que en los seres humanos, el síndrome hemolítico, que se caracteriza por una disminución del número de eritrocitos, un menor hematocrito, una menor hemoglobina , un mayor número de reticulocitos y una mayor concentración de bilirrubina plasmática, así como un aumento de los índices hepáticos y esplénicos, se manifestó exclusivamente en mutantes homocigotos. [16]
La enfermedad denominada deficiencia de triosafosfato isomerasa (TPI) es un trastorno multisistémico grave, hereditario, autosómico recesivo, del metabolismo glucolítico. [18] Se caracteriza por anemia hemolítica y neurodegeneración, y es causada por una disfunción metabólica anaeróbica. Esta disfunción es el resultado de una mutación sin sentido que afecta a la proteína TPI codificada. [19] La mutación más común es la sustitución del gen Glu104Asp, que produce el fenotipo más grave y es responsable de aproximadamente el 80% de la deficiencia clínica de TPI. [18]
La deficiencia de TPI es muy rara, con menos de 50 casos reportados en la literatura. [20] Al ser una enfermedad hereditaria autosómica recesiva, la deficiencia de TPI tiene un riesgo de recurrencia del 25% en el caso de padres heterocigotos. [18] [20] Es una enfermedad congénita que ocurre con mayor frecuencia con anemia hemolítica y se manifiesta con ictericia. [18] La mayoría de los pacientes con TPI para la mutación Glu104Asp o heterocigotos para un alelo nulo de TPI y Glu104Asp tienen una expectativa de vida de la infancia a la niñez temprana. Los pacientes con TPI con otras mutaciones generalmente muestran una expectativa de vida más larga. Solo hay dos casos de individuos con TPI que vivieron más de 6 años. Estos casos involucran a dos hermanos de Hungría, uno que no desarrolló síntomas neurológicos hasta la edad de 12 años, y el hermano mayor que no tiene síntomas neurológicos y solo sufre anemia. [21]
Los individuos con TPI muestran síntomas evidentes después de los 6 a 24 meses de edad. Estos síntomas incluyen: distonía, temblor, discinesia, signos del tracto piramidal, miocardiopatía y afectación de la neurona motora espinal. [18] Los pacientes también presentan infecciones bacterianas frecuentes del sistema respiratorio. [18]
La TPI se detecta a través de la deficiencia de la actividad enzimática y la acumulación de fosfato de dihidroxiacetona (DHAP), que es un sustrato tóxico, en los eritrocitos. [18] [20] Esto se puede detectar a través del examen físico y una serie de análisis de laboratorio. En la detección, generalmente se observan cambios miopáticos en los músculos y neuropatía axonal crónica en los nervios. [18] El diagnóstico de TPI se puede confirmar a través de la genética molecular. [18] El análisis del ADN de las vellosidades coriónicas o el análisis de los glóbulos rojos fetales se pueden utilizar para detectar TPI en el diagnóstico prenatal. [18]
El tratamiento de la TPI no es específico, sino que varía según los distintos casos. Debido a la variedad de síntomas que provoca la TPI, puede ser necesario un equipo de especialistas para brindar tratamiento a una sola persona. Ese equipo de especialistas estaría formado por pediatras, cardiólogos, neurólogos y otros profesionales de la salud, que pueden desarrollar un plan de acción integral. [22]
También se pueden tomar medidas de apoyo, como transfusiones de glóbulos rojos en casos de anemia grave, para tratar la TPI. En algunos casos, la extirpación del bazo (esplenectomía) puede mejorar la anemia. No existe ningún tratamiento para prevenir el deterioro neurológico progresivo o cualquier otra manifestación clínica no hematológica de las enfermedades. [23]
El uso más común de las isomerasas en aplicaciones industriales es en la fabricación de azúcar . La glucosa isomerasa (también conocida como xilosa isomerasa ) cataliza la conversión de D- xilosa y D- glucosa en D -xilulosa y D- fructosa . Como la mayoría de las isomerasas de azúcar, la glucosa isomerasa cataliza la interconversión de aldosas y cetosas . [24]
La conversión de glucosa en fructosa es un componente clave de la producción de jarabe de maíz con alto contenido de fructosa . La isomerización es más específica que los métodos químicos más antiguos de producción de fructosa, lo que da como resultado un mayor rendimiento de fructosa y ningún producto secundario . [24] La fructosa producida a partir de esta reacción de isomerización es más pura y no tiene sabores residuales de contaminantes . Muchos fabricantes de dulces y refrescos prefieren el jarabe de maíz con alto contenido de fructosa debido al alto poder edulcorante de la fructosa (el doble que la sacarosa [25] ), su costo relativamente bajo y su incapacidad para cristalizar. La fructosa también se usa como edulcorante para diabéticos . [24] Los principales problemas del uso de la glucosa isomerasa involucran su inactivación a temperaturas más altas y el requisito de un pH alto (entre 7,0 y 9,0) en el entorno de reacción. Las temperaturas moderadamente altas, superiores a 70 °C, aumentan el rendimiento de fructosa al menos a la mitad en el paso de isomerización. [26] La enzima requiere un catión divalente como Co2 + y Mg2 + para alcanzar su actividad máxima, lo que supone un coste adicional para los fabricantes. La glucosa isomerasa también tiene una afinidad mucho mayor por la xilosa que por la glucosa, lo que requiere un entorno cuidadosamente controlado. [24]
La isomerización de xilosa a xilulosa tiene sus propias aplicaciones comerciales a medida que aumenta el interés en los biocombustibles . Esta reacción se observa a menudo de forma natural en las bacterias que se alimentan de materia vegetal en descomposición. Su uso industrial más común es en la producción de etanol , logrado por la fermentación de xilulosa . El uso de hemicelulosa como material de origen es muy común. La hemicelulosa contiene xilano , que a su vez está compuesto de xilosa en enlaces β(1,4) . [27] El uso de la glucosa isomerasa convierte de forma muy eficiente la xilosa en xilulosa, que luego puede ser utilizada por la levadura fermentadora . En general, se ha invertido una amplia investigación en ingeniería genética para optimizar la glucosa isomerasa y facilitar su recuperación de aplicaciones industriales para su reutilización.
La glucosa isomerasa es capaz de catalizar la isomerización de una variedad de otros azúcares, incluyendo la D- ribosa , la D -alosa y la L- arabinosa . Los sustratos más eficientes son aquellos similares a la glucosa y la xilosa, que tienen grupos hidroxilo ecuatoriales en los carbonos tercero y cuarto. [28] El modelo actual para el mecanismo de la glucosa isomerasa es el de un desplazamiento de hidruro basado en estudios de cristalografía de rayos X y de intercambio de isótopos. [24]
Algunas isomerasas se asocian con membranas biológicas como proteínas de membrana periféricas o ancladas a través de una única hélice transmembrana , [29] por ejemplo las isomerasas con el dominio tiorredoxina y ciertas prolil isomerasas .