En química , los isómeros son moléculas o iones poliatómicos con fórmula molecular idéntica (es decir, el mismo número de átomos de cada elemento ) pero disposiciones distintas de los átomos en el espacio. [1] La isomería se refiere a la existencia o posibilidad de isómeros.
Los isómeros no necesariamente comparten propiedades químicas o físicas similares . Dos formas principales de isomería son la isomería estructural o constitucional, en la que los enlaces entre los átomos difieren; y estereoisomería o isomería espacial, en la que los enlaces son iguales pero las posiciones relativas de los átomos difieren.
Las relaciones isoméricas forman una jerarquía. Dos sustancias químicas pueden ser el mismo isómero constitucional, pero, tras un análisis más profundo, ser estereoisómeros entre sí. Dos moléculas que son el mismo estereoisómero entre sí pueden tener diferentes formas conformacionales o ser isotopólogos diferentes. La profundidad del análisis depende del campo de estudio o de las propiedades químicas y físicas de interés.
La palabra inglesa "isomer" ( / ˈ aɪ s əm ər / ) es una formación posterior de "isomeric", [2] que fue tomada del alemán isomerisch [3] del sueco isomerisk ; que a su vez fue acuñado del griego ἰσόμερoς isómeros , con raíces isos = "igual", méros = "parte". [4]

Los isómeros estructurales tienen el mismo número de átomos de cada elemento (de ahí la misma fórmula molecular ), pero los átomos están conectados de distintas maneras. [5]
Por ejemplo, hay tres compuestos distintos con la fórmula molecular :
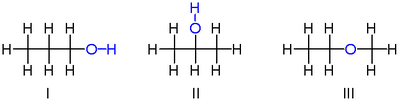
Los dos primeros isómeros mostrados son propanoles , es decir, alcoholes derivados del propano . Ambos tienen una cadena de tres átomos de carbono conectados por enlaces simples, mientras que las valencias de carbono restantes están llenas de siete átomos de hidrógeno y de un grupo hidroxilo que comprende el átomo de oxígeno unido a un átomo de hidrógeno. Estos dos isómeros difieren en qué carbono está unido el hidroxilo: ya sea a un extremo de la cadena de carbono propan-1-ol (1-propanol, alcohol n -propílico, n -propanol; I ) o al carbono medio propan-2 -ol (2-propanol, alcohol isopropílico, isopropanol; II ). Estos pueden describirse mediante fórmulas estructurales condensadas y .
El tercer isómero es el éter metoxietano (etil-metil-éter; III ). A diferencia de los otros dos, tiene el átomo de oxígeno conectado a dos carbonos y los ocho hidrógenos unidos directamente a los carbonos. Puede describirse mediante la fórmula condensada .
El alcohol “3-propanol” no es un isómero más, ya que la diferencia entre este y el 1-propanol no es real; es sólo el resultado de una elección arbitraria en la dirección de numerar los carbonos a lo largo de la cadena. Por la misma razón, el "etoximetano" es la misma molécula que el metoxietano, no otro isómero.
El 1-propanol y el 2-propanol son ejemplos de isómeros posicionales , que se diferencian por la posición en la que se producen ciertas características, como dobles enlaces o grupos funcionales , en una molécula "principal" (propano, en ese caso).
También existen tres isómeros estructurales del hidrocarburo :
En dos de los isómeros, los tres átomos de carbono están conectados en una cadena abierta, pero en uno de ellos ( propadieno o aleno; I ) los carbonos están conectados por dos dobles enlaces , mientras que en el otro ( propino o metilacetileno; II ) están unidos por un enlace simple y un enlace triple . En el tercer isómero ( ciclopropeno ; III ), los tres carbonos están conectados formando un anillo mediante dos enlaces simples y un doble enlace. En los tres, las valencias restantes de los átomos de carbono quedan satisfechas por los cuatro hidrógenos.
Nuevamente, observe que solo hay un isómero estructural con un triple enlace, porque la otra ubicación posible de ese enlace es simplemente dibujar los tres carbonos en un orden diferente. Por la misma razón, sólo hay un ciclopropeno, no tres.
Los tautómeros son isómeros estructurales que se interconvierten fácilmente, de modo que dos o más especies coexisten en equilibrio, como por ejemplo
. [6]
Ejemplos importantes son la tautomería ceto-enólica y el equilibrio entre las formas neutra y zwitteriónica de un aminoácido .
La estructura de algunas moléculas se describe a veces como una resonancia entre varios isómeros estructurales aparentemente diferentes. El ejemplo clásico es el 1,2-dimetilbenceno ( o -xileno), que a menudo se describe como una mezcla de dos isómeros estructurales aparentemente distintos:
Sin embargo, ninguna de estas dos estructuras describe un compuesto real; son ficciones ideadas como una forma de describir (por su "promediado" o "resonancia") el enlace deslocalizado real del o -xileno, que es el isómero único con un núcleo de benceno y dos grupos metilo en posiciones adyacentes.
Los estereoisómeros tienen los mismos átomos o isótopos conectados por enlaces del mismo tipo, pero difieren en sus formas (las posiciones relativas de esos átomos en el espacio), aparte de las rotaciones y traslaciones .
En teoría, uno puede imaginar que cualquier disposición en el espacio de los átomos de una molécula o ion cambie gradualmente a cualquier otra disposición de infinitas maneras, moviendo cada átomo a lo largo de una trayectoria apropiada. Sin embargo, los cambios en las posiciones de los átomos generalmente cambiarán la energía interna de una molécula, que está determinada por los ángulos entre los enlaces de cada átomo y por las distancias entre los átomos (estén unidos o no).
Un isómero conformacional es una disposición de los átomos de la molécula o ion para la cual la energía interna es un mínimo local ; es decir, una disposición tal que cualquier pequeño cambio en las posiciones de los átomos aumentará la energía interna y, por tanto, dará como resultado fuerzas que tienden a empujar a los átomos de regreso a sus posiciones originales. Por lo tanto, cambiar la forma de la molécula de un mínimo de energía a otro mínimo de energía requerirá pasar por configuraciones que tengan mayor energía que y . Es decir, un isómero de conformación está separado de cualquier otro isómero por una barrera energética : la cantidad que se debe agregar temporalmente a la energía interna de la molécula para poder recorrer todas las conformaciones intermedias a lo largo del camino "más fácil" (el que minimiza esa cantidad).

Un ejemplo clásico de isomería conformacional es el ciclohexano . Los alcanos generalmente tienen energía mínima cuando los ángulos son cercanos a 110 grados. Las conformaciones de la molécula de ciclohexano con los seis átomos de carbono en el mismo plano tienen una energía mayor, porque algunos o todos los ángulos deben estar lejos de ese valor (120 grados para un hexágono regular). Así, las conformaciones que son mínimos de energía locales tienen el anillo torcido en el espacio, según uno de dos patrones conocidos como silla (con los carbonos alternativamente encima y debajo de su plano medio) y barco (con dos carbonos opuestos encima del plano, y el otro). cuatro debajo).
Si la barrera de energía entre dos isómeros conformacionales es lo suficientemente baja, puede ser superada por las entradas aleatorias de energía térmica que la molécula obtiene de las interacciones con el medio ambiente o de sus propias vibraciones . En ese caso, los dos isómeros también pueden considerarse un solo isómero, dependiendo de la temperatura y el contexto. Por ejemplo, las dos conformaciones del ciclohexano se convierten entre sí con bastante rapidez a temperatura ambiente (en estado líquido), por lo que normalmente se tratan como un solo isómero en química. [7]
En algunos casos, la barrera puede cruzarse mediante un túnel cuántico de los propios átomos. Este último fenómeno impide la separación de los estereoisómeros de la fluorocloroamina o del peróxido de hidrógeno , porque las dos conformaciones con mínima energía se interconvierten en unos pocos picosegundos incluso a temperaturas muy bajas. [8]
Por el contrario, la barrera energética puede ser tan alta que la forma más fácil de superarla requeriría romper temporalmente y luego reformar uno o más enlaces de la molécula. En ese caso, los dos isómeros suelen ser lo suficientemente estables como para aislarlos y tratarlos como sustancias distintas. Se dice entonces que estos isómeros son isómeros configuracionales diferentes o "configuraciones" de la molécula, no sólo dos conformaciones diferentes. [9] (Sin embargo, uno debe tener en cuenta que los términos "conformación" y "configuración" son en gran medida sinónimos fuera de la química, y su distinción puede ser controvertida incluso entre los químicos. [7] )
Las interacciones con otras moléculas de compuestos iguales o diferentes (por ejemplo, a través de enlaces de hidrógeno ) pueden cambiar significativamente la energía de conformaciones de una molécula. Por tanto, los posibles isómeros de un compuesto en solución o en sus fases líquida y sólida muchos serán muy diferentes a los de una molécula aislada en el vacío. Incluso en la fase gaseosa, algunos compuestos como el ácido acético existirán principalmente en forma de dímeros o grupos más grandes de moléculas, cuyas configuraciones pueden ser diferentes a las de la molécula aislada.
Se dice que dos compuestos son enantiómeros si sus moléculas son imágenes especulares entre sí, que no pueden coincidir sólo mediante rotaciones o traslaciones, como una mano izquierda y una mano derecha. Se dice que las dos formas son quirales .
Un ejemplo clásico es el bromoclorofluorometano ( ). Los dos enantiómeros se pueden distinguir, por ejemplo, según si el camino gira en el sentido de las agujas del reloj o en el sentido contrario a las agujas del reloj, visto desde el átomo de hidrógeno. Para cambiar una conformación a otra, en algún momento esos cuatro átomos tendrían que estar en el mismo plano, lo que requeriría forzar o romper severamente sus enlaces con el átomo de carbono. La barrera energética correspondiente entre las dos conformaciones es tan alta que prácticamente no hay conversión entre ellas a temperatura ambiente, y pueden considerarse configuraciones diferentes.
El compuesto clorofluorometano , por el contrario, no es quiral: la imagen especular de su molécula también se obtiene dando media vuelta alrededor de un eje adecuado.
Otro ejemplo de compuesto quiral es el 2,3-pentadieno , un hidrocarburo que contiene dos dobles enlaces superpuestos. Los dobles enlaces son tales que los tres carbonos del medio están en línea recta, mientras que los tres primeros y los tres últimos se encuentran en planos perpendiculares. La molécula y su imagen especular no son superponibles, aunque la molécula tenga un eje de simetría. Los dos enantiómeros se pueden distinguir, por ejemplo, mediante la regla de la mano derecha . Este tipo de isomería se llama isomería axial.
Los enantiómeros se comportan de manera idéntica en reacciones químicas, excepto cuando reaccionan con compuestos quirales o en presencia de catalizadores quirales , como la mayoría de las enzimas . Por esta última razón, los dos enantiómeros de la mayoría de los compuestos quirales suelen tener efectos y funciones marcadamente diferentes en los organismos vivos. En bioquímica y ciencia de los alimentos , los dos enantiómeros de una molécula quiral (como la glucosa ) suelen identificarse y tratarse como sustancias muy diferentes.
Cada enantiómero de un compuesto quiral normalmente hace girar el plano de luz polarizada que lo atraviesa. La rotación tiene la misma magnitud pero sentidos opuestos para los dos isómeros y puede ser una forma útil de distinguir y medir su concentración en una solución. Por este motivo, antiguamente los enantiómeros se denominaban "isómeros ópticos". [10] [11] Sin embargo, este término es ambiguo y la IUPAC lo desaconseja . [12] [13]
Los estereoisómeros que no son enantiómeros se denominan diastereómeros . Algunos diastereómeros pueden contener un centro quiral , otros no. [14]
Algunos pares de enantiómeros (como los del transcicloocteno ) pueden interconvertirse mediante movimientos internos que cambian las longitudes y los ángulos de los enlaces sólo ligeramente . Otros pares (como el CHFClBr) no pueden interconvertirse sin romper los enlaces y, por lo tanto, tienen configuraciones diferentes.
Un doble enlace entre dos átomos de carbono obliga a los cuatro enlaces restantes (si son simples) a estar en el mismo plano, perpendicular al plano del enlace definido por su orbital π . Si los dos enlaces de cada carbono se conectan a átomos diferentes, son posibles dos conformaciones distintas, que se diferencian entre sí por un giro de 180 grados de uno de los carbonos alrededor del doble enlace.
El ejemplo clásico es el dicloroeteno , específicamente el isómero estructural que tiene un cloro unido a cada carbono. Tiene dos isómeros conformacionales, con los dos cloros en el mismo lado o en lados opuestos del plano del doble enlace. Se les llama tradicionalmente cis (del latín que significa "de este lado de") y trans ("del otro lado de"), respectivamente; o Z y E en la nomenclatura recomendada por la IUPAC . La conversión entre estas dos formas generalmente requiere romper enlaces temporalmente (o convertir el doble enlace en un enlace simple), por lo que las dos se consideran configuraciones diferentes de la molécula.
De manera más general, la isomería cis - trans (anteriormente llamada "isomería geométrica") ocurre en moléculas donde la orientación relativa de dos grupos funcionales distinguibles está restringida por una estructura algo rígida de otros átomos. [15]
Por ejemplo, en el alcohol cíclico inositol (un alcohol seis veces mayor que el ciclohexano), la cadena principal cíclica de seis carbonos evita en gran medida que el hidroxilo y el hidrógeno de cada carbono cambien de lugar. Por lo tanto, uno tiene diferentes isómeros configuracionales dependiendo de si cada hidroxilo está en "este lado" o "en el otro lado" del plano medio del anillo. Descontando los isómeros que son equivalentes bajo rotaciones, hay nueve isómeros que difieren según este criterio y se comportan como sustancias estables diferentes (dos de ellos son enantiómeros entre sí). El más común en la naturaleza ( mio -inositol) tiene los hidroxilos en los carbonos 1, 2, 3 y 5 del mismo lado de ese plano, por lo que puede denominarse cis -1,2,3,5- trans -4, 6-ciclohexanohexol. Y cada uno de estos isómeros cis - trans posiblemente pueda tener conformaciones estables de "silla" o "barco" (aunque las barreras entre ellos son significativamente más bajas que las que existen entre diferentes isómeros cis - trans ).

Los isómeros cis y trans también se encuentran en compuestos de coordinación inorgánicos , como complejos planos cuadrados ycomplejos octaédricos .
Para moléculas orgánicas más complejas, las etiquetas cis y trans son ambiguas. La IUPAC recomienda un esquema de etiquetado más preciso, basado en las prioridades del CIP para los enlaces en cada átomo de carbono. [16] [14]
De manera más general, los átomos o grupos de átomos que pueden formar tres o más enlaces simples no equivalentes (como los metales de transición en los compuestos de coordinación) pueden dar lugar a múltiples estereoisómeros cuando se unen diferentes átomos o grupos en esas posiciones. Lo mismo ocurre si un centro con seis o más enlaces equivalentes tiene dos o más sustituyentes.
Por ejemplo, en el compuesto , los enlaces del átomo de fósforo a los cinco halógenos tienen una geometría bipiramidal aproximadamente trigonal . Así, son posibles dos estereoisómeros con esa fórmula, dependiendo de si el átomo de cloro ocupa una de las dos posiciones "axiales" o una de las tres posiciones "ecuatoriales".
Para el compuesto , son posibles tres isómeros, con cero, uno o dos cloros en las posiciones axiales.
Como otro ejemplo, un complejo con una fórmula como , donde el átomo central M forma seis enlaces con geometría octaédrica , tiene al menos dos isómeros meridionales faciales , dependiendo de si los tres enlaces (y por tanto también los tres enlaces) están dirigidos al tres esquinas de una cara del octaedro ( isómero fac ), o se encuentran en el mismo plano ecuatorial o "meridiano" del mismo ( isómero mer ).
Dos partes de una molécula que están conectadas por un solo enlace pueden girar alrededor de ese enlace. Si bien el enlace en sí es indiferente a esa rotación, las atracciones y repulsiones entre los átomos de las dos partes normalmente hacen que la energía de toda la molécula varíe (y posiblemente también que las dos partes se deformen) dependiendo del ángulo relativo de rotación φ entre las dos partes. dos partes. Entonces habrá uno o más valores especiales de φ para los cuales la energía estará en un mínimo local. Las conformaciones correspondientes de la molécula se denominan isómeros rotacionales o rotámeros .
Así, por ejemplo, en una molécula de etano , todos los ángulos y longitudes de enlace están estrechamente restringidos, excepto que los dos grupos metilo pueden girar independientemente alrededor del eje. Por lo tanto, incluso si esos ángulos y distancias se suponen fijos, hay infinitas conformaciones para la molécula de etano, que difieren por el ángulo relativo φ de rotación entre los dos grupos. La débil repulsión entre los átomos de hidrógeno en los dos grupos metilo hace que la energía se minimice para tres valores específicos de φ, separados por 120°. En esas configuraciones, los seis planos están separados por 60°. Descontando las rotaciones de toda la molécula, esa configuración es un solo isómero: la llamada conformación escalonada .
La rotación entre las dos mitades de la molécula 1,2-dicloroetano ( también tiene tres mínimos de energía locales, pero tienen diferentes energías debido a las diferencias entre las interacciones , , y . Por lo tanto, hay tres rotámeros: un isómero trans donde los dos cloros están en el mismo plano que los dos carbonos, pero con enlaces en direcciones opuestas; y dos isómeros gauche , imágenes especulares entre sí, donde los dos grupos giran aproximadamente 109° desde esa posición. La diferencia de energía calculada entre trans y gauche es ~1,5 kcal/mol, la barrera para la rotación de ~109° de trans a gauche es ~5 kcal/mol, y la de la rotación de ~142° de un gauche a su enantiómero es ~ 8 kcal/mol. El butano es similar, pero con energías y barreras ligeramente más bajas [17] .
Si las dos partes de la molécula conectadas por un enlace simple son voluminosas o están cargadas, las barreras energéticas pueden ser mucho mayores. Por ejemplo, en el compuesto bifenilo (dos grupos fenilo conectados por un enlace sencillo), la repulsión entre los átomos de hidrógeno más cercanos al enlace sencillo central da a la conformación totalmente plana, con los dos anillos en el mismo plano, una energía mayor que las conformaciones en las que los dos anillos están en el mismo plano. dos anillos están torcidos. Por lo tanto, en la fase gaseosa, la molécula tiene al menos dos rotámeros, con los planos de los anillos girados ±47°, que son imágenes especulares entre sí. La barrera entre ellos es bastante baja (~8 kJ /mol). [18] Este efecto de impedimento estérico es más pronunciado cuando esos cuatro hidrógenos son reemplazados por átomos o grupos más grandes, como cloros o carboxilos . Si la barrera es lo suficientemente alta como para que los dos rotámeros se separen como compuestos estables a temperatura ambiente, se denominan atropisómeros .
Las moléculas grandes pueden tener isómeros que difieren por la topología de su disposición general en el espacio, incluso si no existe una restricción geométrica específica que las separe. Por ejemplo, las cadenas largas pueden torcerse para formar nudos topológicamente distintos , impidiendo la interconversión mediante sustituyentes voluminosos o el cierre del ciclo (como en los plásmidos circulares de ADN y ARN ). Algunos nudos pueden presentarse en pares de enantiómeros de imagen especular. Estas formas se denominan isómeros topológicos o topoisómeros .
Además, dos o más de estas moléculas pueden estar unidas en un catenano mediante tales enlaces topológicos, incluso si no existe ningún enlace químico entre ellas. Si las moléculas son lo suficientemente grandes, el enlace puede ocurrir de múltiples maneras topológicamente distintas, constituyendo diferentes isómeros. Compuestos de jaula , como el helio encerrado en dodecaedrano (He @ C
20h
20) y los peapods de carbono , son un tipo similar de isomería topológica que involucra moléculas con grandes vacíos internos con aberturas restringidas o nulas. [19]
Diferentes isótopos del mismo elemento pueden considerarse diferentes tipos de átomos al enumerar isómeros de una molécula o ion. La sustitución de uno o más átomos por sus isótopos puede crear múltiples isómeros estructurales y/o estereoisómeros a partir de un solo isómero.
Por ejemplo, reemplazar dos átomos de hidrógeno común ( ) por deuterio ( , o ) en una molécula de etano produce dos isómeros estructurales distintos, dependiendo de si las sustituciones son ambas en el mismo carbono (1,1-dideuteroetano, ) o una en cada carbono (1,2-dideuteroetano, ); como si el sustituyente fuera cloro en lugar de deuterio. Las dos moléculas no se interconvierten fácilmente y tienen propiedades diferentes, como su espectro de microondas . [20]
Otro ejemplo sería sustituir un átomo de deuterio por uno de los hidrógenos del clorofluorometano ( ). Si bien la molécula original no es quiral y tiene un solo isómero, la sustitución crea un par de enantiómeros quirales de , que podrían distinguirse (al menos en teoría) por su actividad óptica. [21]
Cuando dos isómeros serían idénticos si todos los isótopos de cada elemento fueran reemplazados por un solo isótopo, se describen como isotopómeros o isómeros isotópicos. [22] En los dos ejemplos anteriores, si todos fueran reemplazados por , los dos dideuteroetanos se convertirían en etano y los dos deuteroclorofluorometanos se convertirían en .
El concepto de isotopómeros se diferencia del de isotopólogos u homólogos isotópicos, que se diferencian en su composición isotópica. [22] Por ejemplo, y son isotopólogos y no isotopómeros y, por lo tanto, no son isómeros entre sí.
Otro tipo de isomería basada en propiedades nucleares es la isomería de espín , donde las moléculas difieren sólo en los números cuánticos magnéticos de espín relativo m s de los núcleos atómicos constituyentes. Este fenómeno es significativo para el hidrógeno molecular, que puede separarse parcialmente en dos estados de larga duración descritos como isómeros de espín [23] o isómeros de espín nuclear: [24] parahidrógeno, con los espines de los dos núcleos apuntando en direcciones opuestas, y ortohidrógeno. , donde los giros apuntan en la misma dirección.
La isomerización es el proceso mediante el cual una molécula se transforma en otra molécula que tiene exactamente los mismos átomos, pero los átomos se reordenan. [25] En algunas moléculas y bajo algunas condiciones, la isomerización ocurre espontáneamente. Muchos isómeros son iguales o aproximadamente iguales en energía de enlace y, por lo tanto, existen en cantidades aproximadamente iguales, siempre que puedan interconvertirse con relativa libertad, es decir, la barrera energética entre los dos isómeros no sea demasiado alta. Cuando la isomerización ocurre intramolecularmente , se considera una reacción de reordenamiento .
Un ejemplo de isomerización organometálica es la producción de decafenilferroceno, [(η 5 -C 5 Ph 5 ) 2 Fe] a partir de su isómero de enlace . [26] [27]
La síntesis industrial del ácido fumárico se realiza mediante la isomerización cis-trans del ácido maleico :
Las topoisomerasas son enzimas que pueden cortar y reformar el ADN circular y así cambiar su topología.
Son comunes los isómeros que tienen propiedades biológicas distintas; por ejemplo, la colocación de grupos metilo . En las xantinas sustituidas , la teobromina , que se encuentra en el chocolate, es un vasodilatador con algunos efectos en común con la cafeína ; pero, si uno de los dos grupos metilo se mueve a una posición diferente en el núcleo de dos anillos, el isómero es teofilina , que tiene una variedad de efectos, incluida la broncodilatación y la acción antiinflamatoria . Otro ejemplo de esto ocurre con los fármacos estimulantes a base de fenetilamina . La fentermina es un compuesto no quiral con un efecto más débil que el de la anfetamina . Se utiliza como medicamento para reducir el apetito y tiene propiedades estimulantes leves o nulas. Sin embargo, una disposición atómica alternativa da la dextrometanfetamina , que es un estimulante más fuerte que la anfetamina.
En química y bioquímica medicinales, los enantiómeros son una preocupación especial porque pueden poseer una actividad biológica distinta . Muchos procedimientos preparativos proporcionan una mezcla de cantidades iguales de ambas formas enantioméricas. En algunos casos, los enantiómeros se separan mediante cromatografía utilizando fases estacionarias quirales. También pueden separarse mediante la formación de sales diastereoméricas . En otros casos se ha desarrollado la síntesis enantioselectiva .
Como ejemplo inorgánico, el cisplatino (ver estructura arriba) es un fármaco importante utilizado en la quimioterapia contra el cáncer, mientras que el isómero trans (transplatino) no tiene actividad farmacológica útil.
La isomería se observó por primera vez en 1827, cuando Friedrich Wöhler preparó cianato de plata y descubrió que, aunque su composición elemental era idéntica a la del fulminato de plata (preparado por Justus von Liebig el año anterior), [28] sus propiedades eran distintas. Este hallazgo desafió la comprensión química predominante en la época, que sostenía que los compuestos químicos podían ser distintos sólo cuando sus composiciones elementales difieren. (Ahora sabemos que las estructuras de enlace del fulminato y el cianato se pueden describir aproximadamente como ≡ y , respectivamente).
En los años siguientes se encontraron ejemplos adicionales, como el descubrimiento de Wöhler en 1828 de que la urea tiene la misma composición atómica ( ) que el cianato de amonio químicamente distinto . (Ahora se sabe que sus estructuras son y , respectivamente). En 1830, Jöns Jacob Berzelius introdujo el término isomería para describir el fenómeno. [4] [29] [30] [31]
En 1848, Louis Pasteur observó que los cristales de ácido tartárico tenían dos tipos de formas que eran imágenes especulares entre sí. Separando los cristales a mano, obtuvo dos versiones de ácido tartárico, cada una de las cuales cristalizaría en sólo una de las dos formas, y giró el plano de luz polarizada en el mismo grado pero en direcciones opuestas. [32] [33] En 1860, Pasteur planteó explícitamente la hipótesis de que las moléculas de los isómeros podrían tener la misma composición pero diferentes disposiciones de sus átomos. [34]