
El enlace iónico es un tipo de enlace químico que implica la atracción electrostática entre iones con cargas opuestas , o entre dos átomos con electronegatividades muy diferentes , [1] y es la interacción primaria que ocurre en los compuestos iónicos . Es uno de los principales tipos de enlace, junto con el enlace covalente y el enlace metálico . Los iones son átomos (o grupos de átomos) con una carga electrostática. Los átomos que ganan electrones forman iones con carga negativa (llamados aniones ). Los átomos que pierden electrones forman iones con carga positiva (llamados cationes ). Esta transferencia de electrones se conoce como electrovalencia en contraste con la covalencia . En el caso más simple, el catión es un átomo de metal y el anión es un átomo de no metal , pero estos iones pueden ser más complejos, por ejemplo, iones moleculares como NH+
4o asi2−
4En palabras más simples, un enlace iónico resulta de la transferencia de electrones de un metal a un no metal para obtener una capa de valencia completa para ambos átomos.
No puede existir un enlace iónico puro , en el que un átomo o molécula transfiere completamente un electrón a otro: todos los compuestos iónicos tienen algún grado de enlace covalente o intercambio de electrones. Por lo tanto, el término "enlace iónico" se da cuando el carácter iónico es mayor que el carácter covalente, es decir, un enlace en el que hay una gran diferencia de electronegatividad entre los dos átomos, lo que hace que el enlace sea más polar (iónico) que en el enlace covalente donde los electrones se comparten de manera más equitativa. Los enlaces con caracteres parcialmente iónicos y parcialmente covalentes se denominan enlaces covalentes polares . [2]
Los compuestos iónicos conducen electricidad cuando están fundidos o en solución, normalmente no cuando están sólidos. Los compuestos iónicos generalmente tienen un punto de fusión alto , dependiendo de la carga de los iones que los componen. Cuanto más altas sean las cargas, más fuertes serán las fuerzas de cohesión y más alto será el punto de fusión. También tienden a ser solubles en agua; cuanto más fuertes sean las fuerzas de cohesión, menor será la solubilidad. [3]
Los átomos que tienen una capa de valencia casi llena o casi vacía tienden a ser muy reactivos . Los átomos fuertemente electronegativos (como los halógenos ) a menudo tienen solo uno o dos estados electrónicos vacíos en su capa de valencia , y con frecuencia se unen con otros átomos o ganan electrones para formar aniones . Los átomos débilmente electronegativos (como los metales alcalinos ) tienen relativamente pocos electrones de valencia , que pueden perderse fácilmente en átomos fuertemente electronegativos. Como resultado, los átomos débilmente electronegativos tienden a distorsionar su nube de electrones y formar cationes .
El enlace iónico puede resultar de una reacción redox cuando los átomos de un elemento (generalmente metal ), cuya energía de ionización es baja, ceden algunos de sus electrones para lograr una configuración electrónica estable. Al hacerlo, se forman cationes. Un átomo de otro elemento (generalmente no metal) con mayor afinidad electrónica acepta uno o más electrones para alcanzar una configuración electrónica estable , y después de aceptar electrones, un átomo se convierte en un anión. Típicamente, la configuración electrónica estable es uno de los gases nobles para los elementos del bloque s y el bloque p , y configuraciones electrónicas estables particulares para los elementos del bloque d y el bloque f . La atracción electrostática entre los aniones y los cationes conduce a la formación de un sólido con una red cristalográfica en la que los iones se apilan de manera alternada. En una red de este tipo, generalmente no es posible distinguir unidades moleculares discretas, de modo que los compuestos formados no son moleculares. Sin embargo, los iones en sí mismos pueden ser complejos y formar iones moleculares como el anión acetato o el catión amonio.

Por ejemplo, la sal de mesa común es cloruro de sodio . Cuando se combinan el sodio (Na) y el cloro (Cl), los átomos de sodio pierden un electrón cada uno , formando cationes (Na + ), y los átomos de cloro ganan un electrón cada uno para formar aniones (Cl− ) . Estos iones se atraen entre sí en una proporción de 1:1 para formar cloruro de sodio (NaCl).
Sin embargo, para mantener la neutralidad de carga, se observan proporciones estrictas entre aniones y cationes de modo que los compuestos iónicos, en general, obedezcan las reglas de la estequiometría a pesar de no ser compuestos moleculares. Para los compuestos que son de transición a las aleaciones y poseen enlaces iónicos y metálicos mixtos, esto puede no ser así en la actualidad. Muchos sulfuros, por ejemplo, forman compuestos no estequiométricos.
Muchos compuestos iónicos se denominan sales , ya que también pueden formarse mediante la reacción de neutralización de una base de Arrhenius como NaOH con un ácido de Arrhenius como HCl.
Se dice entonces que la sal NaCl está formada por el resto ácido Cl − y el resto base Na + .
La eliminación de electrones para formar el catión es endotérmica, lo que aumenta la energía total del sistema. También puede haber cambios de energía asociados con la ruptura de enlaces existentes o la adición de más de un electrón para formar aniones. Sin embargo, la acción del anión de aceptar los electrones de valencia del catión y la posterior atracción de los iones entre sí libera energía (en red) y, por lo tanto, reduce la energía total del sistema.
El enlace iónico se producirá solo si el cambio de energía general para la reacción es favorable. En general, la reacción es exotérmica, pero, por ejemplo, la formación de óxido de mercurio (HgO) es endotérmica. La carga de los iones resultantes es un factor importante en la fuerza del enlace iónico, por ejemplo, una sal C + A − se mantiene unida por fuerzas electrostáticas aproximadamente cuatro veces más débiles que C 2+ A 2− según la ley de Coulomb , donde C y A representan un catión y un anión genéricos respectivamente. Los tamaños de los iones y el empaquetamiento particular de la red se ignoran en este argumento bastante simplista.
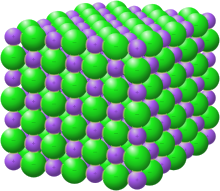
Los compuestos iónicos en estado sólido forman estructuras reticulares. Los dos factores principales que determinan la forma de la red son las cargas relativas de los iones y sus tamaños relativos. Algunas estructuras son adoptadas por varios compuestos; por ejemplo, la estructura de la sal de roca cloruro de sodio también es adoptada por muchos haluros alcalinos y óxidos binarios como el óxido de magnesio . Las reglas de Pauling proporcionan pautas para predecir y racionalizar las estructuras cristalinas de los cristales iónicos.
Para un compuesto iónico cristalino sólido, el cambio de entalpía en la formación del sólido a partir de iones gaseosos se denomina energía reticular . El valor experimental de la energía reticular se puede determinar utilizando el ciclo de Born-Haber . También se puede calcular (predecir) utilizando la ecuación de Born-Landé como la suma de la energía potencial electrostática , calculada sumando las interacciones entre cationes y aniones, y un término de energía potencial repulsiva de corto alcance. El potencial electrostático se puede expresar en términos de la separación interiónica y una constante ( constante de Madelung ) que tiene en cuenta la geometría del cristal. Cuanto más lejos del núcleo, más débil es el escudo. La ecuación de Born-Landé proporciona un ajuste razonable a la energía reticular de, por ejemplo, el cloruro de sodio, donde el valor calculado (predicho) es −756 kJ/mol, que se compara con −787 kJ/mol utilizando el ciclo de Born-Haber . [4] [5] En solución acuosa, la fuerza de enlace se puede describir mediante la ecuación de Bjerrum o Fuoss como función de las cargas iónicas, bastante independiente de la naturaleza de los iones, como la polarizabilidad o el tamaño. [6] La fuerza de los puentes salinos se evalúa con mayor frecuencia mediante mediciones de equilibrios entre moléculas que contienen sitios catiónicos y aniónicos, con mayor frecuencia en solución. [7] Las constantes de equilibrio en agua indican contribuciones de energía libre aditivas para cada puente salino. Otro método para la identificación de enlaces de hidrógeno también en moléculas complicadas es la cristalografía , a veces también la espectroscopia de RMN.
Las fuerzas de atracción que definen la fuerza del enlace iónico se pueden modelar mediante la Ley de Coulomb . Las fuerzas de enlace iónico suelen estar (los rangos citados varían) entre 170 y 1500 kJ/mol. [8] [9]
Los iones en las redes cristalinas de compuestos puramente iónicos son esféricos ; sin embargo, si el ion positivo es pequeño y/o está muy cargado, distorsionará la nube de electrones del ion negativo, un efecto resumido en las reglas de Fajans . Esta polarización del ion negativo conduce a una acumulación de densidad de carga adicional entre los dos núcleos , es decir, a una covalencia parcial. Los iones negativos más grandes se polarizan más fácilmente, pero el efecto suele ser importante solo cuando están involucrados iones positivos con cargas de 3+ (p. ej., Al 3+ ). Sin embargo, los iones 2+ (Be 2+ ) o incluso 1+ (Li + ) muestran cierto poder polarizador porque sus tamaños son muy pequeños (p. ej., LiI es iónico pero tiene algún enlace covalente presente). Nótese que este no es el efecto de polarización iónica que se refiere al desplazamiento de iones en la red debido a la aplicación de un campo eléctrico.
En el enlace iónico, los átomos están unidos por la atracción de iones de carga opuesta, mientras que, en el enlace covalente , los átomos están unidos compartiendo electrones para alcanzar configuraciones electrónicas estables. En el enlace covalente, la geometría molecular alrededor de cada átomo está determinada por las reglas VSEPR de repulsión de pares de electrones de la capa de valencia , mientras que, en los materiales iónicos, la geometría sigue las reglas de empaquetamiento máximo . Se podría decir que el enlace covalente es más direccional en el sentido de que la penalización energética por no adherirse a los ángulos de enlace óptimos es grande, mientras que el enlace iónico no tiene tal penalización. No hay pares de electrones compartidos que se repelan entre sí, los iones simplemente deben empaquetarse lo más eficientemente posible. Esto a menudo conduce a números de coordinación mucho más altos . En NaCl, cada ion tiene 6 enlaces y todos los ángulos de enlace son de 90°. En CsCl, el número de coordinación es 8. En comparación, el carbono normalmente tiene un máximo de cuatro enlaces.
No puede existir un enlace puramente iónico, ya que la proximidad de las entidades involucradas en el enlace permite cierto grado de compartir la densidad electrónica entre ellas. Por lo tanto, todo enlace iónico tiene algún carácter covalente. Así, el enlace se considera iónico cuando el carácter iónico es mayor que el carácter covalente. Cuanto mayor sea la diferencia de electronegatividad entre los dos tipos de átomos involucrados en el enlace, más iónico (polar) es. Los enlaces con carácter parcialmente iónico y parcialmente covalente se denominan enlaces covalentes polares . Por ejemplo, las interacciones Na–Cl y Mg–O tienen un pequeño porcentaje de covalencia, mientras que los enlaces Si–O suelen ser ~50% iónicos y ~50% covalentes. Pauling estimó que una diferencia de electronegatividad de 1,7 (en la escala de Pauling ) corresponde a un 50% de carácter iónico, de modo que una diferencia mayor de 1,7 corresponde a un enlace que es predominantemente iónico. [10]
El carácter iónico de los enlaces covalentes se puede medir directamente en átomos que tienen núcleos cuadrupolares ( 2 H, 14 N, 81,79 Br, 35,37 Cl o 127 I). Estos núcleos son generalmente objeto de estudios de resonancia magnética nuclear NQR y RMN . Las interacciones entre los momentos cuadrupolares nucleares Q y los gradientes de campo eléctrico (EFG) se caracterizan a través de las constantes de acoplamiento cuadrupolar nuclear.
donde el término eq zz corresponde al componente principal del tensor EFG y e es la carga elemental. A su vez, el gradiente de campo eléctrico abre el camino a la descripción de los modos de enlace en las moléculas cuando los valores de QCC se determinan con precisión mediante métodos de RMN o NQR.
En general, cuando el enlace iónico se produce en estado sólido (o líquido), no es posible hablar de un único "enlace iónico" entre dos átomos individuales, porque las fuerzas de cohesión que mantienen unida la red son de naturaleza más colectiva. Esto es bastante diferente en el caso del enlace covalente, donde a menudo podemos hablar de un enlace distinto localizado entre dos átomos particulares. Sin embargo, incluso si el enlace iónico se combina con algo de covalencia, el resultado no son necesariamente enlaces discretos de carácter localizado. [2] En tales casos, el enlace resultante a menudo requiere una descripción en términos de una estructura de banda que consiste en orbitales moleculares gigantescos que abarcan todo el cristal. Por lo tanto, el enlace en el sólido a menudo conserva su naturaleza colectiva en lugar de localizada. Cuando la diferencia de electronegatividad disminuye, el enlace puede conducir a un semiconductor , un semimetal o, eventualmente, un conductor metálico con enlace metálico.