
La plasticidad no sináptica es una forma de neuroplasticidad que implica la modificación de la función del canal iónico en el axón , las dendritas y el cuerpo celular que da como resultado cambios específicos en la integración de los potenciales postsinápticos excitatorios y los potenciales postsinápticos inhibidores . La plasticidad no sináptica es una modificación de la excitabilidad intrínseca de la neurona. Interactúa con la plasticidad sináptica , pero se considera una entidad separada de la plasticidad sináptica. La modificación intrínseca de las propiedades eléctricas de las neuronas desempeña un papel en muchos aspectos de la plasticidad, desde la plasticidad homeostática hasta el aprendizaje y la memoria en sí. La plasticidad no sináptica afecta la integración sináptica , la propagación subumbral , la generación de picos y otros mecanismos fundamentales de las neuronas a nivel celular. Estas alteraciones neuronales individuales pueden dar como resultado cambios en la función cerebral superior , especialmente el aprendizaje y la memoria. Sin embargo, como campo emergente en la neurociencia , gran parte del conocimiento sobre la plasticidad no sináptica es incierto y aún requiere más investigación para definir mejor su papel en la función y el comportamiento cerebral.
La neuroplasticidad es la capacidad de una parte o región particular de una neurona de cambiar su fuerza con el tiempo. Existen dos categorías de plasticidad ampliamente reconocidas: sináptica y no sináptica. La plasticidad sináptica se relaciona directamente con la fuerza de la conexión entre dos neuronas, incluida la cantidad de neurotransmisor liberado por la neurona presináptica y la respuesta generada en la neurona postsináptica . La plasticidad no sináptica implica la modificación de la excitabilidad neuronal en el axón , las dendritas y el soma de una neurona individual, alejada de la sinapsis.
La plasticidad sináptica es la capacidad de una sinapsis entre dos neuronas de cambiar su fuerza con el tiempo. La plasticidad sináptica es causada por cambios en el uso de la vía sináptica, es decir, la frecuencia de los potenciales sinápticos y los receptores utilizados para transmitir señales químicas. La plasticidad sináptica desempeña un papel importante en el aprendizaje y la memoria en el cerebro. La plasticidad sináptica puede ocurrir a través de mecanismos intrínsecos, en los que los cambios en la fuerza de la sinapsis ocurren debido a su propia actividad, o a través de mecanismos extrínsecos, en los que los cambios en la fuerza de la sinapsis ocurren a través de otras vías neuronales. La plasticidad sináptica inhibitoria a corto plazo a menudo ocurre debido al suministro limitado de neurotransmisores en la sinapsis, y la inhibición a largo plazo puede ocurrir a través de la disminución de la expresión del receptor en la célula postsináptica . La plasticidad sináptica complementaria a corto plazo a menudo ocurre debido a un flujo de iones residual o aumentado en la terminal presináptica o postsináptica, mientras que la plasticidad sináptica a largo plazo puede ocurrir a través de una mayor producción de receptores de glutamato AMPA y NMDA , entre otros, en la célula postsináptica. [1]
En comparación, la plasticidad no sináptica es un campo de investigación menos conocido y relativamente nuevo y en curso en la neurociencia. Se manifiesta a través de cambios en las características de las estructuras no sinápticas, como el soma (biología) , el axón o las dendritas. La plasticidad no sináptica puede tener efectos a corto o largo plazo. Una forma en que estos cambios ocurren es a través de la modificación de los canales dependientes del voltaje en las dendritas y el axón, lo que cambia la interpretación de los potenciales excitatorios o inhibidores propagados a la célula. Por ejemplo, la plasticidad no sináptica axonal se puede observar cuando un potencial de acción no logra alcanzar la terminal presináptica debido a una baja conducción o acumulación de iones. [2]

Se ha demostrado que la plasticidad sináptica y no sináptica funcionan simultáneamente de diversas maneras para producir efectos estimulantes en la neurona. Esto incluye la generación de picos, un producto de la regulación no sináptica del potasio y otros canales iónicos presinápticos, que aumentan la respuesta del potencial postsináptico excitatorio a través de la liberación de neurotransmisores y el aumento del potencial de acción. [3] La plasticidad dendrítica no sináptica también se suma a los efectos de la plasticidad sináptica a través de la ampliación del potencial de acción. Como se analizará más adelante, las neuronas producen el factor neurotrófico derivado del cerebro (BNDF) para coordinar la plasticidad sináptica y no sináptica. [4] Los cambios no sinápticos en el cuerpo somal, el axón o las dendritas de la neurona están inextricablemente vinculados a la fuerza sináptica.
Aunque se sabe mucho más sobre el papel de la plasticidad sináptica en la memoria y el aprendizaje, tanto la plasticidad sináptica como la no sináptica son esenciales para la memoria y el aprendizaje en el cerebro. Hay mucha evidencia de que ambos mecanismos funcionan para lograr los efectos observados de forma sinérgica. Un ejemplo clave de esto es la formación de la memoria en la sinapsis, en la que la modificación de los mecanismos de liberación presináptica y los receptores postsinápticos afecta la potenciación o la depresión a largo plazo. Por otro lado, la despolarización somal continua se ha propuesto como un método para el comportamiento aprendido y la memoria mediante plasticidad no sináptica. La plasticidad no sináptica también aumenta la eficacia de la formación de la memoria sináptica mediante la regulación de los canales iónicos dependientes del voltaje . La plasticidad no sináptica es el mecanismo responsable de las modificaciones de estos canales en el axón, lo que lleva a un cambio en la fuerza del potencial de acción neuronal, afectando invariablemente la fuerza de los mecanismos sinápticos y, por lo tanto, la profundidad y la longitud de la codificación de la memoria. [5] [6]
La plasticidad no sináptica también tiene la capacidad de regular los efectos de la plasticidad sináptica a través de mecanismos de retroalimentación negativa . El cambio en el número y las propiedades de los canales iónicos en el axón o las dendritas tiene la capacidad de disminuir los efectos de una sinapsis hiperestimulada. [5] [6] En el caso de una sobreexcitación extrema de estos canales iónicos, se producirá un flujo retrógrado de iones hacia la célula, lo que provocará excitotoxicidad y muerte celular por apoptosis o necrosis . [7]
Las áreas neuronales no sinápticas, como el axón, también tienen cualidades inherentes que afectan a la sinapsis. Estos mecanismos esenciales incluyen el retraso en la despolarización que sufre el potencial de acción mientras viaja por el axón. Esta cualidad intrínseca ralentiza la propagación de los potenciales de acción y se debe al movimiento de la corriente despolarizante por el citoplasma y a la colocación intermitente de canales de sodio en los nódulos de Ranvier . Estos mecanismos siempre existen, pero pueden cambiar dependiendo de las condiciones del soma celular, el axón y las dendritas en ese momento. Por lo tanto, la latencia o el retraso en la propagación de los potenciales de acción o los potenciales postsinápticos excitatorios puede ser variable. Cada potencial postsináptico excitatorio que se propaga a una célula postsináptica se transmite primero a través del potencial de acción por el axón en la célula presináptica y, por lo tanto, la plasticidad no sináptica afecta inherentemente a la plasticidad sináptica. [1]
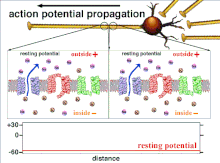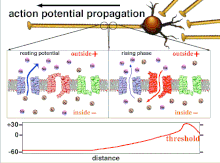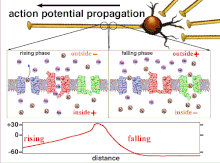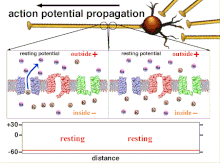
La excitabilidad de una neurona en cualquier punto depende de las condiciones internas y externas de la célula en el momento de la estimulación. Dado que una neurona normalmente recibe múltiples señales entrantes a la vez, la propagación de un potencial de acción depende de la integración de todos los potenciales postsinápticos excitatorios e inhibidores entrantes que llegan al cono axónico . Si la suma de todas las señales excitatorias e inhibidoras despolariza la membrana celular hasta el voltaje umbral, se dispara un potencial de acción. Cambiar la excitabilidad intrínseca de una neurona cambiará la función de esa neurona.
La plasticidad no sináptica tiene un efecto excitatorio en la generación de picos . El aumento en la generación de picos se ha correlacionado con una disminución en el umbral de pico , [3] una respuesta de la plasticidad no sináptica. Esta respuesta puede resultar de la modulación de ciertas corrientes presinápticas de K + (ion potasio) (I A , I K, Ca e I Ks ), que funcionan para aumentar la excitabilidad de las neuronas sensoriales, ampliar el potencial de acción y mejorar la liberación de neurotransmisores . Estas modulaciones de las conductancias de K + sirven como mecanismos comunes para regular la excitabilidad y la fuerza sináptica . [5]
La plasticidad no sináptica se ha relacionado con la plasticidad sináptica, a través de mecanismos sinérgicos y reguladores. El grado de modificación sináptica determina la polaridad de los cambios no sinápticos, lo que afecta al cambio en la excitabilidad celular. Los niveles moderados de plasticidad sináptica producen cambios no sinápticos que actuarán sinérgicamente con los mecanismos sinápticos para fortalecer una respuesta. Por el contrario, niveles más robustos de plasticidad sináptica producirán respuestas no sinápticas que actuarán como un mecanismo de retroalimentación negativa . Los mecanismos de retroalimentación negativa funcionan para proteger contra la saturación o supresión de la actividad del circuito en su conjunto. [5]
La modulación axonal es un tipo de plasticidad en la que cambia el número, la actividad o la ubicación de los canales iónicos en el axón. Esto hace que la neurona se comporte de manera diferente cuando se la estimula. La modulación de los canales iónicos es una respuesta a un cambio en las frecuencias de estimulación de una neurona.
Dado que la suma de los potenciales de acción es lo que finalmente da como resultado que se cruce la polarización umbral, la relación temporal de las diferentes señales de entrada es muy importante para determinar si una neurona postsináptica se activará y cuándo lo hará. Con el tiempo, el tiempo que tarda un potencial de acción en propagarse a lo largo de un axón en particular puede cambiar. En un experimento, se utilizaron conjuntos de múltiples electrodos para medir el tiempo que tardaban los potenciales de acción en viajar de un electrodo a otro, lo que se denomina latencia. Luego se estimularon las neuronas y se registró el valor de la latencia a lo largo del tiempo. Los valores de latencia cambiaron con el tiempo, lo que sugiere que la plasticidad axonal influyó en la propagación de los potenciales de acción. [8]
La derivación es un proceso en el que los canales iónicos axónicos se abren durante el flujo pasivo (sin necesidad de una bomba de iones ) de una despolarización subumbral a lo largo del axón. Generalmente, se produce en los puntos de ramificación axónica, [9] el momento en que estos canales se abren cuando la señal subumbral llega a la zona hace que se introduzca una hiperpolarización en la despolarización que fluye pasivamente. Por lo tanto, la célula puede controlar por qué ramas del axón fluye la corriente de despolarización subumbral, lo que da como resultado que algunas ramas del axón estén más hiperpolarizadas que otras. Estos diferentes potenciales de membrana hacen que ciertas áreas de la neurona sean más excitables que otras, según la ubicación específica y la aparición de la derivación.
Efectos a corto plazo: La estimulación de alta frecuencia de una neurona durante un corto período de tiempo aumenta la excitabilidad de la neurona al reducir la cantidad de voltaje necesaria para disparar un potencial de acción. [3] La estimulación de alta frecuencia conduce a un aumento en la concentración intracelular de iones de sodio y calcio debido a la apertura repetida de canales de sodio y calcio dependientes del voltaje en el axón y la terminal. A medida que aumenta la frecuencia de los estímulos, hay menos tiempo entre cada estímulo para que la célula se repolarice y regrese al potencial de reposo normal . Por lo tanto, el potencial de reposo se vuelve más despolarizado, lo que significa que se necesita una corriente despolarizante más pequeña para disparar un potencial de acción.
Sin embargo, esta modulación suele ser de corta duración. Si cesa la estimulación, la neurona volverá a su potencial de reposo original, ya que los canales iónicos y las bombas tienen tiempo suficiente para recuperarse del último estímulo.
Efectos a largo plazo: La estimulación de alta frecuencia de una neurona durante un largo período de tiempo provoca dos cambios neuronales resultantes. Inicialmente, la neurona responde como lo haría durante una estimulación a corto plazo, con un aumento de la excitabilidad. Continuar la estimulación de alta frecuencia después de este punto, da como resultado un cambio drástico e irreversible en la excitabilidad. Cuando las concentraciones de sodio alcanzan un nivel suficientemente alto en el axón, las bombas de sodio/calcio invierten su dirección de flujo, lo que hace que el calcio se importe a la célula a medida que el sodio se exporta. La mayor concentración de calcio (y la posterior despolarización de la membrana) inactiva los canales de sodio y los dirige a la endocitosis y la hidrólisis lisosomal . [10] Esto da como resultado una disminución importante de los canales de sodio axónicos, que son necesarios para la propagación del potencial de acción. Si la estimulación continúa, eventualmente la neurona dejará de transmitir potenciales de acción y morirá. La muerte neuronal debido a la sobreestimulación se llama excitotoxicidad .
Efectos a corto plazo: todas las neuronas vivas tienen una tasa basal de propagación del potencial de acción y de liberación sináptica. Por lo tanto, la estimulación de baja frecuencia de una neurona a corto plazo es similar a la actividad de una neurona en reposo en el cerebro. No se producen cambios importantes en la excitabilidad intrínseca de la neurona.
Efectos a largo plazo: La estimulación de baja frecuencia de una neurona durante un largo período de tiempo disminuye la excitabilidad de la neurona al activar las fosfatasas dependientes del calcio que marcan los receptores AMPA para la internalización. [11] La estimulación de baja frecuencia conduce a niveles bajos de calcio en la célula. Cuando las concentraciones de calcio son bajas, las fosfatasas dependientes del calcio activas dominan sobre las quinasas dependientes del calcio. A medida que se activan más fosfatasas, marcan más receptores AMPA para la internalización a través de la endocitosis. Dado que los receptores AMPA son uno de los principales receptores excitatorios en las neuronas, eliminarlos de la membrana celular deprime efectivamente la célula (si la célula no puede reaccionar a las señales excitatorias, no puede generar un potencial de acción propio). De esta manera, la estimulación de baja frecuencia puede realmente revertir los efectos de la potenciación a largo plazo , [12] sin embargo, estos conceptos generalmente se consideran tipos de plasticidad sináptica.
Las neuronas del sistema nervioso central (SNC) integran señales de muchas neuronas. A corto plazo, es importante tener cambios en la actividad de la neurona porque así es como se transmite la información en el sistema nervioso ( plasticidad hebbiana ). Sin embargo, para la sostenibilidad a largo plazo, la deriva hacia la excitabilidad o inexcitabilidad perturbará la capacidad del circuito para transmitir información ( plasticidad homeostática ). La potenciación a largo plazo (LTP) induce una mayor tasa de disparo en las neuronas postsinápticas. Se ha planteado la hipótesis de que las propiedades intrínsecas de una neurona deberían organizarse para aprovechar al máximo el rango dinámico, actuando como un mecanismo homeostático. [13] Sin embargo, se demostró que la excitabilidad intrínseca sigue una distribución lognormal que requiere un aprendizaje hebbiano activo para mantenerse. [14] Los estudios in vitro han encontrado que cuando se inhibe la actividad espontánea de los cultivos neuronales, las neuronas se vuelven hiperexcitables y que cuando se induce un aumento de la actividad durante períodos prolongados, las tasas de disparo del cultivo disminuyen. [15] [16] Por el contrario, hay una gran cantidad de evidencia de que la forma opuesta de regulación, el aprendizaje hebbiano o LTP-IE/LTD-IE, también ocurre [17] y los argumentos teóricos muestran que la plasticidad hebbiana debe ser la forma dominante de plasticidad para la excitabilidad intrínseca también. [14] Dado que la plasticidad homeostática también ocurre entre sinapsis individuales, [18] una visión anterior que sugería que la plasticidad homeostática y la plasticidad intrínseca están vinculadas resultó ser inconsistente con la evidencia.
Un mecanismo para preservar el rango dinámico de una neurona es el escalamiento sináptico , una forma homeostática de plasticidad que restaura la actividad neuronal a sus niveles "de referencia" normales al cambiar la respuesta postsináptica de las sinapsis de una neurona en función de la actividad. La modulación homeostática de la excitabilidad intrínseca de una neurona es otra forma de mantener la estabilidad. La regulación de las conductancias iónicas se puede lograr de varias formas, principalmente a través de la liberación de neuromoduladores como la dopamina , la serotonina , etc. [19] Otra forma es a través de la liberación controlada del factor neurotrófico derivado del cerebro (BDNF). También se ha descubierto que el BDNF influye en el escalamiento sináptico, lo que sugiere que este factor neurotrófico puede ser responsable de la coordinación de los mecanismos sinápticos y no sinápticos en la plasticidad homeostática. [4]
Las dendritas son las regiones responsables de la integración de las entradas de otras neuronas . Una forma en que las neuronas manipulan las propiedades de integración de las dendritas es modificando el número y las propiedades de los canales iónicos regulados por voltaje. La inducción de la potenciación a largo plazo (PLP) en una sinapsis particular da como resultado un aumento en la excitabilidad de las ramas dendríticas específicas de esa sinapsis. [20] La excitabilidad dendrítica es importante para la propagación e integración de señales sinápticas. Se cree que la excitabilidad dendrítica contribuye a la potenciación de los SE, o un aumento en la probabilidad de que una entrada dada resulte en la activación de un potencial de acción. [21]
Se sabe que los cambios en la excitabilidad dendrítica afectan la retropropagación del potencial de acción. Los potenciales de acción comienzan cerca del montículo axónico y se propagan a lo largo del axón, pero también se propagan hacia atrás a través del soma hacia el árbol dendrítico. La retropropagación activa depende de los canales iónicos y el cambio de las densidades o propiedades de estos canales puede influir en el grado en el que se atenúa la señal . [21] La plasticidad de la retropropagación en las dendritas ocurre en menos de un minuto y dura más de 25 minutos. [22] La retropropagación es un método de señalización a las sinapsis de que se disparó un potencial de acción. Esto es importante para la plasticidad dependiente del tiempo de pico . Experimentalmente se observó una rápida adaptación dendrítica en escalas de tiempo de unos pocos segundos, lo que indica un posible mecanismo de aprendizaje global significativo [23] [24]
La plasticidad intrínseca es una forma de plasticidad dependiente de la actividad distinta de la plasticidad sináptica , que implica cambios en la sinapsis entre dos neuronas en lugar de cambios en las propiedades eléctricas dentro de una sola neurona. [25] [26] Hay algunos fenómenos estrechamente relacionados que pueden afectar la excitabilidad de una neurona, como la neuromodulación , la plasticidad estructural, la plasticidad a corto plazo debido a la cinética del canal y el desarrollo neuronal . [27] [28] No hay consenso sobre la cantidad que regula la plasticidad intrínseca, por ejemplo, la tasa de disparo de una neurona, su ganancia o su concentración interna de calcio. Funcionalmente, la plasticidad intrínseca podría permitir que las neuronas aprendan la intensidad de los estímulos y representen esas estadísticas de intensidad en sus excitabilidades. [29] [30] La plasticidad intrínseca contribuye a la codificación de la memoria y complementa otras formas de plasticidad dependiente de la actividad, incluida la plasticidad sináptica . [31]
El experimento de Kemenes et al . [2] demostró que en una neurona moduladora extrínseca , la plasticidad no sináptica influye en la expresión de la memoria asociativa a largo plazo . La relación entre la plasticidad no sináptica y la memoria se evaluó utilizando células gigantes cerebrales (CGC). La despolarización de los estímulos condicionados aumentó la respuesta de la red neuronal. Esta despolarización duró tanto como la memoria a largo plazo . La despolarización persistente y la expresión de la memoria conductual ocurrieron más de 24 horas después del entrenamiento, lo que indica efectos a largo plazo. En este experimento, la expresión electrofisiológica del rastro de memoria a largo plazo fue una respuesta de alimentación inducida por estímulo condicionado. Las CGC estaban significativamente más despolarizadas en los organismos entrenados que en el grupo de control, lo que indica una asociación con el aprendizaje y los cambios de excitabilidad. Cuando las CGC se despolarizaron, mostraron una mayor respuesta a los estímulos condicionales y una respuesta de alimentación ficticia más fuerte. Esto demostró que la despolarización es suficiente para producir una respuesta de alimentación significativa a los estímulos condicionados. Además, no se observó ninguna diferencia significativa en las tasas de alimentación entre los organismos condicionados y los que fueron despolarizados artificialmente, lo que reafirma que la despolarización es suficiente para generar el comportamiento asociado con la memoria a largo plazo. [2]
La actividad no sináptica en la célula se expresa generalmente como cambios en la excitabilidad neuronal. Esto ocurre a través de la modulación de los componentes de la membrana, como los canales en reposo y dependientes del voltaje y las bombas de iones . Se cree que los procesos no sinápticos están involucrados en el almacenamiento de la memoria. Un posible mecanismo de esta acción implica marcar una neurona que ha estado activa recientemente con cambios en la excitabilidad. Esto ayudaría a vincular estímulos separados temporalmente. Otro mecanismo potencial proviene de un modelo computacional que indica que la plasticidad no sináptica puede preparar los circuitos para la modificación en el aprendizaje porque los cambios de excitabilidad pueden regular el umbral de plasticidad sináptica. [5]
La capacidad de almacenamiento de los sistemas de almacenamiento de memoria basados en sinapsis es muy grande, lo que los convierte en un mecanismo atractivo para estudiar. Hay aproximadamente 10 4 sinapsis por neurona y 10 11 neuronas en el cerebro humano. [25] La plasticidad no sináptica a menudo se pasa por alto simplemente porque su capacidad de almacenamiento no es tan alta. Regular la densidad de canales iónicos en el axón y el soma de una neurona cambiaría el rendimiento y afectaría a todas las sinapsis. Por lo tanto, su capacidad de almacenamiento sería significativamente menor que la de la plasticidad sináptica.
Aunque su capacidad de almacenamiento es demasiado baja como para que sea el único mecanismo de almacenamiento, la plasticidad no sináptica podría contribuir a los métodos de almacenamiento sináptico. Se ha demostrado que la modulación de los canales iónicos puede ocurrir en regiones tan pequeñas como dendritas específicas. [20] Esta especificidad hace que la capacidad de almacenamiento de la plasticidad no sináptica sea mayor que si se considerara la modulación de toda la neurona. Las memorias procedimentales son una buena opción para este tipo de sistema de almacenamiento porque no requieren la alta especificidad que requieren las memorias declarativas. La generalización de tareas motoras y estímulos condicionados podría ser una forma eficiente de almacenar esta información. [25]
Los cambios en la excitabilidad a partir del aprendizaje que actúan como parte de la huella de la memoria lo hacen como iniciadores para iniciar cambios adicionales en las neuronas o por un mecanismo de almacenamiento a corto plazo para la memoria a corto plazo. La plasticidad no sináptica puede surgir durante el aprendizaje como resultado de procesos celulares, aunque el momento, la persistencia y la relación entre la plasticidad no sináptica y la salida sináptica son poco conocidos. Los estudios han demostrado que la plasticidad no sináptica desempeña un papel indirecto pero importante en la formación de recuerdos. La plasticidad no sináptica inducida por el aprendizaje está asociada con la despolarización del soma. [5]
Los experimentos han revelado que durante el aprendizaje condicional se producen cambios no sinápticos . Woody et al . [32] demostraron que el condicionamiento del parpadeo (EBC), una forma de condicionamiento clásico para estudiar las estructuras neuronales y los mecanismos que subyacen al aprendizaje y la memoria, en un gato está asociado con una mayor excitabilidad y entrada en las neuronas de las áreas corticales sensoriomotoras y en el núcleo facial . Se observó que el aumento de la excitabilidad del condicionamiento clásico continuó después de que la respuesta se detuvo. Esto sugiere que el aumento de la excitabilidad puede funcionar como un mecanismo para el almacenamiento de la memoria. [5]
En el condicionamiento del parpadeo en conejos, se produjeron cambios no sinápticos en todo el hipocampo dorsal . Esto indica que, aunque los cambios de excitabilidad por sí solos no son suficientes para explicar los procesos de almacenamiento de la memoria, la plasticidad no sináptica podría ser un mecanismo de almacenamiento para fases de la memoria limitadas por el tiempo. Los cambios no sinápticos influyen en otros tipos de plasticidad relacionados con la memoria. Por ejemplo, un cambio no sináptico como la despolarización del potencial de membrana en reposo resultante del aprendizaje condicional podría causar plasticidad sináptica en el aprendizaje futuro. [5]
La capacidad de aprender reglas depende de la plasticidad no sináptica. Un estudio intentó enseñar a ratas a discriminar entre varios olores, y les llevó varios días enseñarles a distinguir entre un primer par de olores. Sin embargo, después de aprender esto, la rata pudo aprender a distinguir entre diferentes olores mucho más rápido. Se observaron cambios en la excitabilidad de las neuronas piramidales en estas ratas durante tres días después del entrenamiento. Estos cambios se desvanecieron con el tiempo, lo que sugiere que las neuronas estaban involucradas en el aprendizaje de las reglas, no en el almacenamiento de la memoria. [5] Daoudal y Debanne intentaron determinar si las mismas reglas de aprendizaje y mecanismos de inducción definidos para la plasticidad sináptica también se aplicaban a la plasticidad no sináptica que afectaba a los canales iónicos. Determinaron que la plasticidad no sináptica y sináptica comparten reglas de aprendizaje y vías de inducción comunes, por ejemplo, la potenciación a largo plazo dependiente del receptor NMDA (LTP) y la depresión a largo plazo (LTD). También demostraron que la plasticidad sináptica y no sináptica forman sinérgicamente un engrama coherente para almacenar rastros de memoria. [22]
El ahorro es la capacidad de volver a aprender información olvidada mucho más rápido de lo que se aprendió originalmente. La plasticidad no sináptica es un posible mecanismo para este efecto de ahorro. Durante los procedimientos de entrenamiento, muchas neuronas experimentan un aumento de la excitabilidad intrínseca. Este aumento de la excitabilidad persiste incluso después de que se desvanezca la memoria. [5] [25]
Las drogas de abuso afectan típicamente al sistema mesolímbico , o más específicamente, a la vía de recompensa del sistema nervioso. Entre las drogas de abuso más comunes, la nicotina es uno de los agonistas más potentes en la sinapsis colinérgica nicotínica. [33] La nicotina, que compite con la acetilcolina (ACh), actúa a través del receptor nicotínico de acetilcolina (nAChR) preterminal no sináptico para iniciar un cambio de potencial de membrana y propagar una señal intracelular de Ca 2+ , fomentando así la liberación de neurotransmisores. El papel específico y característico de la actividad del nAChR mediada por la corriente de calcio tiene una dependencia de voltaje diferente a la de otros canales iónicos permeables al Ca 2+ , así como una distribución temporal y espacial diferente y, como resultado, la actividad del nAChR no sináptico mejora la inducción de la potenciación sináptica, promoviendo el aprendizaje de la dependencia de sustancias. [34]
La plasticidad no sináptica puede funcionar para aliviar los efectos del daño cerebral . Cuando uno de los nervios vestibulares está dañado, la disparidad en las tasas de activación de las neuronas en los núcleos vestibulares causa reflejos vestibulares innecesarios. Los síntomas de este daño se desvanecen con el tiempo. Esto probablemente se deba a modificaciones de la excitabilidad intrínseca en las neuronas del núcleo vestibular. [25] [35]
La plasticidad no sináptica también desempeña un papel clave en la actividad convulsiva . Las convulsiones febriles, convulsiones debidas a fiebre en las primeras etapas de la vida, pueden provocar una mayor excitabilidad de las neuronas del hipocampo. Estas neuronas se vuelven muy sensibles a los agentes convulsivos. Se ha demostrado que las convulsiones en las primeras etapas de la vida pueden predisponer a una persona a sufrir más convulsiones a través de mecanismos no sinápticos. [36]
Los traumatismos, incluidos los accidentes cerebrovasculares que provocan lesiones corticales , suelen provocar epilepsia . El aumento de la excitabilidad y de las conductancias de NMDA provocan actividad epiléptica, lo que sugiere que la plasticidad no sináptica puede ser el mecanismo a través del cual se induce la epilepsia después de un traumatismo. [37]
El ácido valproico (VPA) es un tratamiento para la epilepsia , las migrañas y el trastorno bipolar que se ha relacionado con muchas afecciones, incluido el autismo . Existe un modelo animal de autismo en el que se administra VPA a ratas preñadas. Las crías tienen rasgos similares a los de los humanos con autismo. Poco después del nacimiento, estos animales muestran una excitabilidad disminuida y corrientes NMDA aumentadas . Estos efectos se corrigen en etapas posteriores de la vida. Los cambios en la excitabilidad intrínseca en estos animales ayudaron a compensar los efectos del aumento de las corrientes NMDA en la actividad de la red, una forma de plasticidad homeostática. Se cree que esto ayuda a mediar los efectos perjudiciales que tendrían las corrientes NMDA aumentadas. [38]
Se necesitan más investigaciones para obtener una comprensión más amplia de la plasticidad no sináptica. Los temas que deberían explorarse más a fondo a partir de enero de 2010 [actualizar]incluyen:
{{cite journal}}: CS1 maint: DOI inactivo a partir de noviembre de 2024 ( enlace )