El sistema inmunitario adaptativo , también conocido como sistema inmunitario adquirido o sistema inmunitario específico, es un subsistema del sistema inmunitario que se compone de células, órganos y procesos especializados que eliminan patógenos de forma específica. El sistema inmunitario adquirido es una de las dos principales estrategias de inmunidad que se encuentran en los vertebrados (la otra es el sistema inmunitario innato ).

Al igual que el sistema innato, el sistema inmunitario adaptativo incluye componentes de inmunidad humoral y de inmunidad celular y destruye los patógenos invasores. A diferencia del sistema inmunitario innato , que está preprogramado para reaccionar ante categorías amplias y comunes de patógenos, el sistema inmunitario adaptativo es sumamente específico para cada patógeno particular con el que se ha encontrado el cuerpo. [1]
La inmunidad adaptativa crea una memoria inmunológica después de una respuesta inicial a un patógeno específico y conduce a una respuesta mejorada a futuros encuentros con ese patógeno. Los anticuerpos son una parte fundamental del sistema inmunitario adaptativo. La inmunidad adaptativa puede proporcionar una protección duradera, a veces durante toda la vida de la persona. Por ejemplo, alguien que se recupera del sarampión ahora está protegido contra el sarampión durante toda su vida; en otros casos no proporciona protección de por vida, como en el caso de la varicela . Este proceso de inmunidad adaptativa es la base de la vacunación .
Las células que llevan a cabo la respuesta inmunitaria adaptativa son los glóbulos blancos conocidos como linfocitos . Las células B y las células T , dos tipos diferentes de linfocitos, llevan a cabo las actividades principales: respuestas de anticuerpos y respuesta inmunitaria mediada por células. En las respuestas de anticuerpos, las células B se activan para secretar anticuerpos , que son proteínas también conocidas como inmunoglobulinas. Los anticuerpos viajan a través del torrente sanguíneo y se unen al antígeno extraño haciendo que se inactive, lo que no permite que el antígeno se una al huésped. [2] Los antígenos son cualquier sustancia que provoque la respuesta inmunitaria adaptativa. A veces, el sistema adaptativo no puede distinguir las moléculas extrañas dañinas de las inofensivas; los efectos de esto pueden ser la fiebre del heno , el asma o cualquier otra alergia .
En la inmunidad adaptativa, los receptores específicos de patógenos se "adquieren" durante la vida del organismo (mientras que en la inmunidad innata los receptores específicos de patógenos ya están codificados en el genoma ). Esta respuesta adquirida se llama "adaptativa" porque prepara al sistema inmunológico del cuerpo para desafíos futuros (aunque en realidad también puede ser maladaptativa cuando da lugar a alergias o autoinmunidad ).
El sistema es altamente adaptable debido a dos factores. En primer lugar, la hipermutación somática es un proceso de mutaciones genéticas aleatorias aceleradas en los genes codificadores de anticuerpos, lo que permite crear anticuerpos con una nueva especificidad. En segundo lugar, la recombinación V(D)J selecciona aleatoriamente una región variable (V), una de diversidad (D) y una de unión (J) para la recombinación genética y descarta el resto, lo que produce una combinación altamente única de segmentos de genes de receptores de antígenos en cada linfocito. Este mecanismo permite que una pequeña cantidad de segmentos genéticos genere una gran cantidad de receptores de antígenos diferentes, que luego se expresan de manera única en cada linfocito individual . Dado que la reorganización genética conduce a un cambio irreversible en el ADN de cada célula, toda la progenie (descendencia) de esa célula hereda genes que codifican la misma especificidad de receptor, incluidas las células B y las células T de memoria que son las claves para la inmunidad específica de larga duración.
El término "adaptativo" fue utilizado por primera vez por Robert Good en referencia a las respuestas de anticuerpos en ranas como sinónimo de "respuesta inmune adquirida" en 1964. Good reconoció que utilizó los términos como sinónimos, pero solo explicó que prefería utilizar el término "adaptativo". Es posible que estuviera pensando en la teoría, entonces no inverosímil, de la formación de anticuerpos en la que los anticuerpos eran plásticos y podían adaptarse a la forma molecular de los antígenos, y/o en el concepto de "enzimas adaptativas" como las describió Monod en las bacterias, es decir, enzimas cuya expresión podría ser inducida por sus sustratos. La frase fue utilizada casi exclusivamente por Good y sus estudiantes y algunos otros inmunólogos que trabajaban con organismos marginales hasta la década de 1990, cuando se utilizó ampliamente junto con el término "inmunidad innata", que se convirtió en un tema popular después del descubrimiento del sistema del receptor Toll en Drosophila , un organismo previamente marginal para el estudio de la inmunología. El término "adaptativo" tal como se utiliza en inmunología es problemático, ya que las respuestas inmunitarias adquiridas pueden ser tanto adaptativas como maladaptativas en el sentido fisiológico. De hecho, tanto las respuestas inmunitarias adquiridas como las innatas pueden ser tanto adaptativas como maladaptativas en el sentido evolutivo. La mayoría de los libros de texto actuales, tras el uso temprano de Janeway , utilizan "adaptativo" casi exclusivamente y señalan en los glosarios que el término es sinónimo de "adquirido". [ cita requerida ]
El sentido clásico de "inmunidad adquirida" pasó a significar, desde el descubrimiento de Tonegawa , "inmunidad específica de antígeno mediada por reordenamientos de genes somáticos que crean receptores de antígenos que definen clones". En la última década, el término "adaptativo" se ha aplicado cada vez más a otra clase de respuesta inmunitaria no asociada hasta ahora con reordenamientos de genes somáticos. Estas incluyen la expansión de células asesinas naturales (NK) con especificidad hasta ahora inexplicable para antígenos, la expansión de células NK que expresan receptores codificados en la línea germinal y la activación de otras células inmunitarias innatas a un estado activado que confiere una "memoria inmunitaria" de corto plazo. En este sentido, la "inmunidad adaptativa" se asemeja más al concepto de "estado activado" o "heterostasis", volviendo así en sentido al sentido fisiológico de "adaptación" a los cambios ambientales. [ cita requerida ]
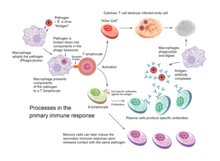
La inmunidad adquirida se activa en los vertebrados cuando un patógeno evade el sistema inmunológico innato y (1) genera un nivel umbral de antígeno y (2) genera señales "extrañas" o "peligrosas" que activan las células dendríticas . [3]
Las principales funciones del sistema inmunológico adquirido incluyen: [ cita requerida ]
En los seres humanos, el sistema inmunológico adaptativo tarda entre 4 y 7 días en generar una respuesta significativa. [4]
Los linfocitos T y B son las células del sistema inmunitario adaptativo. El cuerpo humano tiene alrededor de 2 billones de linfocitos, que constituyen el 20-40% de los glóbulos blancos; su masa total es aproximadamente la misma que la del cerebro o el hígado . El torrente sanguíneo periférico contiene solo el 2% de todos los linfocitos circulantes; el otro 98% se mueve dentro de los tejidos y el sistema linfático , que incluye los ganglios linfáticos y el bazo . [2] En los seres humanos, aproximadamente el 1-2% del conjunto de linfocitos recircula cada hora para aumentar la oportunidad de que las células se encuentren con el patógeno y el antígeno específicos a los que reaccionan. [5]
Las células B y las células T se derivan de las mismas células madre hematopoyéticas multipotentes y parecen idénticas entre sí hasta después de que se activan. Las células B desempeñan un papel importante en la respuesta inmunitaria humoral , mientras que las células T están íntimamente involucradas en las respuestas inmunitarias mediadas por células . En todos los vertebrados excepto Agnatha , las células B y las células T son producidas por células madre en la médula ósea. [6] Los progenitores de células T luego migran de la médula ósea al timo , donde se desarrollan más.
En un animal adulto, los órganos linfoides periféricos contienen una mezcla de células B y T en al menos tres etapas de diferenciación: [ cita requerida ]
La inmunidad adquirida se basa en la capacidad de las células inmunitarias para distinguir entre las células del propio organismo y los invasores no deseados. Las células del huésped expresan antígenos "propios" . Estos antígenos son diferentes de los que se encuentran en la superficie de las bacterias o en la superficie de las células del huésped infectadas por virus (antígenos "ajenos" o "extraños"). La respuesta inmunitaria adquirida se desencadena al reconocer un antígeno extraño en el contexto celular de una célula dendrítica activada. [ cita requerida ]
Con excepción de las células no nucleadas (incluidos los eritrocitos ), todas las células son capaces de presentar antígenos a través de la función de las moléculas del complejo mayor de histocompatibilidad (CMH). [6] Algunas células están especialmente equipadas para presentar antígenos y preparar a las células T vírgenes. Las células dendríticas , las células B y los macrófagos están equipados con ligandos "coestimuladores" especiales reconocidos por los receptores coestimuladores de las células T y se denominan células presentadoras de antígenos (CPA) profesionales. [ cita requerida ]
Las células T activadas por APC profesionales pueden activar varios subgrupos de células T, y cada tipo de célula T está especialmente equipada para enfrentarse a cada toxina o patógeno microbiano específico. El tipo de célula T activada y el tipo de respuesta generada dependen, en parte, del contexto en el que la APC se encontró por primera vez con el antígeno. [3]
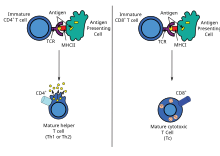
Las células dendríticas engullen patógenos exógenos , como bacterias, parásitos o toxinas en los tejidos y luego migran, a través de señales quimiotácticas , a los ganglios linfáticos enriquecidos con células T. Durante la migración, las células dendríticas experimentan un proceso de maduración en el que pierden la mayor parte de su capacidad para engullir otros patógenos y desarrollan la capacidad de comunicarse con las células T. La célula dendrítica utiliza enzimas para cortar el patógeno en trozos más pequeños, llamados antígenos . En el ganglio linfático, la célula dendrítica muestra estos antígenos no propios en su superficie al acoplarlos a un receptor llamado complejo mayor de histocompatibilidad o MHC (también conocido en humanos como antígeno leucocitario humano (HLA)). Este complejo MHC-antígeno es reconocido por las células T que pasan a través del ganglio linfático. Los antígenos exógenos generalmente se muestran en moléculas MHC de clase II , que activan las células T auxiliares CD4 + . [3]
Los antígenos endógenos son producidos por bacterias y virus intracelulares que se replican dentro de una célula huésped. La célula huésped utiliza enzimas para digerir las proteínas asociadas al virus y muestra estas partes en su superficie a las células T acoplándolas al MHC. Los antígenos endógenos se muestran típicamente en moléculas de MHC de clase I y activan las células T citotóxicas CD8 +. Con la excepción de las células no nucleadas (incluidos los eritrocitos ), el MHC de clase I se expresa en todas las células huésped. [3]
Las células T citotóxicas (también conocidas como TC, células T asesinas o linfocitos T citotóxicos (CTL)) son un subgrupo de células T que inducen la muerte de células infectadas con virus (y otros patógenos) o que están dañadas o disfuncionales. [3]
Las células T citotóxicas ingenuas se activan cuando su receptor de células T (TCR) interactúa fuertemente con una molécula MHC de clase I unida a un péptido. Esta afinidad depende del tipo y la orientación del complejo antígeno/MHC, y es lo que mantiene unidos a los CTL y a la célula infectada. [3] Una vez activados, los CTL experimentan un proceso llamado selección clonal , en el que adquieren funciones y se dividen rápidamente para producir un ejército de células efectoras "armadas". Los CTL activados luego viajan por todo el cuerpo en busca de células que porten ese péptido MHC de clase I + único. [ cita requerida ]
Cuando se exponen a estas células somáticas infectadas o disfuncionales , los CTL efectores liberan perforina y granulisina : citotoxinas que forman poros en la membrana plasmática de la célula diana , lo que permite que los iones y el agua fluyan hacia la célula infectada y provoquen su estallido o lisis . Los CTL liberan granzima , una serina proteasa encapsulada en un gránulo que ingresa a las células a través de los poros para inducir la apoptosis (muerte celular). Para limitar el daño tisular extenso durante una infección, la activación de los CTL está estrictamente controlada y, en general, requiere una señal de activación de antígeno/MHC muy fuerte, o señales de activación adicionales proporcionadas por células T "auxiliares" (ver a continuación). [3]
Al resolverse la infección, la mayoría de las células efectoras mueren y los fagocitos las eliminan, pero algunas de estas células permanecen como células de memoria. [6] En un encuentro posterior con el mismo antígeno, estas células de memoria se diferencian rápidamente en células efectoras, acortando drásticamente el tiempo necesario para generar una respuesta efectiva. [ cita requerida ]

Los linfocitos CD4+, también llamados células T "auxiliares", son mediadores de la respuesta inmunitaria y desempeñan un papel importante en el establecimiento y la maximización de las capacidades de la respuesta inmunitaria adquirida. [3] Estas células no tienen actividad citotóxica ni fagocítica y no pueden matar células infectadas ni eliminar patógenos, sino que, en esencia, "gestionan" la respuesta inmunitaria al ordenar a otras células que realicen estas tareas. [ cita requerida ]
Las células T colaboradoras expresan receptores de células T (TCR) que reconocen el antígeno unido a las moléculas del MHC de clase II. La activación de una célula T colaboradora ingenua hace que libere citocinas, lo que influye en la actividad de muchos tipos de células, incluida la célula presentadora de antígeno (APC) que la activó. Las células T colaboradoras requieren un estímulo de activación mucho más suave que las células T citotóxicas. Las células T colaboradoras pueden proporcionar señales adicionales que "ayudan" a activar las células citotóxicas. [6]
Clásicamente, una APC profesional puede inducir dos tipos de respuestas de células T auxiliares CD4 + efectoras , denominadas Th1 y Th2, cada una diseñada para eliminar diferentes tipos de patógenos. Los factores que determinan si una infección desencadena una respuesta de tipo Th1 o Th2 no se comprenden por completo, pero la respuesta generada sí desempeña un papel importante en la eliminación de diferentes patógenos. [3]
La respuesta Th1 se caracteriza por la producción de interferón-gamma , que activa las actividades bactericidas de los macrófagos e induce a las células B a producir anticuerpos opsonizantes (marcadores para la fagocitosis) y fijadores del complemento, y conduce a la inmunidad mediada por células . [3] En general, las respuestas Th1 son más efectivas contra patógenos intracelulares (virus y bacterias que están dentro de las células huésped).
La respuesta Th2 se caracteriza por la liberación de interleucina 5 , que induce eosinófilos en la eliminación de parásitos. [8] Th2 también produce interleucina 4 , que facilita el cambio de isotipo de las células B. [3] En general, las respuestas Th2 son más efectivas contra bacterias extracelulares , parásitos incluidos helmintos y toxinas . [3] Al igual que las células T citotóxicas, la mayoría de las células auxiliares CD4 + mueren al resolverse la infección, y unas pocas permanecen como células de memoria CD4 + .
Cada vez hay más pruebas sólidas de estudios científicos basados en ratones y humanos de una diversidad más amplia en los subconjuntos de células T auxiliares efectoras CD4 + . [9] [10] Las células T reguladoras (Treg) se han identificado como importantes reguladores negativos de la inmunidad adaptativa, ya que limitan y suprimen el sistema inmunológico para controlar las respuestas inmunes aberrantes a los autoantígenos; un mecanismo importante para controlar el desarrollo de enfermedades autoinmunes. [6] Las células T auxiliares foliculares (Tfh) son otra población distinta de células T efectoras CD4 + que se desarrollan a partir de células T vírgenes después de la activación del antígeno. Las células Tfh están especializadas en ayudar a la inmunidad humoral de las células B , ya que son excepcionalmente capaces de migrar a las células B foliculares en los órganos linfoides secundarios y proporcionarles señales paracrinas positivas para permitir la generación y recuperación de la producción de anticuerpos madurados por afinidad de alta calidad . De manera similar a los Tregs, las células Tfh también desempeñan un papel en la tolerancia inmunológica , ya que una expansión anormal del número de células Tfh puede conducir a una producción irrestricta de anticuerpos autorreactivos que causan trastornos autoinmunes sistémicos graves. [11]
La importancia de las células T CD4 + auxiliares se pone de relieve durante una infección por VIH . El VIH es capaz de subvertir el sistema inmunológico atacando específicamente a las células T CD4 + , precisamente las células que podrían impulsar la eliminación del virus, pero también las células que impulsan la inmunidad contra todos los demás patógenos encontrados durante la vida de un organismo. [6]
Las células T gamma delta (células T γδ) poseen un receptor de células T alternativo (TCR) a diferencia de las células T CD4+ y CD8+ αβ y comparten características de las células T auxiliares, las células T citotóxicas y las células asesinas naturales. Al igual que otros subconjuntos de células T "no convencionales" que tienen TCR invariantes, como las células T asesinas naturales restringidas a CD1d , las células T γδ presentan características que las colocan en el límite entre la inmunidad innata y adquirida. Por un lado, las células T γδ pueden considerarse un componente de la inmunidad adaptativa en el sentido de que reorganizan los genes TCR a través de la recombinación V(D)J , que también produce diversidad de unión , y desarrollan un fenotipo de memoria. Sin embargo, por otro lado, los diversos subconjuntos también pueden considerarse parte del sistema inmunológico innato, donde un TCR restringido o receptores NK pueden usarse como un receptor de reconocimiento de patrones . Por ejemplo, según este paradigma, un gran número de células T Vγ9/Vδ2 responden en cuestión de horas a moléculas comunes producidas por microbios, y células T Vδ1 intraepiteliales altamente restringidas responden a células epiteliales estresadas. [ cita requerida ]

Las células B son las principales células implicadas en la creación de anticuerpos que circulan en el plasma sanguíneo y la linfa, conocida como inmunidad humoral . Los anticuerpos (también conocidos como inmunoglobulina, Ig), son proteínas grandes en forma de Y que utiliza el sistema inmunológico para identificar y neutralizar objetos extraños. En los mamíferos, hay cinco tipos de anticuerpos: IgA , IgD , IgE , IgG e IgM , que difieren en sus propiedades biológicas; cada uno ha evolucionado para manejar diferentes tipos de antígenos. Tras la activación, las células B producen anticuerpos, cada uno de los cuales reconoce un antígeno único y neutraliza patógenos específicos. [3]
La unión del antígeno y del anticuerpo provocaría cinco mecanismos de protección diferentes:
Al igual que las células T, las células B expresan un receptor de células B (BCR) único, en este caso, una molécula de anticuerpo unida a la membrana. Todos los BCR de cualquier clon de células B reconocen y se unen a un solo antígeno en particular. Una diferencia fundamental entre las células B y las células T es la forma en que cada célula "ve" un antígeno. Las células T reconocen su antígeno cognado en una forma procesada, como un péptido en el contexto de una molécula MHC, [3] mientras que las células B reconocen antígenos en su forma nativa. [3] Una vez que una célula B encuentra su antígeno cognado (o específico) (y recibe señales adicionales de una célula T colaboradora (predominantemente de tipo Th2)), se diferencia aún más en una célula efectora, conocida como célula plasmática. [3]
Las células plasmáticas son células de vida corta (2-3 días) que secretan anticuerpos. Estos anticuerpos se unen a los antígenos, lo que los convierte en objetivos más fáciles para los fagocitos y desencadenan la cascada del complemento . [3] Alrededor del 10% de las células plasmáticas sobreviven para convertirse en células B de memoria específicas de antígeno de larga vida . [3] Estas células, ya preparadas para producir anticuerpos específicos, pueden ser llamadas a responder rápidamente si el mismo patógeno vuelve a infectar al huésped, mientras que este experimenta pocos síntomas, si es que experimenta alguno.
Los vertebrados primitivos sin mandíbula , como la lamprea y el pez bruja , tienen un sistema inmunológico adaptativo que muestra 3 linajes celulares diferentes, cada uno de los cuales comparte un origen común con las células B, las células T αβ y las células T γΔ innatas. [12] [13] En lugar de los anticuerpos clásicos y los receptores de células T , estos animales poseen una gran variedad de moléculas llamadas receptores de linfocitos variables (VLR, por sus siglas en inglés) que, al igual que los receptores de antígenos de los vertebrados con mandíbula, se producen a partir de solo una pequeña cantidad (uno o dos) de genes . Se cree que estas moléculas se unen a los antígenos patógenos de manera similar a los anticuerpos y con el mismo grado de especificidad. [14]
Durante mucho tiempo se creyó que los insectos y otros invertebrados solo poseían un sistema inmunológico innato . Sin embargo, en los últimos años se han descubierto algunas de las características básicas de la inmunidad adaptativa en los insectos. Esos rasgos son la memoria inmunológica y la especificidad. Aunque las características están presentes, los mecanismos son diferentes a los de los vertebrados .
La memoria inmunitaria en los insectos se descubrió mediante el fenómeno de la preparación. Cuando los insectos se exponen a una dosis no letal o a bacterias muertas por calor , pueden desarrollar un recuerdo de esa infección que les permite soportar una dosis letal de la misma bacteria a la que estuvieron expuestos anteriormente. [15] [16] A diferencia de los vertebrados, los insectos no poseen células específicas para la inmunidad adaptativa. En cambio, esos mecanismos están mediados por los hemocitos . Los hemocitos funcionan de manera similar a los fagocitos y después de la preparación pueden reconocer y engullir al patógeno de manera más efectiva. [17] También se demostró que es posible transferir la memoria a la descendencia. Por ejemplo, en las abejas melíferas , si la reina está infectada con bacterias, las obreras recién nacidas tienen habilidades mejoradas para luchar contra la misma bacteria. [18] Otro modelo experimental basado en el escarabajo rojo de la harina también mostró una transferencia de memoria preparada específica del patógeno a la descendencia tanto de la madre como del padre. [19]
La teoría más comúnmente aceptada de la especificidad se basa en el gen Dscam . El gen Dscam, también conocido como molécula adhesiva de células del síndrome de Down, es un gen que contiene 3 dominios de Ig variables . Esos dominios pueden empalmarse alternativamente alcanzando un alto número de variaciones. [20] Se ha demostrado que después de la exposición a diferentes patógenos se producen diferentes formas de empalme de dscam. Después de que los animales con diferentes formas de empalme se exponen al mismo patógeno, solo sobreviven los individuos con la forma de empalme específica para ese patógeno. [20]
Otros mecanismos que respaldan la especificidad de la inmunidad de los insectos son la interferencia de ARN (RNAi). La RNAi es una forma de inmunidad antiviral con alta especificidad. [21] Tiene varias vías diferentes que terminan con el virus siendo incapaz de replicarse. Una de las vías es el ARNi en el que el ARN bicatenario largo se corta en pedazos que sirven como plantillas para el complejo proteico Ago2-RISC que encuentra y degrada el ARN complementario del virus. La vía del miRNA en el citoplasma se une al complejo Ago1-RISC y funciona como una plantilla para la degradación del ARN viral. El último es el piRNA donde el ARN pequeño se une a la familia de proteínas Piwi y controla las transposonas y otros elementos móviles. [22] A pesar de la investigación, los mecanismos exactos responsables de la preparación inmunitaria y la especificidad en los insectos no están bien descritos.

CRISPR es un término utilizado en la investigación del ADN . Significa repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas . Estas son parte del código genético de los procariotas : la mayoría de las bacterias y arqueas las tienen. Es su defensa contra el ataque de los virus . [23] Su estructura y función se descubrieron en el siglo XXI. [24] [25] [26]
CRISPR tiene muchas secuencias cortas repetidas. Estas secuencias son parte de un sistema inmunológico adaptativo para procariotas. Les permite recordar y contrarrestar a los bacteriófagos que los atacan. Funcionan como una especie de sistema inmunológico adquirido para las bacterias. [27] [28]
Cuando se activan las células B y las células T, algunas se convierten en células B de memoria y otras en células T de memoria . A lo largo de la vida de un animal, estas células de memoria forman una base de datos de linfocitos B y T eficaces. Al interactuar con un antígeno encontrado previamente, se seleccionan y activan las células de memoria apropiadas. De esta manera, la segunda y posteriores exposiciones a un antígeno producen una respuesta inmunitaria más fuerte y rápida. Esto es "adaptativo" en el sentido de que el sistema inmunitario del cuerpo se prepara para desafíos futuros, pero es "maladaptativo", por supuesto, si los receptores son autoinmunes. La memoria inmunológica puede adoptar la forma de memoria pasiva a corto plazo o de memoria activa a largo plazo. [ cita requerida ]
La memoria pasiva suele ser de corto plazo, con una duración de entre unos días y varios meses. Los recién nacidos no han tenido exposición previa a microbios y son particularmente vulnerables a las infecciones. La madre proporciona varias capas de protección pasiva. En el útero , la IgG materna se transporta directamente a través de la placenta , de modo que, al nacer, los bebés humanos tienen altos niveles de anticuerpos, con el mismo rango de especificidades antigénicas que su madre. [3] La leche materna contiene anticuerpos (principalmente IgA) que se transfieren al intestino del bebé, protegiéndolo contra infecciones bacterianas, hasta que el recién nacido puede sintetizar sus propios anticuerpos. [3]
Se trata de inmunidad pasiva porque el feto en realidad no produce células de memoria ni anticuerpos: solo los toma prestados. La inmunidad pasiva a corto plazo también puede transferirse artificialmente de un individuo a otro a través de un suero rico en anticuerpos . [ cita requerida ]
En general, la inmunidad activa es a largo plazo y puede adquirirse mediante una infección seguida de la activación de las células B y T, o adquirirse artificialmente mediante vacunas, en un proceso llamado inmunización.
Históricamente, las enfermedades infecciosas han sido la principal causa de muerte en la población humana. Durante el último siglo, se han desarrollado dos factores importantes para combatir su propagación: el saneamiento y la inmunización . [6] La inmunización (comúnmente denominada vacunación ) es la inducción deliberada de una respuesta inmunitaria y representa la manipulación más eficaz del sistema inmunitario que los científicos han desarrollado. [6] Las inmunizaciones tienen éxito porque utilizan la especificidad natural del sistema inmunitario, así como su inducibilidad. [ cita requerida ]
El principio de la inmunización consiste en introducir un antígeno, derivado de un organismo causante de una enfermedad, que estimula el sistema inmunitario para que desarrolle una inmunidad protectora contra ese organismo, pero que no provoca por sí mismo los efectos patógenos de ese organismo. Un antígeno (abreviatura de generador de anticuerpos ) se define como cualquier sustancia que se une a un anticuerpo específico y provoca una respuesta inmunitaria adaptativa. [2]
La mayoría de las vacunas virales se basan en virus vivos atenuados , mientras que muchas vacunas bacterianas se basan en componentes acelulares de microorganismos, incluidos componentes de toxinas inofensivos . [2] Muchos antígenos derivados de vacunas acelulares no inducen fuertemente una respuesta adaptativa, y la mayoría de las vacunas bacterianas requieren la adición de adyuvantes que activan las células presentadoras de antígenos del sistema inmunológico innato para mejorar la inmunogenicidad . [6]

La mayoría de las moléculas grandes, incluidas prácticamente todas las proteínas y muchos polisacáridos , pueden servir como antígenos. [3] Las partes de un antígeno que interactúan con una molécula de anticuerpo o un receptor de linfocitos se denominan epítopos o determinantes antigénicos. La mayoría de los antígenos contienen una variedad de epítopos y pueden estimular la producción de anticuerpos, respuestas específicas de células T o ambas. [3] Una proporción muy pequeña (menos del 0,01 %) de los linfocitos totales pueden unirse a un antígeno en particular, lo que sugiere que solo unas pocas células responden a cada antígeno. [6]
Para que la respuesta adquirida "recuerde" y elimine una gran cantidad de patógenos, el sistema inmunitario debe ser capaz de distinguir entre muchos antígenos diferentes [2], y los receptores que reconocen los antígenos deben producirse en una enorme variedad de configuraciones, en esencia, un receptor (al menos) para cada patógeno diferente que pueda encontrarse. Incluso en ausencia de estimulación antigénica, un ser humano puede producir más de un billón de moléculas de anticuerpos diferentes [6] . Se necesitarían millones de genes para almacenar la información genética que produce estos receptores, pero el genoma humano completo contiene menos de 25.000 genes [29] .
La producción de una gran cantidad de receptores se realiza mediante un proceso conocido como selección clonal . [2] [3] Según la teoría de la selección clonal, al nacer, un animal genera aleatoriamente una gran diversidad de linfocitos (cada uno de ellos con un receptor de antígeno único) a partir de la información codificada en una pequeña familia de genes. Para generar cada receptor de antígeno único, estos genes han pasado por un proceso llamado recombinación V(D)J o diversificación combinatoria , en el que un segmento de gen se recombina con otros segmentos de gen para formar un único gen único. Este proceso de ensamblaje genera la enorme diversidad de receptores y anticuerpos, antes de que el cuerpo se encuentre con los antígenos, y permite que el sistema inmunológico responda a una diversidad casi ilimitada de antígenos. [3] A lo largo de la vida de un animal, los linfocitos que pueden reaccionar contra los antígenos con los que se encuentra realmente el animal son seleccionados para actuar, dirigidos contra cualquier cosa que exprese ese antígeno. [ cita requerida ]
Las partes innata y adquirida del sistema inmunitario trabajan juntas, no una a pesar de la otra. El brazo adquirido, las células B y T no podrían funcionar sin la intervención del sistema innato. Las células T son inútiles sin las células presentadoras de antígenos que las activen, y las células B quedan inutilizadas sin la ayuda de las células T. Por otra parte, el sistema innato probablemente se vería invadido por patógenos sin la acción especializada de la respuesta inmunitaria adaptativa.
La piedra angular del sistema inmunitario es el reconocimiento de lo "propio" frente a lo "ajeno". Por lo tanto, los mecanismos que protegen al feto humano (que se considera "ajeno") del ataque del sistema inmunitario son particularmente interesantes. Aunque no ha surgido una explicación exhaustiva para explicar esta misteriosa, y a menudo repetida, falta de rechazo, dos razones clásicas pueden explicar cómo se tolera al feto. La primera es que el feto ocupa una parte del cuerpo protegida por una barrera no inmunológica, el útero , que el sistema inmunitario no patrulla de forma rutinaria. [3] La segunda es que el propio feto puede promover la inmunosupresión local en la madre, tal vez mediante un proceso de agotamiento activo de nutrientes. [3] Una explicación más moderna para esta inducción de tolerancia es que las glicoproteínas específicas expresadas en el útero durante el embarazo suprimen la respuesta inmunitaria uterina (véase eu-FEDS ). [ cita requerida ]
Durante el embarazo en los mamíferos vivíparos (todos los mamíferos excepto los monotremas ), los retrovirus endógenos (ERV) se activan y producen en grandes cantidades durante la implantación del embrión. Actualmente se sabe que poseen propiedades inmunosupresoras, lo que sugiere un papel en la protección del embrión del sistema inmunológico de su madre. Además, las proteínas de fusión virales causan la formación del sincitio placentario [30] para limitar el intercambio de células migratorias entre el embrión en desarrollo y el cuerpo de la madre (algo que un epitelio no puede hacer de manera suficiente, ya que ciertas células sanguíneas se especializan para insertarse entre células epiteliales adyacentes). La acción inmunodepresora fue el comportamiento normal inicial del virus, similar al VIH. Las proteínas de fusión fueron una forma de propagar la infección a otras células simplemente fusionándolas con la infectada (el VIH también hace esto). Se cree que los ancestros de los mamíferos vivíparos modernos evolucionaron después de una infección por este virus, lo que permitió que el feto sobreviviera al sistema inmunológico de la madre. [31]
El proyecto del genoma humano encontró varios miles de ERV clasificados en 24 familias. [32]
Un marco teórico que explica el funcionamiento del sistema inmunitario adquirido lo proporciona la teoría de la red inmunitaria , basada en las interacciones entre idiotipos (características moleculares únicas de un clonotipo, es decir, el conjunto único de determinantes antigénicos de la porción variable de un anticuerpo) y "antiidiotipos" (receptores de antígenos que reaccionan con el idiotipo como si fuera un antígeno extraño). Esta teoría, que se basa en la hipótesis de selección clonal existente y desde 1974 ha sido desarrollada principalmente por Niels Jerne y Geoffrey W. Hoffmann , se considera relevante para la comprensión de la patogénesis del VIH y la búsqueda de una vacuna contra el VIH .
Uno de los desarrollos más interesantes en la ciencia biomédica durante las últimas décadas ha sido la elucidación de los mecanismos que median la inmunidad innata. Un conjunto de mecanismos inmunes innatos es humoral, como la activación del complemento . Otro conjunto comprende receptores de reconocimiento de patrones como los receptores tipo Toll , que inducen la producción de interferones y otras citocinas que aumentan la resistencia de células como los monocitos a las infecciones. [33] Las citocinas producidas durante las respuestas inmunes innatas se encuentran entre los activadores de las respuestas inmunes adaptativas. [33] Los anticuerpos ejercen efectos aditivos o sinérgicos con los mecanismos de inmunidad innata. La HbS inestable agrupa Band-3, una proteína integral importante de los glóbulos rojos; [34] los anticuerpos reconocen estos grupos y aceleran su eliminación por las células fagocíticas. Las proteínas Band 3 agrupadas con anticuerpos unidos activan el complemento, y los fragmentos C3 del complemento son opsoninas reconocidas por el receptor del complemento CR1 en las células fagocíticas. [35]
Un estudio de población ha demostrado que el efecto protector del rasgo falciforme contra la malaria por falciparum implica el aumento de las respuestas inmunes adquiridas e innatas al parásito de la malaria, lo que ilustra la transición esperada de la inmunidad innata a la adquirida. [36]
Las infecciones repetidas de malaria fortalecen la inmunidad adquirida y amplían sus efectos contra los parásitos que expresan diferentes antígenos de superficie . En la edad escolar, la mayoría de los niños han desarrollado una inmunidad adaptativa eficaz contra la malaria. Estas observaciones plantean preguntas sobre los mecanismos que favorecen la supervivencia de la mayoría de los niños en África, al tiempo que permiten que algunos desarrollen infecciones potencialmente letales.
En el caso de la malaria, como en otras infecciones, [33] las respuestas inmunitarias innatas dan lugar a respuestas inmunitarias adaptativas y las estimulan. El control genético de la inmunidad innata y adquirida es hoy una disciplina amplia y floreciente.
Las respuestas inmunes humorales y mediadas por células limitan la multiplicación del parásito de la malaria, y muchas citocinas contribuyen a la patogénesis de la malaria, así como a la resolución de las infecciones. [37]
El sistema inmune adquirido, que ha sido mejor estudiado en mamíferos, se originó en peces con mandíbula hace aproximadamente 500 millones de años. La mayoría de las moléculas, células, tejidos y mecanismos asociados de este sistema de defensa se encuentran en peces cartilaginosos . [38] Los receptores de linfocitos , Ig y TCR, se encuentran en todos los vertebrados con mandíbula. La clase de Ig más antigua, IgM, está unida a la membrana y luego se secreta tras la estimulación de las células B de peces cartilaginosos. Otro isotipo, IgW de tiburón, está relacionado con la IgD de mamíferos. Los TCR, tanto α/β como γ/δ, se encuentran en todos los animales, desde los gnatóstomos hasta los mamíferos. La organización de los segmentos genéticos que experimentan reordenamiento genético difiere en los peces cartilaginosos, que tienen una forma de grupo en comparación con la forma de translocón en los peces óseos hasta los mamíferos. Al igual que el TCR y la Ig, el MHC se encuentra solo en vertebrados con mandíbula. Los genes implicados en el procesamiento y presentación de antígenos , así como los genes de clase I y clase II , están estrechamente vinculados dentro del MHC de casi todas las especies estudiadas. [ cita requerida ]
Las células linfoides se pueden identificar en algunos deuteróstomos prevertebrados (es decir, erizos de mar). [39] Estos se unen al antígeno con receptores de reconocimiento de patrones (PRR) del sistema inmunológico innato . En peces sin mandíbula , dos subconjuntos de linfocitos utilizan receptores de linfocitos variables (VLR) para la unión al antígeno. [40] La diversidad se genera por un reordenamiento mediado por la citosina deaminasa de segmentos de ADN basados en LRR . [41] No hay evidencia de los genes activadores de la recombinación (RAG) que reordenan los segmentos de genes Ig y TCR en vertebrados con mandíbula.
Se cree que la evolución del AIS, basada en moléculas de Ig, TCR y MHC, surgió de dos eventos evolutivos importantes: la transferencia del transposón RAG (posiblemente de origen viral) y dos duplicaciones del genoma completo . [38] Aunque las moléculas del AIS están bien conservadas, también están evolucionando rápidamente. Sin embargo, un enfoque comparativo descubre que muchas características son bastante uniformes en todos los taxones. Todas las características principales del AIS surgieron temprano y rápidamente. Los peces sin mandíbula tienen un AIS diferente que se basa en el reordenamiento genético para generar diversos receptores inmunes con una dicotomía funcional que es paralela a las moléculas de Ig y TCR. [42] El sistema inmune innato , que tiene un papel importante en la activación del AIS, es el sistema de defensa más importante de los invertebrados y las plantas .
La inmunidad se puede adquirir de forma activa o pasiva. La inmunidad se adquiere de forma activa cuando una persona se expone a sustancias extrañas y el sistema inmunitario responde. La inmunidad pasiva se produce cuando los anticuerpos se transfieren de un huésped a otro. Tanto la inmunidad adquirida de forma activa como la adquirida de forma pasiva se pueden obtener por medios naturales o artificiales.