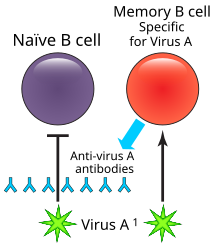
En inmunología , una célula B de memoria ( MBC ) es un tipo de linfocito B que forma parte del sistema inmunológico adaptativo . Estas células se desarrollan dentro de los centros germinales de los órganos linfoides secundarios . Las células B de memoria circulan en el torrente sanguíneo en un estado inactivo, a veces durante décadas. [1] Su función es memorizar las características del antígeno que activó su célula B madre durante la infección inicial, de modo que si la célula B de memoria se encuentra más tarde con el mismo antígeno , desencadena una respuesta inmune secundaria acelerada y robusta . [2] [3] Las células B de memoria tienen receptores de células B (BCR) en su membrana celular, idénticos a los de su célula madre, que les permiten reconocer el antígeno y generar una respuesta de anticuerpos específica. [4]
En una vía de desarrollo dependiente de células T , las células B foliculares vírgenes son activadas por células T auxiliares foliculares presentadoras de antígeno (T FH ) durante la infección inicial o respuesta inmune primaria . [3] Las células B vírgenes circulan a través de los folículos en los órganos linfoides secundarios (es decir, el bazo y los ganglios linfáticos ), donde pueden ser activadas por un péptido extraño flotante introducido a través de la linfa o por un antígeno presentado por las células presentadoras de antígenos (APC), como las células dendríticas. (CD). [5] Las células B también pueden activarse uniéndose a un antígeno extraño en la periferia, donde luego se mueven hacia los órganos linfoides secundarios. [3] Una señal transducida por la unión del péptido a la célula B hace que las células migren al borde del folículo que bordea el área de las células T. [5]
Las células B internalizan los péptidos extraños, los descomponen y los expresan en complejos mayores de histocompatibilidad de clase II (MHCII), que son proteínas de la superficie celular. Dentro de los órganos linfoides secundarios, la mayoría de las células B ingresarán a los folículos de células B donde se formará un centro germinal. La mayoría de las células B eventualmente se diferenciarán en células plasmáticas o células B de memoria dentro del centro germinal. [3] [6] Los T FH que expresan receptores de células T (TCR) afines al péptido (es decir , específicos para el complejo péptido-MHCII) en el borde del folículo de células B y la zona de células T se unirán al MHCII ligando. Luego, las células T expresarán la molécula del ligando CD40 (CD40L) y comenzarán a secretar citocinas que hacen que las células B proliferen y experimenten una recombinación de cambio de clase , una mutación en la codificación genética de las células B que cambia su tipo de inmunoglobulina . [7] [8] El cambio de clase permite que las células B de memoria secreten diferentes tipos de anticuerpos en futuras respuestas inmunes. [3] Las células B luego se diferencian en células plasmáticas , células B del centro germinal o células B de memoria dependiendo de los factores de transcripción expresados . Las células B activadas que expresaron el factor de transcripción Bcl-6 ingresarán a los folículos de las células B y sufrirán reacciones en el centro germinal. [7]
Una vez dentro del centro germinal, las células B experimentan una proliferación, seguida de una mutación de la región codificante genética de su BCR , un proceso conocido como hipermutación somática . [3] Las mutaciones aumentarán o disminuirán la afinidad del receptor de superficie por un antígeno en particular, una progresión llamada maduración de la afinidad . Después de adquirir estas mutaciones, los receptores en la superficie de las células B (receptores de células B) se prueban dentro del centro germinal para determinar su afinidad con el antígeno actual. [9] Los clones de células B con mutaciones que han aumentado la afinidad de sus receptores de superficie reciben señales de supervivencia a través de interacciones con sus células T FH afines . [2] [3] [10] Las células B que no tienen una afinidad lo suficientemente alta para recibir estas señales de supervivencia, así como las células B que son potencialmente autorreactivas, serán seleccionadas y morirán por apoptosis. [6] Estos procesos aumentan la variabilidad en los sitios de unión al antígeno, de modo que cada célula B recién generada tiene un receptor único. [11]
Después de la diferenciación, las células B de memoria se trasladan a la periferia del cuerpo, donde será más probable que encuentren antígenos en caso de una exposición futura. [6] [2] [3] Muchas de las células B circulantes se concentran en áreas del cuerpo que tienen una alta probabilidad de entrar en contacto con el antígeno, como la placa de Peyer .
El proceso de diferenciación en células B de memoria dentro del centro germinal aún no se comprende completamente. [3] Algunos investigadores plantean la hipótesis de que la diferenciación en células B de memoria se produce de forma aleatoria. [6] [4] Otras hipótesis proponen que el factor de transcripción NF-κB y la citoquina IL-24 están involucrados en el proceso de diferenciación en células B de memoria. [11] [3] Una hipótesis adicional establece que las células B con afinidad relativamente menor por el antígeno se convertirán en células B de memoria, en contraste con las células B con afinidad relativamente mayor que se convertirán en células plasmáticas.
No todas las células B presentes en el organismo han sufrido hipermutaciones somáticas. Las células B de memoria IgM+ que no se han sometido a recombinación de cambio de clase demuestran que las células B de memoria se pueden producir independientemente de los centros germinales.
Tras la infección con un patógeno, muchas células B se diferenciarán en células plasmáticas , también llamadas células B efectoras, que producen una primera ola de anticuerpos protectores y ayudan a eliminar la infección. [6] [2] Las células plasmáticas secretan anticuerpos específicos para los patógenos, pero no pueden responder a la exposición secundaria. Una fracción de las células B con BCR afines al antígeno se diferencian en células B de memoria que sobreviven a largo plazo en el cuerpo. [12] Las células B de memoria pueden mantener su expresión de BCR y podrán responder rápidamente ante una exposición secundaria. [6]
Las células B de memoria producidas durante la respuesta inmune primaria son específicas del antígeno involucrado durante la primera exposición. En una respuesta secundaria, responderán las células B de memoria específicas del antígeno o antígenos similares. [3] Cuando las células B de memoria se reencuentran con su antígeno específico, proliferan y se diferencian en células plasmáticas, que luego responden y eliminan el antígeno. [3] Las células B de memoria que no se diferencian en células plasmáticas en este punto pueden volver a ingresar a los centros germinales para sufrir un mayor cambio de clase o hipermutación somática para una mayor maduración de la afinidad. [3] La diferenciación de las células B de memoria en células plasmáticas es mucho más rápida que la diferenciación mediante células B vírgenes, lo que permite que las células B de memoria produzcan una respuesta inmune secundaria más eficiente. [4] La eficiencia y acumulación de la respuesta de las células B de memoria es la base de las vacunas y las inyecciones de refuerzo. [4] [3]
El fenotipo de las células de memoria que pronostican el destino de las células plasmáticas o de las células del centro germinal se descubrió hace unos años. Con base en comparaciones de microarrays de expresión entre células B de memoria y células B vírgenes, se identificó que existen varias proteínas de superficie, como CD80 , PD-L2 y CD73, que solo se expresan en las células B de memoria, por lo que también sirven para dividirlas. células en múltiples subconjuntos fenotípicos. [13] Además, se ha demostrado que las células de memoria que expresan CD80, PD-L2 y CD73 tienen más probabilidades de convertirse en células plasmáticas. Por otro lado, las células que no tienen este tipo de marcadores tienen más probabilidades de formar células del centro germinal. Las células B de memoria IgM + no expresan CD80 ni CD73, mientras que las IgG + sí las expresan. Además, es más probable que las IgG + se diferencien en células secretoras de anticuerpos. [14]
Las células B de memoria pueden sobrevivir durante décadas, lo que les da la capacidad de responder a múltiples exposiciones al mismo antígeno. [3] Se supone que la supervivencia duradera es el resultado de ciertos genes antiapoptosis que se expresan más en las células B de memoria que en otros subconjuntos de células B. [6] Además, las células B de memoria no necesitan tener una interacción continua con el antígeno ni con las células T para sobrevivir a largo plazo. [4]
Sin embargo, es cierto que la vida útil de las células B de memoria individuales sigue estando mal definida, aunque desempeñan un papel fundamental en la inmunidad a largo plazo. En un estudio que utilizó un sistema transgénico de receptor de células B (BCR) (era un modelo de ratón transgénico de cadena H que carecía de Ig secretada, por lo que no depositaba complejos inmunes que contenían Ag), se demostró que el número de células B de memoria permanecen constantes durante un período de aproximadamente 8 a 20 semanas después de la inmunización. También se estimó que la vida media de las células B de memoria era de entre 8 y 10 semanas, luego de realizar un experimento en el que las células fueron tratadas in vivo con bromodesoxiuridina . [15] En otros experimentos con ratones, se ha demostrado que la vida útil de las células B de memoria es al menos 9 veces mayor que la vida útil de una célula B folicular ingenua. [dieciséis]
Las células B de memoria normalmente se distinguen por el marcador de superficie celular CD27, aunque algunos subconjuntos no expresan CD27. Las células B de memoria que carecen de CD27 generalmente se asocian con células B agotadas o ciertas afecciones autoinmunes como el VIH, el lupus o la artritis reumatoide. [2] [3]
Debido a que las células B normalmente han sufrido un cambio de clase, pueden expresar una variedad de moléculas de inmunoglobulina . A continuación se describen algunos atributos específicos de moléculas de inmunoglobulina particulares:
Es importante mencionar la importancia de la integración de vías de señalización relacionadas con los receptores de BCR y TLR para modular la producción de anticuerpos mediante la expansión de las células B de memoria. Por tanto, existen diferentes factores que aportan la información para secretar diferentes tipos de anticuerpos. Se ha demostrado que la producción de IgG1 específica, IgG1 anafiláctica e IgE total depende de la señal producida por TLR2 y Myd88 . Además, la señal que produce el TLR4 cuando es estimulado por las natterinas (proteína obtenida del veneno del pez T. nattereri ) acelera la síntesis del anticuerpo IgE actuando como adyuvante, como se demostró en un experimento in vivo con ratones. [17]
El receptor CCR6 es generalmente un marcador de células B que eventualmente se diferenciarán en MBC. Este receptor detecta quimiocinas , que son mensajeros químicos que permiten que las células B se muevan dentro del cuerpo. Las células B de memoria pueden tener este receptor que les permita salir del centro germinal hacia los tejidos donde tienen una mayor probabilidad de encontrar antígenos. [6]
Se ha demostrado que las células B de memoria tienen un alto nivel de expresión de CCR6, así como una mayor respuesta quimiotáctica al ligando CCR6 ( CCL20 ) en comparación con las células B vírgenes. Sin embargo, la respuesta humoral primaria y el mantenimiento de las células B de memoria no se ven afectados en ratones con deficiencia de CCR6. Sin embargo, no existe una respuesta secundaria eficaz de las células B de memoria cuando hay una reexposición del antígeno si las células no expresan CCR6. Por lo tanto, podemos confirmar que CCR6 es esencial para la capacidad de las células B de memoria de recuperar su antígeno afín, así como para el posicionamiento anatómico apropiado de estas células. [18]
Este subconjunto de células se diferencia de las células B activadas en células B de memoria antes de ingresar al centro germinal. Las células B que tienen un alto nivel de interacción con T FH dentro del folículo de células B tienen una mayor propensión a ingresar al centro germinal. Las células B que se convierten en células B de memoria independientemente de los centros germinales probablemente experimenten señalización de CD40 y citocinas de las células T. [4] El cambio de clase aún puede ocurrir antes de la interacción con el centro germinal, mientras que la hipermutación somática solo ocurre después de la interacción con el centro germinal. [4] Se supone que la falta de hipermutación somática es beneficiosa; un nivel más bajo de maduración de afinidad significa que estas células B de memoria están menos especializadas en un antígeno específico y pueden reconocer una gama más amplia de antígenos. [11] [19] [4]
Células B de memoria independientes T
Las células B de memoria independientes de T son un subconjunto llamado células B1. Estas células generalmente residen en la cavidad peritoneal. Cuando se reintroducen en el antígeno, algunas de estas células B1 pueden diferenciarse en células B de memoria sin interactuar con una célula T. [4] Estas células B producen anticuerpos IgM para ayudar a eliminar la infección. [20]
Células B de memoria T-bet
Las células T-bet B son un subconjunto que se ha descubierto que expresan el factor de transcripción T-bet. La apuesta T está asociada con el cambio de clase. También se cree que las células T-bet B son importantes en las respuestas inmunitarias contra infecciones bacterianas y virales intracelulares. [21]
Las vacunas se basan en la noción de memoria inmunológica . La inyección preventiva de un antígeno no patógeno en el organismo permite al organismo generar una memoria inmunológica duradera . La inyección del antígeno provoca una respuesta de anticuerpos seguida de la producción de células B de memoria. Estas células B de memoria se reactivan rápidamente tras la infección con el antígeno y pueden proteger eficazmente al organismo contra enfermedades. [22]
Las células plasmáticas de larga vida y las células B de memoria son responsables de la inmunidad humoral a largo plazo provocada por la mayoría de las vacunas. Se ha realizado un experimento para observar la longevidad de las células B de memoria tras la vacunación, en este caso con la vacuna antivariólica (DryVax), que fue seleccionada debido a que la viruela estaba erradicada, por lo que la memoria inmune a la viruela es una herramienta útil. punto de referencia para comprender la longevidad de las células B de memoria inmune en ausencia de reestimulación. El estudio concluyó que las células B de memoria específicas se mantienen durante décadas, lo que indica que la memoria inmunológica dura mucho tiempo en el compartimento de las células B después de una fuerte exposición inicial al antígeno. [23]