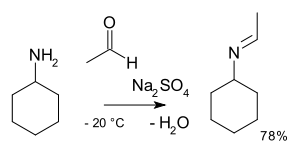
En química orgánica , la alquilimino-desoxo-bisustitución es la reacción orgánica de compuestos carbonílicos con aminas a iminas . [2] El nombre de la reacción se basa en la Nomenclatura de Transformaciones de la IUPAC . La reacción está catalizada por ácido y el tipo de reacción es la adición nucleofílica de la amina al compuesto carbonílico seguida de la transferencia de un protón del nitrógeno al oxígeno a una hemiaminal o carbinolamina estable. Con las aminas primarias, el agua se pierde en una reacción de eliminación a una imina . Con arilaminas se forman bases de Schiff especialmente estables .
Las etapas de reacción son reacciones reversibles y la reacción se completa mediante la eliminación del agua, por ejemplo mediante destilación azeotrópica , tamices moleculares o tetracloruro de titanio . Las aminas primarias reaccionan a través de un intermedio hemiaminal inestable que luego separa el agua.
Las aminas secundarias no pierden agua fácilmente porque no tienen un protón disponible y, en cambio, a menudo reaccionan más con un aminal :
o cuando un protón α-carbonilo está presente en una enamina :
En ambiente ácido el producto de la reacción es una sal de iminio por pérdida de agua.
Este tipo de reacción se encuentra en muchas preparaciones de heterociclos, por ejemplo, la reacción de Povarov y la síntesis de Friedländer a quinolinas .
Los compuestos que contienen una amina primaria o secundaria y un grupo funcional carbonilo suelen ser lábiles. Esta directriz se aplica a aminoaldehídos, aminocetonas y aminoésteres; de hecho, una molécula no puede transportar simultáneamente ( sin protección ) grupos aldehído y amina. La aminoacetona , la aminocetona más simple, no se puede aislar como líquido o sólido, [3] y el 2-aminobenzaldehído se oligomeriza en solución o en estado fundido. [4] Una α- formil aziridina , reducida con DIBAL del éster , se dimeriza reversiblemente [Nota 1] a [Nota 2] una oxazolidina : [5]

Las hidracinas y las hidroxilaminas desplazan los oxígenos del carbonilo mucho más fácilmente que las aminas. Sus equilibrios favorecen fuertemente al producto deshidratado y el carbonilo se recupera sólo con dificultad. [6]