El antígeno tumoral grande (también llamado antígeno T grande y abreviado LTag o LT ) es una proteína codificada en los genomas de los poliomavirus , que son pequeños virus de ADN bicatenario . LTag se expresa temprano en el ciclo infeccioso y es esencial para la proliferación viral. Con cuatro dominios proteicos bien conservados , así como varias regiones intrínsecamente desordenadas , LTag es una proteína multifuncional bastante grande; en la mayoría de los poliomavirus, tiene una longitud de alrededor de 600 a 800 aminoácidos . LTag tiene dos funciones principales, ambas relacionadas con la replicación del genoma viral : desenrolla el ADN del virus para prepararlo para la replicación e interactúa con las proteínas en la célula huésped para desregular el ciclo celular de modo que la maquinaria de replicación del ADN del huésped pueda usarse para replicar el genoma del virus. Algunas proteínas LTag del poliomavirus (en particular el antígeno tumoral grande SV40, muy estudiado ) son oncoproteínas que pueden inducir la transformación neoplásica en la célula huésped. [2] [3]
Las proteínas LTag de los poliomavirus contienen cuatro dominios proteicos globulares bien conservados : desde el extremo N al C , estos son el dominio J, el dominio de unión al origen (OBD), el dominio de unión al zinc y el dominio AAA+ ATPasa . Los dominios están unidos por regiones intrínsecamente desordenadas , que a menudo son funcionalmente importantes y cuya longitud varía entre los poliomavirus; tanto los dominios globulares plegados como las regiones desordenadas forman interacciones proteína-proteína con varias proteínas de la célula huésped. Algunos homólogos de LTag también tienen una cola C-terminal desordenada llamada dominio de rango de huésped, que puede fosforilarse y en algunas cepas es esencial, aunque el mecanismo molecular de su esencialidad no está claro. [3]
En algunos poliomavirus, se producen variantes truncadas de la proteína LTag mediante un empalme alternativo que no incluye los componentes de la helicasa (unión al cinc y ATPasa). Estas LTags truncadas conservan su capacidad de interactuar con algunas proteínas reguladoras del ciclo celular y participan en la transformación celular, pero no en la replicación del genoma viral. [2] [4]
El dominio J es una chaperona molecular de DnaJ que se requiere para la replicación del genoma viral in vivo (pero es prescindible en experimentos de laboratorio sin células). El dominio J interactúa con las proteínas de choque térmico Hsc70 . En muchos LTags de poliomavirus, el extremo N-terminal del dominio J es un motivo de secuencia que media la unión de LTag a la proteína de retinoblastoma de la célula huésped , un determinante clave de la progresión del ciclo celular . Esta región de enlace no estructurada también contiene una secuencia de localización nuclear , que activa la célula huésped para transportar la proteína desde el citoplasma donde se traduce al núcleo donde realiza sus funciones relacionadas con la replicación. [3]
El OBD se une al origen de replicación del genoma viral al reconocer secuencias específicas que se encuentran en la porción del genoma viral conocida como región de control no codificante . También forma interacciones con proteínas de la célula huésped, como la proteína de replicación A y Nbs1 . El OBD es necesario para la replicación viral. [3]
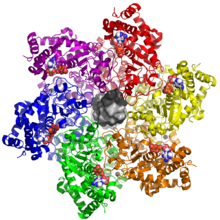
Los dominios de unión al zinc y de ATPasa juntos forman la porción helicasa de la proteína LTag. La función principal del dominio de unión al zinc es la oligomerización de LTag. La formación de estructuras dodecámeras (dos anillos hexaméricos ) es necesaria para la actividad helicasa , que comienza en el origen de la replicación a través de la coordinación entre los dominios OBD, de unión al zinc y de ATPasa. [2] [3]

El dominio ATPasa es un miembro de la familia AAA+ ATPasa y contiene motivos conservados como la caja Walker A de unión a ATP . La energía de la hidrólisis de ATP es necesaria para la actividad de la helicasa . El dominio ATPasa también contiene regiones responsables de las interacciones proteína-proteína con las proteínas de la célula huésped, en particular la topoisomerasa 1 y el regulador del ciclo celular p53 . LTag es única entre las ATPasas AAA+ conocidas en el sentido de que es capaz de iniciar la fusión del ADN alrededor del origen; en la mayoría de estos casos, una proteína iniciadora distinta es responsable de este paso, después del cual la helicasa continúa desenrollándose. [2] [3]
Las principales funciones de LTag en el ciclo de vida viral implican la desregulación del ciclo celular de la célula huésped y la replicación del genoma de ADN circular del virus. Debido a que la replicación del genoma del poliomavirus depende de la maquinaria de replicación del ADN de la célula huésped, la célula debe estar en fase S (la parte del ciclo celular en la que normalmente se replica el genoma de la célula huésped) para proporcionar la maquinaria molecular necesaria para la replicación del ADN viral. El LTag SV40 puede inducir la fase S y activar la respuesta de la célula huésped al daño del ADN. [3] Las acciones coordinadas de las regiones OBD y helicasa dan como resultado la manipulación física del genoma viral, derritiendo la doble hélice de ADN en el origen de la replicación y desenrollando el cromosoma de ADN circular de manera bidireccional. [2] [3] La estructura y función de LTag se asemeja a la de las oncoproteínas del virus del papiloma humano . [2]

El gen LTag está codificado en la "región temprana" del genoma del poliomavirus, llamada así porque esta región del genoma se expresa temprano en el proceso infeccioso. (La "región tardía" contiene genes que codifican las proteínas de la cápside viral ). La región temprana contiene típicamente al menos dos genes y se transcribe como un ARN mensajero único procesado por empalme alternativo . El gen LTag generalmente está codificado en dos exones , de los cuales el primero se superpone con el gen para el antígeno tumoral pequeño (STag); como resultado, las dos proteínas comparten una secuencia N-terminal de alrededor de 80 residuos, mientras que los ~90 residuos restantes de STag no se comparten. [4] [7] En algunos poliomavirus, más notablemente el poliomavirus murino , el primer miembro de la familia descubierto y un oncovirus eficiente , una proteína adicional llamada antígeno tumoral medio se expresa desde la región temprana y es altamente eficiente en la transformación celular. [8]
Algunos poliomavirus, pero no todos, son oncovirus capaces de inducir transformación neoplásica en algunas células. En los poliomavirus oncogénicos, los antígenos tumorales son responsables de la actividad de transformación, aunque los mecanismos moleculares exactos varían de un virus a otro. [3] [2] [9]
El antígeno T grande SV40 del virus SV40 es el miembro mejor estudiado de la familia LTag. SV40, también conocido como poliomavirus 1 de Macaca mulatta , infecta de forma nativa a los monos y no causa enfermedad; sin embargo, es oncogénico en algunos roedores y puede inmortalizar algunas células humanas en cultivos celulares primarios . SV40 tiene tres proteínas tempranas , el antígeno tumoral grande, el antígeno tumoral pequeño y una proteína pequeña llamada 17kT que comparte la mayor parte de su secuencia con el extremo N de LTag. De estas, LTag es principalmente responsable de la transformación celular. STag por sí solo no puede transformar células, pero mejora la eficiencia con la que LTag realiza esta función. El efecto transformador de LTag puede atribuirse en gran medida a su capacidad para unirse a la proteína del retinoblastoma (Rb) y a la proteína supresora de tumores p53 ; la anulación de cualquiera de los sitios de unión hace que LTag sea incapaz de transformar células cultivadas primarias. [10] De hecho, p53, ahora establecido como un factor clave en la carcinogénesis, fue descubierto originalmente por su capacidad para unirse a LTag. [10] [11] [12]
El poliomavirus murino (MPyV), descrito en la década de 1950, fue el primer poliomavirus descubierto y puede causar tumores en roedores. El MPyV tiene tres proteínas tempranas; además de LTag y STag, también expresa el antígeno tumoral medio , que es el principal responsable de la actividad transformadora del virus. [10]
El poliomavirus de células de Merkel (MCPyV), también conocido como poliomavirus humano 5 , infecta naturalmente a los humanos y está asociado con el carcinoma de células de Merkel (MCC), una forma rara de cáncer de piel que se origina en las células de Merkel . Aunque la infección por MCPyV es común y generalmente asintomática, una gran mayoría de los tumores de MCC poseen una copia genómicamente integrada del genoma del poliomavirus. [9] [13] MCPyV posee cuatro proteínas tempranas, incluida una isoforma de empalme alternativo de 57kT y una proteína alternativa llamada ALTO. En el poliomavirus de células de Merkel, a diferencia de SV40, LTag por sí solo no admite una replicación viral eficiente y se requiere STag. La comparación de las secuencias de LTag de MCPyV y SV40 predice que tienen capacidades similares para las interacciones proteína-proteína , incluida la preservación de los sitios de unión de Rb y p53. [9] Las mutaciones en MCPyV LTag asociadas con tumores consisten en grandes truncamientos C-terminales que eliminan las funciones de replicación del ADN de la proteína al eliminar los dominios de unión de zinc y ATPasa/helicasa, sin afectar estos sitios de interacción proteína-proteína. [14] [15]
LTag es una proteína grande cuyos dominios pueden detectarse y anotarse bioinformáticamente . Como resultado, se utiliza a menudo para comparar y determinar relaciones entre poliomavirus. El Comité Internacional de Taxonomía de Virus clasifica actualmente a los poliomavirus principalmente de acuerdo con la identidad de secuencia de sus genes LTag. [16] Este sistema ha sido cuestionado por estudios filogenéticos que sugieren que las historias evolutivas de LTag y la proteína principal de la cápside VP1 son divergentes y que algunos poliomavirus modernos representan linajes quiméricos . [17]