Un frotis de sangre , frotis de sangre periférica o extensión de sangre es una capa fina de sangre que se extiende sobre un portaobjetos de vidrio para microscopio y que luego se tiñe de tal manera que permite examinar las distintas células sanguíneas al microscopio. Los frotis de sangre se examinan en la investigación de trastornos hematológicos (de la sangre) y se emplean de manera rutinaria para buscar parásitos sanguíneos , como los de la malaria y la filariasis .
Para realizar un frotis de sangre, se coloca una gota de sangre en un extremo de un portaobjetos y se utiliza un esparcidor de portaobjetos para esparcir la sangre a lo largo del mismo. El objetivo es obtener una región, llamada monocapa, donde las células estén lo suficientemente espaciadas como para poder contarlas y diferenciarlas. La monocapa se encuentra en el "borde emplumado" creado por el esparcidor de portaobjetos a medida que arrastra la sangre hacia adelante. [ cita requerida ]
Se deja secar al aire el portaobjetos, después de lo cual se fija la sangre al portaobjetos sumergiéndolo brevemente en metanol . El fijador es esencial para una buena tinción y presentación de los detalles celulares. Después de la fijación, se tiñe el portaobjetos para distinguir las células entre sí. [ cita requerida ]
El análisis de sangre de rutina en los laboratorios médicos se realiza generalmente en frotis de sangre teñidos con tinciones de Romanowsky, como la tinción de Wright , la tinción de Giemsa o Diff-Quik . La tinción combinada de Wright-Giemsa también es una opción popular. Estas tinciones permiten la detección de anomalías en los glóbulos blancos , los glóbulos rojos y las plaquetas . Los hematopatólogos suelen utilizar otras tinciones especializadas para ayudar en el diagnóstico diferencial de los trastornos sanguíneos. [ cita requerida ]
Después de la tinción, la monocapa se observa bajo un microscopio con un aumento de hasta 1000x. Se examinan células individuales y se caracteriza y registra su morfología. [1] [2]

El examen de frotis de sangre generalmente se realiza junto con un hemograma completo para investigar resultados anormales o confirmar resultados que el analizador automático ha marcado como no confiables. [3]
El examen microscópico de la forma, el tamaño y la coloración de los glóbulos rojos es útil para determinar la causa de la anemia . Trastornos como la anemia ferropénica , la anemia de células falciformes , la anemia megaloblástica y la anemia hemolítica microangiopática producen anomalías características en el frotis sanguíneo. [2]
Las proporciones de diferentes tipos de glóbulos blancos se pueden determinar a partir del frotis de sangre. Esto se conoce como diferencial manual de glóbulos blancos . El diferencial de glóbulos blancos puede revelar anomalías en las proporciones de los tipos de glóbulos blancos, como neutrofilia y eosinofilia , así como la presencia de células anormales como los blastos circulantes que se ven en la leucemia aguda . [4] Las anomalías cualitativas de los glóbulos blancos, como la granulación tóxica , también son visibles en el frotis de sangre. Los analizadores de hemograma completo modernos pueden proporcionar un diferencial de glóbulos blancos automatizado, pero tienen una capacidad limitada para diferenciar células inmaduras y anormales, por lo que el examen manual del frotis de sangre está indicado con frecuencia. [5] [6]
El examen del frotis de sangre es el método de diagnóstico preferido para ciertas infecciones parasitarias, como la malaria y la babesiosis . [7] En raras ocasiones, las bacterias pueden ser visibles en el frotis de sangre en pacientes con sepsis grave . [8]
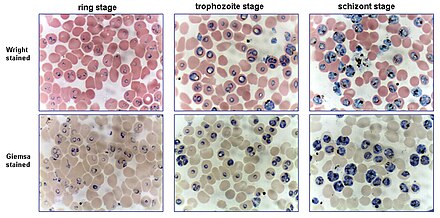
El diagnóstico preferido y más fiable de la malaria es el examen microscópico de frotis de sangre, porque cada una de las cuatro especies principales de parásitos tiene características distintivas. Tradicionalmente se utilizan dos tipos de frotis de sangre. [9]
A partir de la muestra espesa, un microscopista experimentado puede detectar todos los parásitos que encuentre. El diagnóstico microscópico puede ser difícil porque los trofozoítos tempranos ("forma de anillo") de las cuatro especies parecen idénticos y nunca es posible diagnosticar las especies basándose en una sola forma de anillo; la identificación de las especies siempre se basa en varios trofozoítos. [ cita requerida ]
El mayor escollo en la mayoría de los laboratorios de los países desarrollados es dejar pasar demasiado tiempo entre la toma de la muestra de sangre y la realización de los frotis. A medida que la sangre se enfría a temperatura ambiente, los gametocitos masculinos se dividen y liberan microgametos : se trata de estructuras filamentosas largas y sinuosas que pueden confundirse con organismos como Borrelia . Si la sangre se mantiene a temperaturas más cálidas, los esquizontes se rompen y los merozoitos que invaden los eritrocitos dan por error la apariencia de la forma accolé de P. falciparum . Si P. vivax o P. ovale se deja durante varias horas en EDTA, la acumulación de ácido en la muestra hará que los eritrocitos parasitados se encojan y el parásito se enrolle, simulando la apariencia de P. malariae . Este problema se agrava si se utilizan anticoagulantes como la heparina o el citrato . El anticoagulante que causa menos problemas es el EDTA . Se suele utilizar la tinción de Romanowsky o una variante de la misma. Algunos laboratorios utilizan por error el mismo pH de tinción que utilizan para los frotis de sangre de rutina para hematología ( pH 6,8): los frotis de sangre para malaria deben teñirse a un pH de 7,2, o no se verán los puntos de Schüffner ni los puntos de James . [ cita requerida ]
Los procedimientos de captura inmunocromatográfica (pruebas de diagnóstico rápido como las pruebas de detección de antígenos de malaria ) son opciones de diagnóstico no microscópicas para el laboratorio que puede no tener disponible la experiencia microscópica adecuada. [11]