La química del equilibrio se ocupa de los sistemas en equilibrio químico . El principio unificador es que la energía libre de un sistema en equilibrio es la mínima posible, de modo que la pendiente de la energía libre con respecto a la coordenada de reacción es cero. [1] [2] Este principio, aplicado a mezclas en equilibrio, proporciona una definición de una constante de equilibrio . Las aplicaciones incluyen equilibrios ácido-base , anfitrión-huésped , metal-complejo , solubilidad , partición , cromatografía y equilibrios redox .
Se dice que un sistema químico está en equilibrio cuando las cantidades de las entidades químicas involucradas no cambian ni pueden cambiar en el tiempo sin la aplicación de una influencia externa. En este sentido, un sistema en equilibrio químico está en un estado estable . El sistema en equilibrio químico estará a una temperatura, presión o volumen constantes y una composición. Estará aislado del intercambio de calor con el entorno, es decir, es un sistema cerrado . Un cambio de temperatura, presión (o volumen) constituye una influencia externa y las cantidades de equilibrio cambiarán como resultado de dicho cambio. Si existe la posibilidad de que la composición pueda cambiar, pero la tasa de cambio es insignificantemente lenta, se dice que el sistema está en un estado metaestable . La ecuación de equilibrio químico puede expresarse simbólicamente como
El signo ⇌ significa "están en equilibrio con". Esta definición se refiere a propiedades macroscópicas . Los cambios ocurren a nivel microscópico de átomos y moléculas, pero en una medida tan minúscula que no se pueden medir y de una manera equilibrada, de modo que las cantidades macroscópicas no cambian. El equilibrio químico es un estado dinámico en el que las reacciones hacia adelante y hacia atrás se producen a velocidades tales que la composición macroscópica de la mezcla es constante. Por lo tanto, el signo de equilibrio ⇌ simboliza el hecho de que las reacciones ocurren tanto en dirección hacia adelante como hacia atrás .
Por otra parte, un estado estable no es necesariamente un estado de equilibrio en el sentido químico. Por ejemplo, en una cadena de desintegración radiactiva , las concentraciones de isótopos intermedios son constantes porque la tasa de producción es igual a la tasa de desintegración. No es un equilibrio químico porque el proceso de desintegración ocurre en una sola dirección.
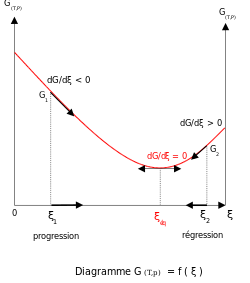
El equilibrio termodinámico se caracteriza por que la energía libre de todo el sistema (cerrado) es mínima. Para sistemas a volumen constante, la energía libre de Helmholtz es mínima y para sistemas a presión constante, la energía libre de Gibbs es mínima. [3] Por lo tanto, un estado metaestable es aquel en el que el cambio de energía libre entre reactivos y productos no es mínimo, aunque la composición no cambie con el tiempo. [4]
La existencia de este mínimo se debe a que la energía libre de mezcla de reactivos y productos es siempre negativa. [5] Para soluciones ideales la entalpía de mezcla es cero, por lo que el mínimo existe porque la entropía de mezcla es siempre positiva. [6] [7] La pendiente de la energía libre de reacción, δ G r con respecto a la coordenada de reacción , ξ , es cero cuando la energía libre está en su valor mínimo.
El potencial químico es la energía libre molar parcial. El potencial, μ i , de la i ésima especie en una reacción química es la derivada parcial de la energía libre con respecto al número de moles de esa especie, N i :
Un equilibrio químico general se puede escribir como [nota 1]
n j son los coeficientes estequiométricos de los reactivos en la ecuación de equilibrio y m j son los coeficientes de los productos. El valor de δ G r para estas reacciones es una función de los potenciales químicos de todas las especies.
El potencial químico, μ i , de la i ésima especie se puede calcular en términos de su actividad , a i .
micraso
yoes el potencial químico estándar de la especie, R es la constante de los gases y T es la temperatura. Fijando la suma de los reactivos j igual a la suma de los productos, k , de modo que δ G r (Eq) = 0:
Reordenando los términos,
Esto relaciona el cambio de energía libre de Gibbs estándar , Δ G o , con una constante de equilibrio , K , el cociente de reacción de los valores de actividad en el equilibrio.
De ello se deduce que cualquier equilibrio de este tipo puede caracterizarse ya sea por el cambio de energía libre estándar o por la constante de equilibrio. En la práctica, las concentraciones son más útiles que las actividades. Las actividades pueden calcularse a partir de las concentraciones si se conocen los coeficientes de actividad , pero esto rara vez ocurre. A veces, los coeficientes de actividad pueden calcularse utilizando, por ejemplo, las ecuaciones de Pitzer o la teoría de interacción iónica específica . De lo contrario, las condiciones deben ajustarse de modo que los coeficientes de actividad no varíen mucho. Para las soluciones iónicas, esto se logra utilizando un medio iónico de fondo a una concentración alta en relación con las concentraciones de las especies en equilibrio.
Si se desconocen los coeficientes de actividad, se pueden incluir en la constante de equilibrio, que se convierte en un cociente de concentración. [8] Se supone que cada actividad a i es el producto de una concentración, [A i ], y un coeficiente de actividad, γ i :
Esta expresión para la actividad se coloca en la expresión que define la constante de equilibrio. [9]
Al fijar el cociente de coeficientes de actividad, Γ , igual a uno, [nota 2] la constante de equilibrio se define como un cociente de concentraciones.
En una notación más familiar, para un equilibrio general
Esta definición es mucho más práctica, pero una constante de equilibrio definida en términos de concentraciones depende de las condiciones. En particular, las constantes de equilibrio para especies en solución acuosa dependen de la fuerza iónica , ya que el cociente de coeficientes de actividad varía con la fuerza iónica de la solución.
Los valores del cambio de energía libre estándar y de la constante de equilibrio dependen de la temperatura. Como primera aproximación, se puede utilizar la ecuación de van 't Hoff .
Esto demuestra que cuando la reacción es exotérmica (Δ H o , el cambio de entalpía estándar , es negativo), entonces K disminuye con el aumento de la temperatura, de acuerdo con el principio de Le Châtelier . La aproximación implicada es que el cambio de entalpía estándar, Δ H o , es independiente de la temperatura, lo que es una buena aproximación solo en un pequeño rango de temperaturas. Se pueden utilizar argumentos termodinámicos para demostrar que
donde C p es la capacidad calorífica a presión constante. [10]
Cuando se trata de gases, se utiliza la fugacidad , f , en lugar de la actividad. Sin embargo, mientras que la actividad es adimensional , la fugacidad tiene la dimensión de la presión . Una consecuencia es que el potencial químico debe definirse en términos de una presión estándar, p o : [11]
Por convención, p o suele tomarse como 1 bar . La fugacidad se puede expresar como el producto de la presión parcial , p , y un coeficiente de fugacidad, Φ :
Los coeficientes de fugacidad son adimensionales y pueden obtenerse experimentalmente a una temperatura y presión específicas, a partir de mediciones de desviaciones del comportamiento de un gas ideal . Las constantes de equilibrio se definen en términos de fugacidad. Si los gases están a una presión suficientemente baja como para comportarse como gases ideales, la constante de equilibrio puede definirse como un cociente de presiones parciales.
Un ejemplo de equilibrio en fase gaseosa lo proporciona el proceso Haber-Bosch de síntesis de amoníaco .
Esta reacción es fuertemente exotérmica , por lo que la constante de equilibrio disminuye con la temperatura. Sin embargo, se requiere una temperatura de alrededor de 400 °C para lograr una velocidad de reacción razonable con los catalizadores disponibles actualmente . La formación de amoniaco también se ve favorecida por la alta presión, ya que el volumen disminuye cuando tiene lugar la reacción. La misma reacción, la fijación de nitrógeno , ocurre a temperatura ambiente en la naturaleza, cuando el catalizador es una enzima como la nitrogenasa . Inicialmente se necesita mucha energía para romper el triple enlace nitrógeno-nitrógeno, aunque la reacción general es exotérmica.
Los equilibrios en fase gaseosa ocurren durante la combustión y fueron estudiados ya en 1943 en relación con el desarrollo del motor cohete V2 . [12]
El cálculo de la composición para un equilibrio gaseoso a presión constante se realiza a menudo utilizando valores ΔG, en lugar de constantes de equilibrio. [13] [14]
Pueden existir dos o más equilibrios al mismo tiempo. Cuando esto sucede, se pueden atribuir constantes de equilibrio a equilibrios individuales, pero no siempre son únicas. Por ejemplo, se pueden definir tres constantes de equilibrio para un ácido dibásico , H 2 A. [15] [nota 3]
Las tres constantes no son independientes entre sí y es fácil ver que β 2 = K 1 K 2 . Las constantes K 1 y K 2 son constantes escalonadas y β es un ejemplo de una constante general.

Las concentraciones de especies en equilibrio se calculan habitualmente suponiendo que los coeficientes de actividad son conocidos o pueden ignorarse. En este caso, cada constante de equilibrio para la formación de un complejo en un conjunto de equilibrios múltiples puede definirse de la siguiente manera
Las concentraciones de las especies que contienen el reactivo A están limitadas por una condición de balance de masas , es decir, la concentración total (o analítica), que es la suma de las concentraciones de todas las especies, debe ser constante. Existe una ecuación de balance de masas para cada reactivo del tipo
Existen tantas ecuaciones de balance de masa como reactivos, A, B..., por lo que si se conocen los valores de las constantes de equilibrio, existen n ecuaciones de balance de masa con n incógnitas, [A], [B]..., las denominadas concentraciones de reactivos libres. La solución de estas ecuaciones proporciona toda la información necesaria para calcular las concentraciones de todas las especies. [16]
Así, la importancia de las constantes de equilibrio radica en que, una vez determinados sus valores experimentalmente, pueden utilizarse para calcular las concentraciones, conocidas como especiación , de mezclas que contienen las especies relevantes.
Existen cinco tipos principales de datos experimentales que se utilizan para la determinación de las constantes de equilibrio de la solución. Los datos potenciométricos obtenidos con un electrodo de vidrio son los más utilizados con soluciones acuosas. Los otros son las mediciones espectrofotométricas , de fluorescencia (luminiscencia) y las mediciones de desplazamiento químico por RMN ; [8] [17] la medición simultánea de K y Δ H para aductos 1:1 en sistemas biológicos se lleva a cabo de manera rutinaria utilizando calorimetría de titulación isotérmica .
Los datos experimentales comprenderán un conjunto de puntos de datos. En el i-ésimo punto de datos, las concentraciones analíticas de los reactivos, T A( i ) , T B( i ) etc. serán cantidades conocidas experimentalmente y habrá una o más cantidades medidas, y i , que dependen de alguna manera de las concentraciones analíticas y las constantes de equilibrio. Un procedimiento computacional general tiene tres componentes principales.
Brønsted y Lowry caracterizaron el equilibrio ácido-base como una reacción de intercambio de protones: [18] [19] [20]
Un ácido es un donador de protones; el protón se transfiere a la base, un aceptor de protones, creando un ácido conjugado. Para soluciones acuosas de un ácido HA, la base es agua; la base conjugada es A − y el ácido conjugado es el ion hidrógeno solvatado. En química de soluciones, es habitual utilizar H + como abreviatura para el ion hidrógeno solvatado, independientemente del disolvente. En solución acuosa, H + denota un ion hidronio solvatado . [21] [22] [nota 4]
La definición de Brønsted–Lowry se aplica a otros disolventes, como el dimetilsulfóxido : el disolvente S actúa como una base, aceptando un protón y formando el ácido conjugado SH + . Una definición más amplia de disociación ácida incluye la hidrólisis , en la que se producen protones mediante la división de moléculas de agua. Por ejemplo, el ácido bórico , B(OH)
3, actúa como un ácido débil, aunque no es un donante de protones, debido al equilibrio de hidrólisis.
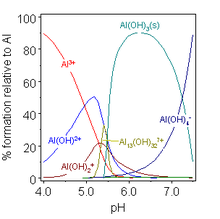
De manera similar, la hidrólisis de iones metálicos provoca iones como [Al(H
2O)
6]3+
comportarse como ácidos débiles: [23]
Los equilibrios ácido-base son importantes en una amplia gama de aplicaciones , como la homeostasis ácido-base , la acidificación de los océanos , la farmacología y la química analítica .
Un complejo huésped-anfitrión, también conocido como complejo donador-aceptor, puede formarse a partir de una base de Lewis , B, y un ácido de Lewis , A. El anfitrión puede ser un donador o un aceptor. En bioquímica, los complejos huésped-anfitrión se conocen como complejos receptor -ligando; se forman principalmente mediante enlaces no covalentes . Muchos complejos huésped-anfitrión tienen una estequiometría 1:1, pero muchos otros tienen estructuras más complejas. El equilibrio general se puede escribir como
El estudio de estos complejos es importante para la química supramolecular [24] [25] y el reconocimiento molecular . El objetivo de estos estudios es a menudo encontrar sistemas con una alta selectividad de unión de un huésped (receptor) para una molécula o ion objetivo particular, el huésped o ligando. Una aplicación es el desarrollo de sensores químicos . [26] Encontrar un fármaco que bloquee un receptor, un antagonista que forma un complejo fuerte con el receptor, o lo active, un agonista , es una vía importante para el descubrimiento de fármacos . [27]
La formación de un complejo entre un ion metálico, M, y un ligando, L, es de hecho una reacción de sustitución. Por ejemplo, en soluciones acuosas , los iones metálicos estarán presentes como iones aquo , por lo que la reacción para la formación del primer complejo podría escribirse como [nota 5]
Sin embargo, como el agua está en gran exceso, la concentración de agua suele suponerse constante y se omite en las expresiones de constantes de equilibrio. A menudo, el metal y el ligando compiten por los protones. [nota 4] Para la constante de equilibrio
Una constante de estabilidad se puede definir de la siguiente manera: [28] [29]
La definición se puede ampliar fácilmente para incluir cualquier número de reactivos. Incluye complejos de hidróxido porque la concentración de iones de hidróxido está relacionada con la concentración de iones de hidrógeno por la autoionización del agua.
Las constantes de estabilidad definidas de esta manera son constantes de asociación . Esto puede generar cierta confusión, ya que los valores p K a son constantes de disociación . En los programas informáticos de uso general, se acostumbra a definir todas las constantes como constantes de asociación. La relación entre los dos tipos de constantes se da en las constantes de asociación y disociación .
En bioquímica , una molécula de oxígeno puede unirse a un átomo de hierro (II) en un grupo prostético hemo en la hemoglobina . El equilibrio se escribe generalmente, denotando la hemoglobina por Hb, como
Pero esta representación es incompleta, ya que el efecto Bohr muestra que las concentraciones de equilibrio dependen del pH. Una mejor representación sería
Esto demuestra que cuando la concentración de iones de hidrógeno aumenta, el equilibrio se desplaza hacia la izquierda de acuerdo con el principio de Le Châtelier . La concentración de iones de hidrógeno puede aumentar en presencia de dióxido de carbono, que se comporta como un ácido débil.
El átomo de hierro también puede unirse a otras moléculas como el monóxido de carbono . El humo del cigarrillo contiene algo de monóxido de carbono, por lo que el equilibrio
Se establece en la sangre de los fumadores de cigarrillos.
La terapia de quelación se basa en el principio de utilizar ligandos quelantes con una alta selectividad de unión para un metal particular para eliminar ese metal del cuerpo humano.
Los complejos con ácidos poliaminocarboxílicos tienen una amplia gama de aplicaciones, siendo especialmente el EDTA el que se utiliza ampliamente.
Un equilibrio de reducción-oxidación ( redox ) se puede manejar exactamente de la misma manera que cualquier otro equilibrio químico. Por ejemplo,
Sin embargo, en el caso de reacciones redox es conveniente dividir la reacción global en dos semirreacciones. En este ejemplo
El cambio de energía libre estándar, que está relacionado con la constante de equilibrio por
se puede dividir en dos componentes,
La concentración de electrones libres es efectivamente cero, ya que los electrones se transfieren directamente del reductor al oxidante. El potencial de electrodo estándar , E 0 para cada semirreacción está relacionado con el cambio de energía libre estándar por [30]
donde n es el número de electrones transferidos y F es la constante de Faraday . Ahora bien, la energía libre para una reacción real está dada por
donde R es la constante de los gases y Q un cociente de reacción . En sentido estricto, Q es un cociente de actividades, pero es una práctica común utilizar concentraciones en lugar de actividades. Por lo tanto:
Para cualquier semirreacción, el potencial redox de una mezcla real viene dado por la expresión generalizada [nota 6]
Este es un ejemplo de la ecuación de Nernst . El potencial se conoce como potencial de reducción. Los potenciales de electrodo estándar están disponibles en una tabla de valores . Con estos valores, se puede calcular el potencial de electrodo real para un par redox como una función de la relación de concentraciones.
El potencial de equilibrio para una semirreacción redox general (ver #Constante de equilibrio arriba para una explicación de los símbolos)
viene dada por [31]
El uso de esta expresión permite el efecto de una especie no involucrada en la reacción redox, como el ion hidrógeno en una semirreacción como
A tener en cuenta.
La constante de equilibrio para una reacción redox completa se puede obtener a partir de los potenciales redox estándar de las semirreacciones constituyentes. En el equilibrio, los potenciales de las dos semirreacciones deben ser iguales entre sí y, por supuesto, el número de electrones intercambiados debe ser el mismo en las dos semirreacciones. [32]
El equilibrio redox desempeña un papel importante en la cadena de transporte de electrones . Los diversos citocromos de la cadena tienen diferentes potenciales redox estándar, cada uno adaptado para una reacción redox específica. Esto permite, por ejemplo, que el oxígeno atmosférico se reduzca en la fotosíntesis . Una familia distinta de citocromos, las citocromo P450 oxidasas , están involucradas en la esteroidogénesis y la desintoxicación .
Cuando un soluto forma una solución saturada en un disolvente , la concentración del soluto, a una temperatura dada, está determinada por la constante de equilibrio a esa temperatura. [33]
La actividad de una sustancia pura en estado sólido es una, por definición, por lo que la expresión se simplifica a
Si el soluto no se disocia, la suma se reemplaza por un solo término, pero si ocurre disociación, como ocurre con las sustancias iónicas
Por ejemplo, con Na 2 SO 4 , m 1 = 2 y m 2 = 1, por lo que el producto de solubilidad se escribe como
Las concentraciones, indicadas por [...], se utilizan generalmente en lugar de las actividades, pero la actividad debe tenerse en cuenta en caso de que exista otra sal sin iones en común, lo que se denomina efecto salino. Cuando hay otra sal presente que tiene un ion en común, entra en juego el efecto del ion común , que reduce la solubilidad del soluto primario. [34]
Cuando una solución de una sustancia en un disolvente se pone en equilibrio con un segundo disolvente que es inmiscible con el primero, la sustancia disuelta puede repartirse entre los dos disolventes. La relación de concentraciones en los dos disolventes se conoce como coeficiente de partición o coeficiente de distribución . [nota 7] El coeficiente de partición se define como la relación de las concentraciones analíticas del soluto en las dos fases. Por convención, el valor se expresa en forma logarítmica.
El coeficiente de partición se define a una temperatura específica y, si corresponde, al pH de la fase acuosa. Los coeficientes de partición son muy importantes en farmacología porque determinan el grado en que una sustancia puede pasar de la sangre (una solución acuosa) a través de una pared celular que es como un disolvente orgánico. Por lo general, se miden utilizando agua y octanol como dos disolventes, lo que produce el llamado coeficiente de partición octanol-agua . Muchos compuestos farmacéuticos son ácidos débiles o bases débiles . Tal compuesto puede existir con un grado diferente de protonación dependiendo del pH y la constante de disociación ácida . Debido a que la fase orgánica tiene una constante dieléctrica baja , las especies sin carga eléctrica serán las más propensas a pasar de la fase acuosa a la fase orgánica. Incluso a pH 7-7,2, el rango de valores de pH biológico, la fase acuosa puede soportar un equilibrio entre más de una forma protonada. El log p se determina a partir de la concentración analítica de la sustancia en la fase acuosa, es decir, la suma de la concentración de las diferentes especies en equilibrio.
La extracción con disolventes se utiliza ampliamente en procesos de separación y purificación. En su forma más simple, se lleva a cabo una reacción en un disolvente orgánico y los subproductos no deseados se eliminan mediante extracción en agua a un pH determinado.
Un ion metálico puede extraerse de una fase acuosa a una fase orgánica en la que la sal no es soluble, añadiendo un ligando . El ligando, L a − , forma un complejo con el ion metálico, M b + , [ML x ] ( b − ax )+ que tiene una superficie exterior fuertemente hidrófoba . Si el complejo no tiene carga eléctrica, se extraerá con relativa facilidad a la fase orgánica. Si el complejo está cargado, se extrae como un par de iones . El ligando adicional no siempre es necesario. Por ejemplo, el nitrato de uranilo , UO 2 (NO 3 ) 2 , es soluble en éter dietílico porque el propio disolvente actúa como ligando. Esta propiedad se utilizó en el pasado para separar el uranio de otros metales cuyas sales no son solubles en éter. Actualmente se prefiere la extracción en queroseno , utilizando un ligando como el fosfato de tri- n -butilo , TBP. En el proceso PUREX , que se utiliza habitualmente en el reprocesamiento nuclear , el uranio (VI) se extrae del ácido nítrico fuerte como el complejo eléctricamente neutro [UO 2 (TBP) 2 (NO 3 ) 2 ]. El ácido nítrico fuerte proporciona una alta concentración de iones nitrato que empuja el equilibrio a favor del complejo nitrato débil. El uranio se recupera por retroextracción (despojo) en ácido nítrico débil. El plutonio (IV) forma un complejo similar, [PuO 2 (TBP) 2 (NO 3 ) 2 ] y el plutonio en este complejo se puede reducir para separarlo del uranio.
Otra aplicación importante de la extracción con disolventes es la separación de los lantánidos . Este proceso también utiliza TBP y los complejos se extraen en queroseno. La separación se logra porque la constante de estabilidad para la formación del complejo TBP aumenta a medida que disminuye el tamaño del ion lantánido.
Un ejemplo de extracción de pares iónicos es el uso de un ligando para permitir la oxidación mediante permanganato de potasio , KMnO 4 , en un disolvente orgánico. El KMnO 4 no es soluble en disolventes orgánicos. Cuando se añade un ligando, como un éter corona , a una solución acuosa de KMnO 4 , forma un complejo hidrófobo con el catión potasio que permite extraer el par iónico no cargado [KL] + [MnO 4 ] − en el disolvente orgánico. Véase también: catálisis por transferencia de fase .
Los problemas de partición más complejos (es decir, 3 o más fases presentes) a veces pueden manejarse con un enfoque de capacidad de fugacidad .
En cromatografía, las sustancias se separan por partición entre una fase estacionaria y una fase móvil. El analito se disuelve en la fase móvil y pasa por la fase estacionaria. La separación se produce debido a las diferentes afinidades de los analitos por la fase estacionaria. Una constante de distribución, K d, se puede definir como
donde a s y a m son las actividades de equilibrio en las fases estacionaria y móvil respectivamente. Se puede demostrar que la tasa de migración, ν , está relacionada con la constante de distribución por
f es un factor que depende de los volúmenes de las dos fases. [35] Por lo tanto, cuanto mayor sea la afinidad del soluto por la fase estacionaria, más lenta será la tasa de migración.
Existe una amplia variedad de técnicas cromatográficas, dependiendo de la naturaleza de las fases estacionaria y móvil. Cuando la fase estacionaria es sólida, el analito puede formar un complejo con ella. Un descalcificador de agua funciona mediante la formación de complejos selectivos con una resina de intercambio iónico de sulfonato . Los iones de sodio forman complejos relativamente débiles con la resina. Cuando el agua dura pasa a través de la resina, los iones divalentes de magnesio y calcio desplazan a los iones de sodio y quedan retenidos en la resina, R.
El agua que sale de la columna es relativamente rica en iones de sodio [nota 8] y pobre en calcio y magnesio, que quedan retenidos en la columna. La columna se regenera haciendo pasar a través de ella una solución concentrada de cloruro de sodio, de modo que se forme nuevamente el complejo resina-sodio en la columna. La cromatografía de intercambio iónico utiliza una resina como Chelex 100 en la que los residuos de iminodiacetato , unidos a una cadena principal de polímero, forman complejos de quelatos de diferentes concentraciones con diferentes iones metálicos, lo que permite separar cromatográficamente iones como Cu 2+ y Ni 2+ .
Otro ejemplo de formación de complejos es la cromatografía quiral , que se utiliza para separar enantiómeros entre sí. La fase estacionaria es quiral y forma complejos de forma selectiva con los enantiómeros. En otros tipos de cromatografía con una fase estacionaria sólida, como la cromatografía de capa fina, el analito se adsorbe de forma selectiva sobre el sólido.
En la cromatografía de gases y líquidos (GLC), la fase estacionaria es un líquido, como el polidimetilsiloxano , recubierto sobre un tubo de vidrio. La separación se logra porque los diversos componentes del gas tienen diferente solubilidad en la fase estacionaria. La GLC se puede utilizar para separar literalmente cientos de componentes en una mezcla de gases, como el humo del cigarrillo o los aceites esenciales , como el aceite de lavanda .