
Toxoplasma gondii ( / ˈ t ɒ k s ə ˌ p l æ z m ə ˈ ɡ ɒ n d i . aɪ , -iː / ) es un protozoo parásito ( específicamente un apicomplejo ) que causa la toxoplasmosis . [3] T. gondii , que se encuentra en todo el mundo,es capaz de infectar prácticamente a todos los animales de sangre caliente , [4] : 1 , pero los félidos son los únicos huéspedes definitivos conocidos en los que el parásito puede experimentar reproducción sexual. [5] [6]
En los roedores , T. gondii altera el comportamiento de manera que aumenta las posibilidades de que los roedores sean presa de los félidos. [7] [8] [9] El apoyo a esta "hipótesis de manipulación" proviene de estudios que muestran que las ratas infectadas con T. gondii tienen una menor aversión a la orina de gato, mientras que la infección en ratones reduce la ansiedad general , aumenta las conductas exploratorias y aumenta la pérdida de Aversión a los depredadores en general. [7] [10] Debido a que los gatos son uno de los únicos huéspedes dentro de los cuales T. gondii puede reproducirse sexualmente, se cree que tales manipulaciones conductuales son adaptaciones evolutivas que aumentan el éxito reproductivo del parásito , ya que los roedores que no evitan las viviendas de los gatos probablemente se convertirán en presa de gato. [7] Los mecanismos principales de los cambios de comportamiento inducidos por T. gondii en roedores ocurren a través de la remodelación epigenética en las neuronas que gobiernan los comportamientos relevantes (por ejemplo, hipometilación de genes relacionados con la arginina vasopresina en la amígdala medial , que disminuyen en gran medida la aversión a los depredadores). [11] [12]
En los seres humanos, especialmente en los bebés y en aquellos con inmunidad debilitada , la infección por T. gondii generalmente es asintomática, pero puede provocar un caso grave de toxoplasmosis . [13] [4] T. gondii inicialmente puede causar síntomas leves similares a los de la gripe en las primeras semanas después de la exposición, pero por lo demás, los adultos humanos sanos son asintomáticos. [14] [13] [4] Este estado asintomático de infección se conoce como infección latente y se ha asociado con numerosas alteraciones sutiles de comportamiento, psiquiátricas y de personalidad en humanos. [14] [15] [16] Los cambios de comportamiento observados entre humanos infectados y no infectados incluyen una menor aversión a la orina de gato (pero con trayectorias divergentes según el género) y un mayor riesgo de varios trastornos psiquiátricos , particularmente esquizofrenia y trastorno bipolar . [17] La evidencia preliminar ha sugerido que la infección por T. gondii puede inducir algunas de las mismas alteraciones en el cerebro humano que las observadas en roedores. [18] [19] [9] [20] [21] [22] Muchas de estas asociaciones han sido fuertemente debatidas y estudios más recientes han encontrado que son débiles, concluyendo: [23]
En general, hubo poca evidencia de que T. gondii estuviera relacionado con un mayor riesgo de trastorno psiquiátrico, control deficiente de los impulsos, aberraciones de la personalidad o deterioro neurocognitivo.
T. gondii es uno de los parásitos más comunes en los países desarrollados; [24] [25] Los estudios serológicos estiman que hasta el 50% de la población mundial ha estado expuesta y puede estar infectada crónicamente con T. gondii ; aunque las tasas de infección difieren significativamente de un país a otro. [14] [26] Las estimaciones han demostrado que la seroprevalencia de IgG más alta se encuentra en Etiopía , con un 64,2 %, en 2018. [27]

T. gondii contiene orgánulos llamados róptrios y micronemas , además de otros orgánulos.

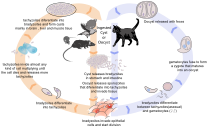
El ciclo de vida de T. gondii puede resumirse en dos componentes: un componente sexual que ocurre sólo en los gatos (felinos, salvajes o domésticos) y un componente asexual que puede ocurrir en prácticamente todos los animales de sangre caliente, incluidos los humanos y los gatos. y pájaros. [28] : 2 Debido a que T. gondii puede reproducirse sexualmente solo dentro de los gatos, los gatos son, por lo tanto, el huésped definitivo de T. gondii . Todos los demás huéspedes (en los que sólo puede producirse reproducción asexual) son huéspedes intermediarios .
Cuando un felino se infecta con T. gondii (por ejemplo, al consumir un ratón infectado que porta los quistes tisulares del parásito), el parásito sobrevive al paso a través del estómago y eventualmente infecta las células epiteliales del intestino delgado del gato. [28] : 39 Dentro de estas células intestinales, los parásitos experimentan desarrollo y reproducción sexual, produciendo millones de quistes de paredes gruesas que contienen cigotos conocidos como ooquistes. Los felinos son el único huésped definitivo porque carecen de expresión de la enzima delta-6-desaturasa (D6D) en su intestino. Esta enzima convierte el ácido linoleico ; la ausencia de expresión permite la acumulación sistémica de ácido linoleico. Hallazgos recientes demostraron que este exceso de ácido linoleico es esencial para la reproducción sexual de T. gondii . [6]

Las células epiteliales infectadas eventualmente se rompen y liberan ooquistes en la luz intestinal , tras lo cual se eliminan en las heces del gato. [4] : 22 Los ooquistes pueden luego propagarse al suelo, el agua, los alimentos o cualquier cosa potencialmente contaminada con las heces. Los ooquistes, muy resistentes, pueden sobrevivir y seguir siendo infecciosos durante muchos meses en climas fríos y secos. [29]
La ingestión de ooquistes por parte de humanos u otros animales de sangre caliente es una de las vías comunes de infección. [30] Los seres humanos pueden quedar expuestos a los ooquistes, por ejemplo, al consumir vegetales sin lavar o agua contaminada, o al manipular las heces (excrementos) de un gato infectado. [28] : 2 [31] Aunque los gatos también pueden infectarse al ingerir ooquistes, son mucho menos sensibles a la infección por ooquistes que los huéspedes intermediarios. [32] [4] : 107
Los huéspedes intermedios encontrados incluyen cerdos, pollos, cabras, ovejas [28] : 2 y Macropus rufus por Moré et al. 2010. [33] : 162 El ganado vacuno y los caballos son resistentes y se cree que son incapaces de sufrir una infección significativa. [28] : 11 Se considera que T. gondii tiene tres etapas de infección; la etapa de taquizoíto de división rápida, la etapa de bradizoíto de división lenta dentro de quistes tisulares y la etapa ambiental de ooquiste. [34] Los taquizoitos también se conocen como "merozoitos taquizoicos" y los bradizoitos como "merozoitos bradizoicos". [35] Cuando un ser humano u otro animal de sangre caliente ingiere un ooquiste o un quiste tisular, la pared resistente del quiste se disuelve mediante enzimas proteolíticas en el estómago y el intestino delgado, liberando esporozoitos del interior del ooquiste. [30] [34] Los parásitos primero invaden las células que se encuentran dentro y alrededor del epitelio intestinal, y dentro de estas células, los parásitos se diferencian en taquizoítos, la etapa celular móvil y de rápida multiplicación de T. gondii . [28] : 39 Los quistes tisulares en tejidos como el cerebro y el tejido muscular se forman aproximadamente entre 7 y 10 días después de la infección inicial. [34] Aunque se ha observado una infección grave por M. rufus , se desconoce si esto es común. [33]
Dentro de las células huésped, los taquizoítos se replican dentro de vacuolas especializadas (llamadas vacuolas parasitóforas ) creadas a partir de la membrana de la célula huésped durante la invasión de la célula. [28] : 23–39 Los taquizoítos se multiplican dentro de esta vacuola hasta que la célula huésped muere y se rompe, liberando y diseminando los taquizoítos a través del torrente sanguíneo a todos los órganos y tejidos del cuerpo, incluido el cerebro . [28] : 39–40
El parásito puede cultivarse fácilmente en monocapas de células de mamíferos mantenidas in vitro en cultivo de tejidos . Invade y multiplica fácilmente en una amplia variedad de líneas celulares de fibroblastos y monocitos . En cultivos infectados, el parásito se multiplica rápidamente y miles de taquizoítos se desprenden de las células infectadas y entran en las células adyacentes, destruyendo la monocapa a su debido tiempo. Luego se pueden infectar nuevas monocapas utilizando una gota de este líquido de cultivo infectado y el parásito se mantiene indefinidamente sin necesidad de animales.
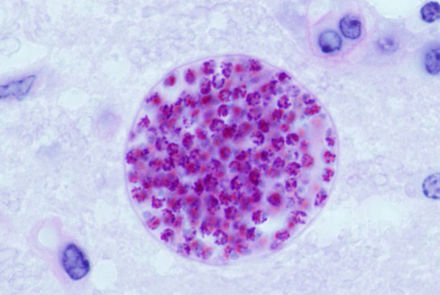
Después del período inicial de infección caracterizado por la proliferación de taquizoítos en todo el cuerpo, la presión del sistema inmunológico del huésped hace que los taquizoítos de T. gondii se conviertan en bradizoítos, la etapa celular semilatente y de división lenta del parásito. [36] Dentro de las células huésped, los grupos de estos bradizoitos se conocen como quistes tisulares. La pared del quiste está formada por la membrana de la vacuola parasitófora. [28] : 343 Aunque los quistes tisulares que contienen bradizoitos pueden formarse prácticamente en cualquier órgano, los quistes tisulares se forman y persisten predominantemente en el cerebro, los ojos y el músculo estriado (incluido el corazón). [28] : 343 Sin embargo, los tropismos tisulares específicos pueden variar entre especies hospedadoras intermedias; en los cerdos, la mayoría de los quistes tisulares se encuentran en el tejido muscular, mientras que en los ratones, la mayoría de los quistes se encuentran en el cerebro. [28] : 41
Los quistes suelen tener un tamaño de entre cinco y 50 µm de diámetro [37] (siendo 50 µm aproximadamente dos tercios del ancho del cabello humano promedio). [38]
El consumo de quistes tisulares en la carne es uno de los principales medios de infección por T. gondii , tanto en humanos como en animales de sangre caliente que comen carne. [28] : 3 Los humanos consumen quistes tisulares cuando comen carne cruda o poco cocida (particularmente cerdo y cordero). [39] El consumo de quistes de tejido es también el principal medio por el cual los gatos se infectan. [4] : 46
Una exhibición en el Museo de Historia Natural de San Diego afirma que la escorrentía urbana con heces de gato transporta Toxoplasma gondii al océano, que puede matar a las nutrias marinas. [40]
Los quistes tisulares pueden mantenerse en el tejido huésped durante toda la vida del animal. [28] : 580 Sin embargo, la presencia perpetua de quistes parece deberse a un proceso periódico de ruptura y reenquistamiento del quiste, más que a una vida útil perpetua de quistes o bradizoítos individuales. [28] : 580 En un momento dado, en un huésped con infección crónica, un porcentaje muy pequeño de quistes se rompe, [28] : 45 aunque, en 2010, aún no se conoce la causa exacta de la ruptura de este quiste tisular. [4] : 47
En teoría, T. gondii puede transmitirse entre huéspedes intermediarios de forma indefinida mediante un ciclo de consumo de quistes tisulares presentes en la carne. Sin embargo, el ciclo de vida del parásito comienza y se completa sólo cuando el parásito pasa a un huésped felino, el único huésped dentro del cual el parásito puede volver a desarrollarse y reproducirse sexualmente. [30]
En 2006, los investigadores revisaron la evidencia de que T. gondii tiene una estructura poblacional inusual dominada por tres linajes clonales llamados Tipos I, II y III que se encuentran en América del Norte y Europa, a pesar de la ocurrencia de una fase sexual en su ciclo de vida. Estimaron que existió un ancestro común hace unos 10.000 años. [41] Los autores de un estudio posterior y más amplio sobre 196 aislamientos de diversas fuentes, incluido T. gondii en el águila calva, el lobo gris, el zorro ártico y la nutria marina, también encontraron que las cepas de T. gondii que infectan la vida silvestre de América del Norte tienen una diversidad genética limitada con la aparición de sólo unos pocos tipos clonales importantes. Descubrieron que el 85% de las cepas en América del Norte pertenecían a uno de los tres genotipos II, III y Tipo 12 muy difundidos. Así, T. gondii ha conservado la capacidad sexual en América del Norte durante muchas generaciones, produciendo poblaciones en gran medida clonales, y los apareamientos han generado poca diversidad genética. [42]
Durante diferentes períodos de su ciclo de vida, los parásitos individuales se convierten en varias etapas celulares, cada una de las cuales se caracteriza por una morfología , bioquímica y comportamiento celular distintos. Estas etapas incluyen taquizoítos, merozoítos, bradizoítos (que se encuentran en los quistes tisulares) y esporozoítos (que se encuentran en los ooquistes).
Algunas etapas son móviles y algunas proteínas quinasas dependientes de calcio (TgCDPK s) están involucrados en la motilidad de este parásito. [43] [44] Gaji et al. 2015 encontrarSe requiere TgCDPK3 para iniciar la acción de la motilidad porque fosforila la miosina A de T. gondii(TgMYOA ). [43] [44] TgCDPK3 es el ortólogo funcional de CDPK1 en este parásito. [44]

Los taquizoitos móviles y que se multiplican rápidamente son responsables de expandir la población del parásito en el huésped. [45] [28] : 19 Cuando un huésped consume un quiste tisular (que contiene bradizoitos) o un ooquiste (que contiene esporozoitos), los bradizoitos o esporozoitos se convierten en taquizoitos al infectar el epitelio intestinal del huésped. [28] : 359 Durante el período agudo inicial de la infección, los taquizoítos se diseminan por todo el cuerpo a través del torrente sanguíneo. [28] : 39–40 Durante las últimas etapas latentes (crónicas) de la infección, los taquizoítos se convierten en bradizoítos para formar quistes tisulares.

Al igual que los taquizoitos, los merozoitos se dividen rápidamente y son responsables de ampliar la población del parásito dentro del intestino del gato antes de la reproducción sexual. [28] : 19 Cuando un huésped definitivo felino consume un quiste de tejido (que contiene bradizoitos), los bradizoitos se convierten en merozoitos dentro de las células epiteliales intestinales. Después de un breve período de rápido crecimiento poblacional en el epitelio intestinal, los merozoitos se convierten en las etapas sexuales no infecciosas del parásito para experimentar la reproducción sexual, lo que eventualmente resulta en ooquistes que contienen cigotos. [28] : 306
Los bradizoitos son la etapa de división lenta del parásito que forma los quistes tisulares. Cuando un huésped no infectado consume un quiste tisular, los bradizoítos liberados del quiste infectan las células epiteliales intestinales antes de convertirse a la etapa de taquizoíto proliferativo. [28] : 359 Después del período inicial de proliferación en todo el cuerpo del huésped, los taquizoitos se convierten nuevamente en bradizoitos, que se reproducen dentro de las células del huésped para formar quistes tisulares en el nuevo huésped.
Los esporozoitos son la etapa del parásito que reside dentro de los ooquistes. Cuando un ser humano u otro huésped de sangre caliente consume un ooquiste, se liberan esporozoitos que infectan las células epiteliales antes de convertirse a la etapa de taquizoíto proliferativo. [28] : 359
Inicialmente, una infección por T. gondii estimula la producción de IL-2 e IFN-γ por parte del sistema inmunológico innato. [36] La producción continua de IFN-γ es necesaria para el control de la infección aguda y crónica por T. gondii . [36] Estas dos citoquinas provocan una respuesta inmune mediada por células T CD4+ y CD8+. [36] Por lo tanto, las células T desempeñan un papel central en la inmunidad contra la infección por Toxoplasma . Las células T reconocen los antígenos de Toxoplasma que les presentan las moléculas del Complejo Mayor de Histocompatibilidad (MHC) del cuerpo. La secuencia genética específica de una determinada molécula de MHC difiere dramáticamente entre individuos, razón por la cual estas moléculas están involucradas en el rechazo de trasplantes. Los individuos que portan ciertas secuencias genéticas de moléculas MHC tienen muchas más probabilidades de estar infectados con Toxoplasma . Un estudio de más de 1600 personas encontró que la infección por Toxoplasma era especialmente común entre personas que expresaban ciertos alelos del MHC (HLA-B*08:01, HLA-C*04:01, HLA-DRB 03:01, HLA-DQA*05: 01 y HLA-DQB*02:01). [46]
La IL-12 se produce durante la infección por T. gondii para activar las células asesinas naturales (NK) . [36] El triptófano es un aminoácido esencial para T. gondii, que elimina de las células huésped. El IFN-γ induce la activación de la indol-amino-2,3-dioxigenasa (IDO) y la triptófano-2,3-dioxigenasa (TDO), dos enzimas responsables de la degradación del triptófano. [47] La presión inmune eventualmente lleva al parásito a formar quistes que normalmente se depositan en los músculos y en el cerebro de los huéspedes. [36]
La activación de IDO y TDO mediada por IFN-γ es un mecanismo evolutivo que sirve para matar de hambre al parásito, pero puede provocar el agotamiento del triptófano en el cerebro del huésped. "IDO y TDO degradan el triptófano a N-formilquinurenina ". La administración de L-quinurenina es capaz de inducir un comportamiento similar a la depresión en ratones. [47] Se ha demostrado que la infección por T. gondii aumenta los niveles de ácido quinurénico (KYNA) en el cerebro de ratones infectados y en el cerebro de personas esquizofrénicas. [47] Los niveles bajos de triptófano y serotonina en el cerebro ya estaban asociados con la depresión. [48]
Se han identificado los siguientes factores de riesgo de infección por T. gondii en humanos y animales de sangre caliente:
Un argumento común en el debate sobre si tener un gato es ético implica la cuestión de la transmisión de Toxoplasma gondii a los humanos. [60] Aunque "vivir en un hogar con un gato que usaba una caja de arena estaba fuertemente asociado con la infección", [31] y que vivir con varios gatitos o cualquier gato menor de un año tiene cierta importancia, [50] varios otros estudios afirman haber demostrado que vivir en una casa con un gato no es un factor de riesgo significativo para la infección por T. gondii . [51] [61]
Los vectores específicos de transmisión también pueden diferir según la ubicación geográfica. "Se cree que el agua de mar de California está contaminada por ooquistes de T. gondii que se originan en las heces de los gatos, sobreviven o evitan el tratamiento de aguas residuales y viajan a la costa a través de sistemas fluviales. Se ha identificado T. gondii en un mejillón de California mediante la reacción en cadena de la polimerasa y secuenciación de ADN. A la luz de la posible presencia de T. gondii, las mujeres embarazadas y las personas inmunodeprimidas deben ser conscientes de este riesgo potencial asociado con el consumo de ostras, mejillones y almejas crudas". [50]
En animales de sangre caliente, como ratas marrones , ovejas y perros, también se ha demostrado que T. gondii se transmite sexualmente. [62] [63] [64] Aunque T. gondii puede infectar, transmitirse y reproducirse asexualmente dentro de los humanos y prácticamente en todos los demás animales de sangre caliente, el parásito puede reproducirse sexualmente solo dentro de los intestinos de los miembros de la familia de los gatos ( felinos) . [30] Los félidos son, por tanto, los huéspedes definitivos de T. gondii ; todos los demás huéspedes (como humanos u otros mamíferos) son huéspedes intermediarios .
Se recomiendan las siguientes precauciones para prevenir o reducir en gran medida las posibilidades de infectarse con T. gondii . Esta información ha sido adaptada de los sitios web de los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos [65] y la Clínica Mayo . [66]
Las prácticas básicas de seguridad en la manipulación de alimentos pueden prevenir o reducir las posibilidades de infectarse con T. gondii , como lavar frutas y verduras sin lavar y evitar carnes, aves y mariscos crudos o poco cocidos. Otras prácticas inseguras, como beber leche no pasteurizada o agua sin tratar, pueden aumentar las probabilidades de infección. [65] Como T. gondii se transmite comúnmente a través de la ingestión de quistes microscópicos en los tejidos de animales infectados, la carne que no está preparada para destruirlos presenta un riesgo de infección. Congelar la carne durante varios días a temperaturas bajo cero (0 °F o -18 °C) antes de cocinarla puede descomponer todos los quistes, ya que rara vez sobreviven a estas temperaturas. [4] : 45 Durante la cocción, los cortes enteros de carne roja deben cocinarse a una temperatura interna de al menos 145 °F (63 °C). La carne a medio cocer generalmente se cocina entre 130 y 140 °F (55 y 60 °C), [67] por lo que se recomienda cocinar la carne al menos a fuego medio . Después de la cocción se debe dejar un periodo de reposo de 3 min antes de su consumo. Sin embargo, la carne molida debe cocinarse a una temperatura interna de al menos 71 °C (160 °F) sin período de descanso. Todas las aves deben cocinarse a una temperatura interna de al menos 165 °F (74 °C). Después de la cocción se debe dejar un periodo de reposo de 3 min antes de su consumo.
Los ooquistes en las heces de los gatos tardan al menos un día en esporularse (para volverse infecciosos después de su eliminación), por lo que desechar la arena para gatos a diario reduce en gran medida la posibilidad de que se desarrollen ooquistes infecciosos. Como estos pueden propagarse y sobrevivir en el medio ambiente durante meses, los humanos deben usar guantes cuando trabajen en el jardín o con la tierra, y deben lavarse las manos rápidamente después de desechar la arena para gatos. Estas precauciones se aplican a los areneros/fosos de arena para juegos al aire libre, que deben cubrirse cuando no estén en uso. Las heces de gato nunca se deben tirar por el inodoro.
Las mujeres embarazadas corren un mayor riesgo de transmitir el parásito al feto y las personas inmunodeprimidas de contraer una infección persistente. Por este motivo, no deben cambiar ni manipular las cajas de arena para gatos. Lo ideal es mantener a los gatos en el interior y alimentarlos únicamente con alimentos que tengan un riesgo bajo o nulo de portar ooquistes, como la comida comercial para gatos o la comida de mesa bien cocinada.
No existe ninguna vacuna humana aprobada contra Toxoplasma gondii . [68] La investigación sobre vacunas humanas está en curso. [69]
Para las ovejas , una vacuna viva aprobada que se vende como Toxovax (de MSD Animal Health ) brinda protección de por vida. [70]
En humanos, la toxoplasmosis activa se puede tratar con una combinación de fármacos como pirimetamina y sulfadiazina , además de ácido folínico . Los pacientes inmunocomprometidos pueden necesitar un tratamiento continuo hasta que se restablezca su sistema inmunológico. [71]
En muchas partes del mundo, donde hay altas poblaciones de gatos salvajes, existe un mayor riesgo para la vida silvestre nativa debido al aumento de la infección por Toxoplasma gondii . Se ha descubierto que las concentraciones séricas de T. gondii en la población silvestre aumentan donde hay grandes cantidades de poblaciones de gatos. Esto crea un entorno peligroso para los organismos que no han evolucionado en convivencia con los felinos y sus parásitos contribuyentes. [72]
La toxoplasmosis es uno de los factores que contribuyen a la mortalidad de las nutrias marinas del sur , especialmente en áreas donde hay una gran escorrentía urbana. [73] En sus hábitats naturales, las nutrias marinas controlan las poblaciones de erizos de mar y, por tanto, indirectamente, controlan los bosques de algas marinas. Al permitir el crecimiento de las algas marinas, se protegen otras poblaciones marinas y se reducen las emisiones de CO 2 debido a la capacidad de las algas para absorber carbono atmosférico. [74] Un examen de 105 nutrias playeras reveló que el 38,1% tenía infecciones parasitarias y el 28% de dichas infecciones habían provocado muertes por meningoencefalitis protozoaria. [73] Se encontró que Toxoplasma gondii era la causa principal del 16,2% de estas muertes, mientras que el 6,7% de las muertes se debieron a un parásito protozoario estrechamente relacionado conocido como Sarcocystis neurona . [73]
Los visones, al ser semiacuáticos, también son susceptibles a la infección y tienen anticuerpos positivos contra Toxoplasma gondii . [75] Los visones pueden seguir una dieta similar a la de las nutrias y darse un festín con crustáceos, peces e invertebrados, por lo que la ruta de transmisión sigue un patrón similar al de las nutrias. Debido a la capacidad del visón de atravesar la tierra con más frecuencia, y a menudo visto como una especie invasora en sí misma, los visones son una amenaza mayor en el transporte de T. gondii a otras especies de mamíferos, en lugar de las nutrias que tienen una amplitud más restrictiva. [75]
Aunque poco estudiadas, las poblaciones de pingüinos, especialmente aquellas que comparten un ambiente con la población humana, están en riesgo debido a infecciones parasitarias, principalmente Toxoplasmosis gondii . Las principales subespecies de pingüinos infectadas por T. gondii incluyen los pingüinos salvajes de Magallanes y Galápagos, así como los pingüinos azules y africanos en cautiverio. [76] En un estudio, se encontró que 57 (43,2%) de 132 muestras de suero de pingüinos de Magallanes tenían T. gondii . Se sabe que la isla donde se encuentra el pingüino, la Isla Magdalena, no tiene poblaciones de gatos, pero sí una población humana muy frecuente, lo que indica la posibilidad de transmisión. [76]
El examen de pingüinos de patas negras con toxoplasmosis revela hepatomegalia, esplenomegalia, hemorragia craneal y riñones necróticos. [77] El tejido alveolar y hepático presenta una gran cantidad de células inmunes, como macrófagos que contienen taquizoitos de T. gondii. [77] Las características histopatológicas en otros animales afectados con toxoplasmosis tenían taquizoítos en estructuras oculares como la retina, lo que provoca ceguera. [77]
La transmisión de ooquistes ha sido desconocida, aunque existen muchos casos documentados de infección en especies marinas. Los investigadores han descubierto que los ovocitos de T. gondii pueden sobrevivir en el agua de mar durante al menos 6 meses y que la cantidad de concentración de sal no afecta su ciclo de vida. No se han realizado estudios sobre la capacidad del ciclo de vida de los ooquistes de T. gondii en ambientes de agua dulce, aunque las infecciones todavía están presentes. Una posible hipótesis de transmisión es a través de especies de amebas, particularmente Acanthamoeba spp., una especie que se encuentra en todos los ambientes acuáticos (agua dulce, salobre y de mar pura). Normalmente, las amebas funcionan como un filtro natural, fagocitando los nutrientes y las bacterias que se encuentran en el agua. Sin embargo, algunos patógenos han aprovechado esto y han evolucionado para poder evitar ser descompuestos y, por lo tanto, sobrevivir encerrados en la ameba (esto incluye Holosporaceae, Pseudomonaceae, Burkholderiacceae, entre otros). [78] En general, esto ayuda al patógeno en el transporte pero, también, lo protege de medicamentos y esterilizadores que, de otro modo, causarían la muerte del patógeno. [79] Los estudios han demostrado que los ooquistes de T. gondii pueden vivir dentro de las amebas después de haber sido engullidos durante al menos 14 días sin una destrucción significativa del parásito. [80] La capacidad del microorganismo para sobrevivir in vitro depende del propio microorganismo, pero existen algunos mecanismos generales presentes. Se ha descubierto que los ooquistes de T. gondii resisten un pH ácido y, por tanto, están protegidos por la acidificación que se encuentra en las vacuolas y lisosomas endocíticos. [80] La fagocitosis aumenta aún más con la membrana superficial rica en carbohidratos ubicada en las amebas. [81] El patógeno puede liberarse mediante lisis de las amebas o mediante exocitosis, pero esto no se ha estudiado suficientemente [82]
Casi todas las especies de aves a las que se les han realizado pruebas de detección de Toxoplasma gondii han resultado positivas. Las únicas especies de aves que no presentan síntomas clínicos de toxoplasmosis serían los patos salvajes, y sólo se ha encontrado un informe sobre patos domesticados en 1962. [83] Las especies con resistencia a T. gondii incluyen pavos domésticos, [84] búhos, halcones de cola roja y gorriones, según la cepa de T. gondii . [85] T. gondii es considerablemente más grave en las palomas, particularmente en las palomas corona, las palomas ornamentales y las palomas originarias de Australia y Nueva Zelanda. El inicio típico es rápido y generalmente resulta en la muerte. Los que sobreviven suelen padecer enfermedades crónicas de encefalitis y neuritis. [85] De manera similar, se observa que los canarios son tan graves como las palomas, pero los síntomas clínicos son más anormales en comparación con otras especies. La mayor parte de la infección afecta al ojo y provoca ceguera, lesiones coroideas, conjuntivitis, atrofia del ojo, blefaritis y coriorretinitis [85] . La mayoría de las veces, la infección provoca la muerte.
La urbanización y el calentamiento global son extremadamente influyentes en la transmisión de T. gondii . [86] La temperatura y la humedad son factores importantes en la etapa de esporulación: la baja humedad siempre es fatal para los ooquistes y también son vulnerables a temperaturas extremas. [86] Las precipitaciones también son un factor importante para la supervivencia de los patógenos transmitidos por el agua. Debido a que el aumento de las precipitaciones aumenta directamente el caudal de los ríos, también aumenta la cantidad de caudal que llega a las zonas costeras. Esto puede propagar patógenos transmitidos por el agua en amplias áreas.
No existe una vacuna eficaz contra T. gondii y se están realizando investigaciones sobre una vacuna viva. Alimentar a los gatos con alimentos disponibles comercialmente, en lugar de carne cruda y poco cocida, evita que los felinos se conviertan en huéspedes de ooquistes, ya que la mayor prevalencia se da en áreas donde se alimenta con carne cruda. [87] Los investigadores también sugieren que los propietarios restrinjan a los gatos a vivir en interiores y a ser castrados o esterilizados para disminuir las poblaciones de gatos callejeros y reducir las interacciones con los huéspedes intermediarios. Se sugiere recolectar diariamente la materia fecal de las cajas de arena, colocarla en una bolsa sellable y desecharla en la basura en lugar de tirarla al inodoro, para limitar la contaminación del agua. [88]
Los estudios han encontrado que los humedales con alta densidad de vegetación disminuyen la concentración de ooquistes en el agua a través de dos posibles mecanismos. En primer lugar, la vegetación disminuye las velocidades del flujo, lo que permite una mayor sedimentación debido al mayor tiempo de transporte. [88] En segundo lugar, la vegetación puede eliminar los ooquistes a través de su capacidad para filtrar mecánicamente el agua, así como a través del proceso de adhesión (es decir, unión a biopelículas). Se ha descubierto que las zonas de erosión y destrucción de humedales costeros albergan mayores concentraciones de ooquistes de T. gondii , que luego desembocan en aguas costeras abiertas. Se ha demostrado que los tratamientos físicos y químicos actuales utilizados típicamente en las instalaciones de tratamiento de agua son ineficaces contra T. gondii . Las investigaciones han demostrado que la desinfección con UV-C del agua que contiene ooquistes da como resultado su inactivación y posible esterilización. [89]
Se han secuenciado los genomas de más de 60 cepas de T. gondii . La mayoría tienen un tamaño de 60 a 80 Mb y constan de 11 a 14 cromosomas . [90] [91] Las cepas principales codifican entre 7800 y 10 000 proteínas , de las cuales aproximadamente 5200 se conservan en RH, GT1, ME49 y VEG. [90] Se ha creado una base de datos, ToxoDB, para documentar información genómica sobre Toxoplasma . [92] [93] [94]
En 1908, mientras trabajaban en el Instituto Pasteur de Túnez , Charles Nicolle y Louis Manceaux descubrieron un organismo protozoario en los tejidos de un roedor parecido a un hámster conocido como gundi , Ctenodactylus gundi . [30] Aunque Nicolle y Manceaux inicialmente creyeron que el organismo era un miembro del género Leishmania que describieron como "Leishmania gondii" , pronto se dieron cuenta de que habían descubierto un organismo completamente nuevo; lo rebautizaron como Toxoplasma gondii . El nuevo nombre del género Toxoplasma es una referencia a su morfología: Toxo , del griego τόξον ( toxon , 'arco, arco'), y πλάσμα ( plasma , 'figura, forma') y al huésped en el que fue descubierto, el gundi ( gondii). [95] El mismo año que Nicolle y Mancaeux descubrieron T. gondii , Alfonso Splendore identificó el mismo organismo en un conejo en Brasil . Sin embargo, no le dio ningún nombre. [30] En 1914, el tropicalista italiano Aldo Castellani "fue el primero en sospechar que la toxoplasmosis podía afectar a los humanos". [96]
La primera identificación concluyente de T. gondii en humanos se produjo en una niña que nació a término mediante cesárea el 23 de mayo de 1938 en el Babies' Hospital de la ciudad de Nueva York . [30] La niña comenzó a tener convulsiones a los tres días de edad y los médicos identificaron lesiones en las máculas de ambos ojos. Cuando murió al mes de edad, se realizó una autopsia . Se descubrió que las lesiones descubiertas en su cerebro y tejido ocular tenían T. gondii tanto libre como intracelular . [30] El tejido infectado de la niña se homogeneizó y se inoculó por vía intracerebral en conejos y ratones; luego desarrollaron encefalitis . Posteriormente, se confirmó la transmisión congénita en muchas otras especies, en particular en ovejas y roedores infectados.
La posibilidad de transmisión de T. gondii a través del consumo de carne poco cocida fue propuesta por primera vez por D. Weinman y AH Chandler en 1954. [30] En 1960, se demostró que la pared del quiste relevante se disolvía en las enzimas proteolíticas que se encuentran en el estómago, liberando enfermedades infecciosas. bradizoítos en el estómago (que pasan al intestino). La hipótesis de la transmisión por consumo de carne poco cocida se probó en un orfanato de París en 1965; La incidencia de T. gondii aumentó del 10% al 50% después de un año de agregar dos porciones de carne de res o de caballo cocida a la dieta diaria de muchos huérfanos, y al 100% entre los alimentados con chuletas de cordero cocidas. [30]
Un estudio realizado en Mumbai en 1959 encontró que la prevalencia entre los vegetarianos estrictos era similar a la de los no vegetarianos. Esto planteó la posibilidad de una tercera vía importante de infección, más allá de la transmisión congénita y de los carnívoros de carne no bien cocida. [30]
En 1970, se encontraron ooquistes en heces (de gato). Se demostró la vía de infección fecal-oral a través de ooquistes. [30] En las décadas de 1970 y 1980 se analizaron las heces de una amplia gama de especies animales infectadas para ver si contenían ooquistes; al menos 17 especies de félidos arrojaron ooquistes, pero no se ha demostrado que ningún no félido permita la reproducción sexual de T. gondii. (lo que lleva a la eliminación de ooquistes). [30]
En 1984, Elmer R. Pfefferkorn publicó su descubrimiento de que el tratamiento de fibroblastos humanos con interferón gamma recombinante humano bloquea el crecimiento de T. gondii . [97]
Hay muchos casos en los que se informaron cambios de comportamiento en roedores con T. gondii . Los cambios observados fueron una reducción en su aversión innata hacia los gatos, lo que facilitó que los gatos se aprovecharan de los roedores. En un experimento realizado por Berdoy y colegas, las ratas infectadas mostraron preferencia por la zona con olor a gato frente a la zona con olor a conejo, facilitando así al parásito dar su paso final en su huésped felino definitivo. [7] Este es un ejemplo del concepto de fenotipo extendido , es decir, la idea de que el comportamiento del animal infectado cambia para maximizar la supervivencia de los genes que aumentan la depredación del huésped roedor intermediario. [98]
Las diferencias en el comportamiento dependiente del sexo observadas en huéspedes infectados en comparación con individuos no infectados pueden atribuirse a diferencias en la testosterona. Los hombres infectados tenían niveles más altos de testosterona, mientras que las mujeres infectadas tenían niveles significativamente más bajos, en comparación con sus equivalentes no infectados. [99] En cuanto a los seres humanos, los estudios que utilizaron el cuestionario de los 16 factores de personalidad de Cattell encontraron que los hombres infectados obtuvieron puntuaciones más bajas en el Factor G (fuerza del superyó/conciencia de las reglas) y más altas en el Factor L (vigilancia), mientras que se observó el patrón opuesto en las mujeres infectadas. [100] Estos hombres eran más propensos a ignorar las reglas y eran más convenientes, desconfiados y celosos. Por otro lado, las mujeres eran más afectuosas, extrovertidas, concienzudas y moralistas. [100] Los ratones infectados con T. gondii tienen un peor rendimiento motor que los ratones no infectados. [101] [102] Por lo tanto, se aplicó una prueba de reacción simple computarizada tanto a adultos infectados como a no infectados. Se descubrió que los adultos infectados se desempeñaron mucho peor y perdieron la concentración más rápidamente que el grupo de control . Pero el efecto de la infección sólo explica menos del 10% de la variabilidad en el rendimiento [100] (es decir, podría haber otros factores de confusión). También se ha observado una correlación entre la seroprevalencia de T. gondii en humanos y un mayor riesgo de accidentes de tráfico. Los sujetos infectados tienen un riesgo 2,65 veces mayor de sufrir un accidente de tráfico. [103] Un estudio turco confirmó que esto es cierto entre los conductores. [104] Este parásito se ha asociado con muchos trastornos neurológicos como la esquizofrenia . En un metanálisis de 23 estudios que cumplieron los criterios de inclusión, la seroprevalencia de anticuerpos contra T. gondii en personas con esquizofrenia es significativamente mayor que en las poblaciones de control (OR = 2,73, P <0,000001). [105] Un resumen de estudios de 2009 encontró que los que intentaban suicidarse tenían muchos más anticuerpos indicativos (IgG) que los pacientes hospitalizados de salud mental sin un intento de suicidio. [106] También se demostró que la infección está asociada con el suicidio en mujeres mayores de 60 años. (P<0,005) [107]
Como se mencionó anteriormente, estos resultados de mayores proporciones de personas seropositivas para el parásito en casos de estos trastornos neurológicos no indican necesariamente una relación causal entre la infección y el trastorno. También es importante mencionar que en 2016 se realizó un estudio de cohorte de nacimientos representativo de la población para probar una hipótesis de que la toxoplasmosis está relacionada con el deterioro del cerebro y el comportamiento medido mediante una variedad de fenotipos que incluyen trastornos neuropsiquiátricos, control deficiente de los impulsos, personalidad y déficits neurocognitivos. Los resultados de este estudio no respaldaron los resultados de los estudios mencionados anteriormente, más que marginalmente. Ninguno de los valores de P mostró significación para ninguna medida de resultado. Por tanto, según este estudio, la presencia de anticuerpos contra T. gondii no se correlaciona con un aumento de la susceptibilidad a ninguno de los fenotipos de comportamiento (excepto posiblemente con una mayor tasa de intentos de suicidio fallidos). Este equipo no observó ninguna asociación significativa entre la seropositividad a T. gondii y la esquizofrenia . El equipo señala que los hallazgos nulos podrían ser un falso negativo debido al bajo poder estadístico debido a los tamaños de muestra pequeños, pero frente a estas ponderaciones, su configuración debería evitar algunas posibilidades de errores en los alrededor de 40 estudios que sí mostraron una correlación positiva. Concluyeron que se deberían realizar más estudios. [108] Otro estudio representativo de la población con 7440 personas en los Estados Unidos encontró que la infección por Toxoplasma era 2,4 veces más común en personas que tenían antecedentes de síntomas maníacos y depresivos (trastorno bipolar tipo 1) en comparación con la población general. [109]
La investigación sobre el vínculo entre la infección por T. gondii y el comportamiento empresarial mostró que los estudiantes que dieron positivo en la exposición a T. gondii tenían 1,4 veces más probabilidades de especializarse en negocios y 1,7 veces más probabilidades de tener un énfasis en "gestión y espíritu empresarial". Entre 197 participantes de eventos empresariales, la exposición a T. gondii se correlacionó con una probabilidad 1,8 veces mayor de haber iniciado su propio negocio. [110]
Las investigaciones publicadas también han indicado que la infección por T. gondii podría promover cambios en las creencias y valores políticos de una persona. Aquellos que están infectados con el parásito tienden a exhibir un mayor grado de pensamiento de "nosotros contra ellos". [111] [112] [113]
El mecanismo detrás de los cambios de comportamiento se atribuye en parte al aumento del metabolismo de la dopamina, [114] que puede neutralizarse con medicamentos antagonistas de la dopamina. [115] T. gondii tiene dos genes que codifican una fenilalanina y una tirosina hidroxilasa bifuncionales , dos pasos importantes y limitantes de la velocidad de la biosíntesis de dopamina. Uno de los genes se expresa constitutivamente, mientras que el otro sólo se produce durante el desarrollo del quiste. [116] [117] Además de la producción adicional de dopamina, la infección por T. gondii también produce cambios epigenéticos duraderos en animales que aumentan la expresión de vasopresina , una causa probable de alteraciones que persisten después de la eliminación de la infección. [118]
En 2022, un estudio publicado en Communications Biology de una población bien documentada de lobos estudiada a lo largo de su vida sugirió que T. gondii también puede tener un efecto significativo en su comportamiento. [119] Sugirió que la infección con este parásito envalentonó a los lobos infectados a adoptar un comportamiento que determinaba los roles de liderazgo e influía en el comportamiento de toma de riesgos, tal vez incluso motivando el establecimiento de nuevas manadas independientes que ellos establecerían y liderarían con patrones de comportamiento diferentes a los de las manadas en que nacieron. El estudio determinó que, en ocasiones, un lobo infectado se convertía en el único macho reproductor de una manada, lo que provocaba un efecto significativo de T. gondii en otra especie .
La toxoplasmosis se está convirtiendo en un peligro para la salud mundial, ya que infecta entre el 30% y el 50% de la población humana mundial. Clínicamente, la presencia permanente del parásito en los tejidos de la mayoría de los individuos infectados suele considerarse asintomática. Sin embargo, varios estudios muestran que esta "infección asintomática" también puede conducir al desarrollo de otras patologías humanas. ... La seroprevalencia de la toxoplasmosis se correlaciona con diversas cargas de morbilidad. Las asociaciones estadísticas no necesariamente significan causalidad. Sin embargo, el principio de precaución sugiere que el posible papel de la toxoplasmosis como factor desencadenante responsable del desarrollo de varias entidades clínicas merece mucha más atención y apoyo financiero tanto en la práctica médica diaria como en la investigación clínica futura.