
En ciencia de superficies , una doble capa ( DL , también llamada doble capa eléctrica , EDL ) es una estructura que aparece en la superficie de un objeto cuando se expone a un fluido . El objeto podría ser una partícula sólida , una burbuja de gas , una gota de líquido o un cuerpo poroso . La DL se refiere a dos capas paralelas de carga que rodean el objeto. La primera capa, la carga superficial (positiva o negativa), consta de iones que se adsorben en el objeto debido a interacciones químicas . La segunda capa está compuesta de iones atraídos por la carga superficial mediante la fuerza de Coulomb , apantallando eléctricamente la primera capa. Esta segunda capa está vagamente asociada con el objeto. Está formado por iones libres que se mueven en el fluido bajo la influencia de la atracción eléctrica y el movimiento térmico en lugar de estar firmemente anclados. Por eso se le llama "capa difusa".
Las DL interfaciales son más evidentes en sistemas con una gran relación superficie-volumen , como un coloide o cuerpos porosos con partículas o poros (respectivamente) en la escala de micrómetros a nanómetros . Sin embargo, las DL son importantes para otros fenómenos, como el comportamiento electroquímico de los electrodos .
Las DL juegan un papel fundamental en muchas sustancias cotidianas. Por ejemplo, la leche homogeneizada existe sólo porque las gotas de grasa están cubiertas con una DL que evita su coagulación y formando mantequilla . Las DL existen en prácticamente todos los sistemas heterogéneos basados en fluidos, como sangre, pintura, tinta, cerámica y lechadas de cemento .
La DL está estrechamente relacionada con los fenómenos electrocinéticos y los fenómenos electroacústicos .

Cuando un conductor electrónico se pone en contacto con un conductor iónico sólido o líquido (electrolito), aparece un límite común ( interfaz ) entre las dos fases . Hermann von Helmholtz [1] fue el primero en darse cuenta de que los electrodos cargados sumergidos en soluciones electrolíticas repelen los coiones de la carga mientras atraen contraiones a sus superficies. Se forman dos capas de polaridad opuesta en la interfaz entre el electrodo y el electrolito. En 1853 demostró que una doble capa eléctrica (DL) es esencialmente un dieléctrico molecular y almacena carga electrostáticamente. [2] Por debajo del voltaje de descomposición del electrolito, la carga almacenada depende linealmente del voltaje aplicado.
Este primer modelo predijo una capacitancia diferencial constante independiente de la densidad de carga dependiendo de la constante dieléctrica del disolvente electrolítico y el espesor de la doble capa. [3] [4] [5]
Este modelo, con una buena base para la descripción de la interfaz, no considera factores importantes que incluyen la difusión/mezcla de iones en solución, la posibilidad de adsorción en la superficie y la interacción entre los momentos dipolares del solvente y el electrodo.
Louis Georges Gouy en 1910 y David Leonard Chapman en 1913 observaron que la capacitancia no era una constante y que dependía del potencial aplicado y de la concentración iónica. El "modelo Gouy-Chapman" introdujo mejoras significativas al introducir un modelo difuso del DL. En este modelo, la distribución de carga de los iones en función de la distancia a la superficie del metal permite aplicar la estadística de Maxwell-Boltzmann . Por tanto, el potencial eléctrico disminuye exponencialmente lejos de la superficie del fluido. [3] [6]
Las capas de Gouy-Chapman pueden tener especial relevancia en bioelectroquímica. La observación de la transferencia de electrones entre proteínas a larga distancia a través de la solución acuosa [7] se ha atribuido a una región difusa entre las proteínas asociadas redox ( citocromos c y c 1 ) que está agotada de cationes en comparación con el volumen de la solución, lo que lleva a a un apantallamiento reducido , campos eléctricos que se extienden varios nanómetros y corrientes que disminuyen casi exponencialmente con la distancia a una velocidad de ~1 nm −1 . Esta región se denomina "conducto de Gouy-Chapman" [7] y está fuertemente regulada por la fosforilación , que agrega una carga negativa a la superficie de la proteína que interrumpe el agotamiento catiónico y previene el transporte de carga a larga distancia. [8] Se observan efectos similares en el sitio activo redox de los complejos fotosintéticos . [9]
El modelo de Gouy-Chapman falla en el caso de DL muy cargadas. En 1924, Otto Stern sugirió combinar el modelo de Helmholtz con el modelo de Gouy-Chapman: en el modelo de Stern, algunos iones se adhieren al electrodo como sugiere Helmholtz, dando una capa interna de Stern, mientras que otros forman una capa difusa de Gouy-Chapman. [10]
La capa de Stern representa el tamaño finito de los iones y, en consecuencia, el acercamiento más cercano de un ion al electrodo es del orden del radio iónico. El modelo de Stern tiene sus propias limitaciones, a saber, que trata efectivamente a los iones como cargas puntuales, asume que todas las interacciones significativas en la capa difusa son culombicas , asume que la permitividad dieléctrica es constante en toda la doble capa y que la viscosidad del fluido es un plano constante. [11]

DC Grahame modificó el modelo de Stern en 1947. [12] Propuso que algunas especies iónicas o sin carga pueden penetrar la capa de Stern, aunque la zona más cercana al electrodo normalmente está ocupada por moléculas de disolvente. Esto podría ocurrir si los iones pierden su capa de solvatación cuando se acercan al electrodo. Llamó a los iones en contacto directo con el electrodo "iones específicamente adsorbidos". Este modelo proponía la existencia de tres regiones. El plano interno de Helmholtz (IHP) pasa a través de los centros de los iones específicamente adsorbidos. El plano exterior de Helmholtz (OHP) pasa a través de los centros de los iones solvatados en la distancia de su máxima aproximación al electrodo. [13] Finalmente, la capa difusa es la región más allá del OHP.
En 1963 J. O'M. Bockris , MAV Devanathan y Klaus Müller [14] propusieron el modelo BDM de doble capa que incluía la acción del disolvente en la interfaz. Sugirieron que las moléculas adheridas al disolvente, como el agua, tendrían una alineación fija con la superficie del electrodo. Esta primera capa de moléculas de disolvente muestra una fuerte orientación al campo eléctrico dependiendo de la carga. Esta orientación tiene gran influencia en la permitividad del disolvente que varía con la intensidad del campo. El IHP pasa por los centros de estas moléculas. En esta capa aparecen iones parcialmente solvatados y específicamente adsorbidos. Los iones solvatados del electrolito se encuentran fuera del IHP. A través de los centros de estos iones pasa el OHP. La capa difusa es la región más allá del OHP.
Investigaciones posteriores con dobles capas sobre películas de dióxido de rutenio realizadas en 1971 por Sergio Trasatti y Giovanni Buzzanca demostraron que el comportamiento electroquímico de estos electrodos a bajas tensiones con iones adsorbidos específicos era similar al de los condensadores. La adsorción específica de los iones en esta región de potencial también podría implicar una transferencia de carga parcial entre el ion y el electrodo. Fue el primer paso hacia la comprensión de la pseudocapacitancia. [4]
Entre 1975 y 1980 , Brian Evans Conway llevó a cabo un extenso trabajo fundamental y de desarrollo sobre condensadores electroquímicos de óxido de rutenio . En 1991 describió la diferencia entre el comportamiento del 'supercondensador' y la 'batería' en el almacenamiento de energía electroquímica. En 1999 acuñó el término supercondensador para explicar el aumento de capacitancia por reacciones redox superficiales con transferencia de carga faradaica entre electrodos e iones. [15] [16]
Su "supercondensador" almacenaba carga eléctrica en parte en la doble capa de Helmholtz y en parte como resultado de reacciones faradaicas con transferencia de carga de "pseudocapacitancia" de electrones y protones entre electrodo y electrolito. Los mecanismos de funcionamiento de los pseudocondensadores son reacciones redox, intercalación y electrosorción.
Rudolph A. Marcus desarrolló los fundamentos físicos y matemáticos de la transferencia de carga de electrones sin enlaces químicos que conducen a la pseudocapacitancia . La teoría de Marcus explica las velocidades de las reacciones de transferencia de electrones: la velocidad a la que un electrón puede pasar de una especie química a otra. Fue formulado originalmente para abordar reacciones de transferencia de electrones en la esfera exterior , en las que dos especies químicas cambian solo en su carga, con un salto de electrón. Para reacciones redox sin establecer ni romper enlaces, la teoría de Marcus reemplaza a la teoría del estado de transición de Henry Eyring , que se derivó para reacciones con cambios estructurales. Marcus recibió el Premio Nobel de Química en 1992 por esta teoría. [17]
Hay descripciones detalladas de la DL interfacial en muchos libros sobre ciencia de coloides e interfaces [18] [19] [20] y transporte de fluidos a microescala. [21] [22] También hay un informe técnico reciente de la IUPAC [23] sobre el tema de la doble capa interfacial y los fenómenos electrocinéticos relacionados .
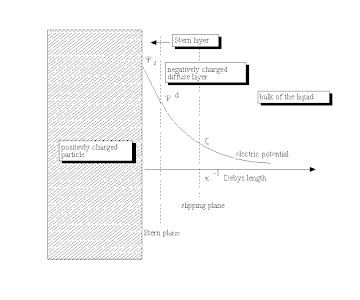
Como afirma Lyklema, "...la razón para la formación de una doble capa "relajada" ("en equilibrio") es la afinidad no eléctrica de los iones que determinan la carga por una superficie..." [ 24] Este proceso conduce a la acumulación de una carga eléctrica superficial , expresada generalmente en C/m 2 . Esta carga superficial crea un campo electrostático que luego afecta a los iones en la mayor parte del líquido. Este campo electrostático, en combinación con el movimiento térmico de los iones, crea una contracarga y, por tanto, protege la carga eléctrica superficial. La carga eléctrica neta en esta capa difusa protectora es igual en magnitud a la carga superficial neta, pero tiene la polaridad opuesta. Como resultado, toda la estructura es eléctricamente neutra.
La capa difusa, o al menos parte de ella, puede moverse bajo la influencia de una tensión tangencial . Existe un plano de deslizamiento introducido convencionalmente que separa el fluido móvil del fluido que permanece adherido a la superficie. El potencial eléctrico en este plano se llama potencial electrocinético o potencial zeta (también denominado potencial ζ). [25] [26]
El potencial eléctrico en el límite externo de la capa de Stern versus el electrolito en masa se denomina potencial de Stern . La diferencia de potencial eléctrico entre la masa del fluido y la superficie se denomina potencial eléctrico de superficie.
Generalmente se utiliza el potencial zeta para estimar el grado de carga DL. Un valor característico de este potencial eléctrico en el DL es de 25 mV con un valor máximo alrededor de 100 mV (hasta varios voltios en los electrodos [22] [27] ). La composición química de la muestra en la que el potencial ζ es 0 se denomina punto de carga cero o punto isoeléctrico . Generalmente está determinado por el valor del pH de la solución, ya que los protones y los iones hidroxilo son los iones que determinan la carga en la mayoría de las superficies. [22] [24]
El potencial zeta se puede medir mediante electroforesis , fenómenos electroacústicos , potencial de transmisión y flujo electroosmótico .
El espesor característico del DL es la longitud de Debye , κ −1 . Es recíprocamente proporcional a la raíz cuadrada de la concentración de iones C. En soluciones acuosas, normalmente es de la escala de unos pocos nanómetros y el espesor disminuye al aumentar la concentración del electrolito.
La intensidad del campo eléctrico dentro del DL puede oscilar entre cero y más de 10 9 V/m. Estos pronunciados gradientes de potencial eléctrico son la razón de la importancia de los DL.
La teoría para una superficie plana y un electrolito simétrico [24] suele denominarse teoría de Gouy-Chapman. Produce una relación simple entre la carga eléctrica en la capa difusa σ d y el potencial de Stern Ψ d : [28]
No existe una solución analítica general para electrolitos mixtos, superficies curvas o incluso partículas esféricas. Existe una solución asintótica para partículas esféricas con DL de baja carga. En el caso de que el potencial eléctrico sobre DL sea inferior a 25 mV, se cumple la llamada aproximación de Debye-Huckel. Produce la siguiente expresión para el potencial eléctrico Ψ en el DL esférico en función de la distancia r desde el centro de la partícula:
Existen varios modelos asintóticos que juegan papeles importantes en los desarrollos teóricos asociados con la DL interfacial.
El primero es "DL delgado". Este modelo supone que DL es mucho más delgada que la partícula coloidal o el radio capilar. Esto restringe el valor de la longitud de Debye y el radio de la partícula de la siguiente manera:
Este modelo ofrece enormes simplificaciones para muchas aplicaciones posteriores. La teoría de la electroforesis es sólo un ejemplo. [29] La teoría de los fenómenos electroacústicos es otro ejemplo. [30]
El modelo DL delgado es válido para la mayoría de los sistemas acuosos porque la longitud de Debye es de sólo unos pocos nanómetros en tales casos. Se descompone sólo en el caso de nanocoloides en solución con fuerzas iónicas cercanas al agua.
El modelo opuesto "DL grueso" supone que la longitud de Debye es mayor que el radio de la partícula:
Este modelo puede resultar útil para algunos nanocoloides y fluidos no polares, donde la longitud de Debye es mucho mayor.
El último modelo introduce "DL superpuestas". [30] Esto es importante en dispersiones y emulsiones concentradas cuando las distancias entre partículas se vuelven comparables con la longitud de Debye.
La doble capa eléctrica ( EDL ) es el resultado de la variación del potencial eléctrico cerca de una superficie, y tiene una influencia significativa en el comportamiento de los coloides y otras superficies en contacto con soluciones o conductores de iones rápidos de estado sólido .
La principal diferencia entre una doble capa en un electrodo y una en una interfaz es el mecanismo de formación de carga superficial . Con un electrodo es posible regular la carga superficial aplicando un potencial eléctrico externo. Esta aplicación, sin embargo, es imposible en capas dobles coloidales y porosas, porque en el caso de partículas coloidales no se tiene acceso al interior de la partícula para aplicar una diferencia de potencial.
Las EDL son análogas a la doble capa del plasma .
Los EDL tienen un parámetro adicional que define su caracterización: la capacitancia diferencial . La capacitancia diferencial, denotada como C , se describe mediante la siguiente ecuación:
donde σ es la carga superficial y ψ es el potencial eléctrico superficial .
Tradicionalmente se ha asumido que la formación de doble capa eléctrica (EDL) está completamente dominada por la adsorción y redistribución de iones. Teniendo en cuenta el hecho de que la electrificación por contacto entre sólido-sólido está dominada por la transferencia de electrones, Wang sugiere que la EDL se forma mediante un proceso de dos pasos. [31] En el primer paso, cuando las moléculas en la solución se acercan por primera vez a una superficie virgen que no tiene cargas superficiales preexistentes, es posible que los átomos/moléculas en la solución interactúen directamente con los átomos en la superficie sólida para Forman una fuerte superposición de nubes de electrones. La transferencia de electrones ocurre primero para hacer que los átomos “neutrales” de la superficie sólida se carguen, es decir, la formación de iones. En el segundo paso, si existen iones en el líquido, como H+ y OH-, los iones negativos distribuidos libremente en la solución serían atraídos para migrar hacia los iones unidos a la superficie debido a interacciones electrostáticas, formando una EDL. Tanto la transferencia de electrones como la transferencia de iones coexisten en la interfaz líquido-sólido. [32]
