La difilobotriasis es la infección causada por tenias del género Diphyllobothrium (comúnmente D. latum y D. nihonkaiense ).
La difilobotriasis se presenta principalmente en regiones donde se consume pescado crudo con regularidad; quienes consumen pescado crudo corren el riesgo de contraer la infección. La infección suele ser asintomática y suele presentarse solo con síntomas leves, que pueden incluir molestias gastrointestinales, pérdida de peso y fatiga. En raras ocasiones, puede producirse deficiencia de vitamina B12 (que puede provocar anemia ) y obstrucciones gastrointestinales . La infección puede durar mucho tiempo si no se trata. La difilobotriasis generalmente se diagnostica buscando huevos o segmentos de tenia en las heces. El tratamiento con medicamentos antiparasitarios es sencillo, eficaz y seguro.
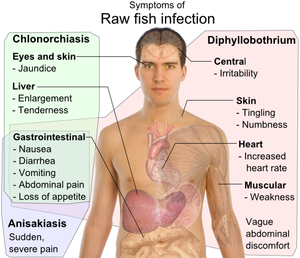
La mayoría de las infecciones (~80% [6] ) son asintomáticas. [6] [7] [8] Las infecciones pueden ser duraderas [7] , persistiendo durante muchos años [6] o décadas (hasta 25 años) [7] si no se tratan.
Los síntomas (cuando están presentes) son generalmente leves. [9] [8] Las manifestaciones pueden incluir dolor y malestar abdominal, diarrea, vómitos, estreñimiento, pérdida de peso y fatiga. [9]
Se han informado/descrito síntomas adicionales, entre ellos dispepsia , distensión abdominal (comúnmente como síntoma de presentación), dolor de cabeza, mialgia y mareos. [8]
Aunque la infección suele ser leve, pueden surgir complicaciones, que dependen de la carga parasitaria y suelen estar relacionadas con la deficiencia de vitamina B12 y otras afecciones de salud relacionadas. [8]
En algunos casos de la enfermedad puede producirse una deficiencia de vitamina B12 con posterior anemia megaloblástica (que es indistinguible de la anemia perniciosa ). [10] La anemia puede a su vez provocar una degeneración combinada subaguda de la médula espinal y un deterioro cognitivo . [8]
D. latum compite con el huésped por la absorción de vitamina B12, [11] absorbiendo alrededor del 80% de la ingesta dietética y causando deficiencia y anemia megaloblástica en alrededor del 40% de los casos. [12] La absorción de vitamina B12 es posible gracias a la posición del parásito , que generalmente se aloja en el yeyuno . [13] Por el contrario, según las investigaciones, la deficiencia de vitamina B12 rara vez se observa en la infección por D. pacificum . [11]
En raras ocasiones, las infecciones masivas pueden provocar obstrucción intestinal. La migración de proglótidos puede causar colecistitis o colangitis . [7]
La difilobotriasis es causada por la infección de varias especies del género Diphyllobothrium . [7]
Los humanos son uno de los huéspedes definitivos de las tenias Diphyllobothrium , junto con otros carnívoros, mamíferos que se alimentan de peces (incluidos cánidos , félidos y osos), mamíferos marinos (delfines, marsopas y ballenas); algunas aves (por ejemplo, las gaviotas) también pueden servir como huéspedes definitivos. [7]
Los huéspedes definitivos liberan los huevos en las heces; los huevos maduran en ~18-20 días si se dan las condiciones favorables. Los crustáceos actúan como los primeros huéspedes intermediarios y se desarrollan las larvas de Diphyllobothrium . Las larvas se liberan cuando los crustáceos son consumidos por los depredadores, que actúan como segundos huéspedes intermediarios (en su mayoría peces pequeños). Las larvas se desplazan hacia tejidos más profundos en el segundo huésped intermediario. Los segundos huéspedes intermediarios no sirven como una fuente importante de infección para los seres humanos, ya que no se consumen crudos con regularidad. El consumo de segundos huéspedes intermediarios infectados por peces depredadores más grandes, que actúan como huéspedes paraténicos; los parásitos migran entonces a la musculatura a la espera de ser consumidos por los huéspedes definitivos en los que las tenias adultas se desarrollarán finalmente en el intestino delgado para liberar hasta un millón de huevos inmaduros por día por parásito. Los huéspedes comienzan a liberar huevos 5-6 semanas después de la infección. [7]
Las tenias se desarrollan en el intestino delgado. Los adultos se adhieren a la mucosa intestinal . Las tenias adultas pueden crecer hasta más de 10 m de longitud y pueden estar formadas por más de 3000 proglótidos [7] que contienen conjuntos de órganos reproductores masculinos y femeninos, lo que permite una alta fecundidad . [8] Los huevos aparecen en las heces entre 5 y 6 semanas después de la infección. [7]
Las tenias D. latum son las más largas y suelen alcanzar una longitud de 4 a 15 m, pero pueden crecer hasta 25 m de longitud dentro del intestino humano. La tasa de crecimiento puede superar los 22 cm/día. Las tenias D. latum presentan un extremo anterior ( escólex ) equipado con surcos de unión en las superficies dorsal y ventral. [8]
Se postula que la difilobotriasis causa cambios en las concentraciones de neuromoduladores en el tejido y el suero del huésped. Se ha demostrado que la infección por D. latum causa cambios locales en el huésped, lo que lleva a una alteración de la función gastrointestinal (incluida la motilidad) a través de la modulación neuroendocrina . [8]
La difilobotriasis provoca la desgranulación de mastocitos y eosinófilos , lo que conduce a la liberación de citocinas proinflamatorias . [8]
La infección puede sospecharse en función de la ocupación, las aficiones, los hábitos alimentarios y los antecedentes de viajes de la persona. [8] Durante los procedimientos de diagnóstico, se aplican las precauciones de seguridad estándar. Los huevos no son directamente infecciosos para los humanos (a diferencia de otras especies de tenia). [7]
El diagnóstico se realiza generalmente mediante la identificación de segmentos de proglótidos o huevos característicos en las heces. [14] Los huevos suelen ser numerosos y pueden detectarse sin técnicas de concentración. La comparación morfológica con otros parásitos intestinales puede emplearse como un enfoque diagnóstico adicional. [ cita requerida ]
Estas técnicas de diagnóstico simples permiten identificar la naturaleza de la infección a nivel de género, lo que suele ser suficiente en un entorno clínico. [6] Aunque es difícil identificar los huevos o proglótidos a nivel de especie, la distinción tiene poca importancia clínica porque, como ocurre con la mayoría de las tenias adultas en el intestino, todos los miembros del género responden a los mismos tratamientos. [ cita requerida ] El tratamiento puede distorsionar las características morfológicas de los tejidos patógenos expulsados y complicar los intentos de diagnóstico morfológico posteriores. [7]
Cuando se necesita determinar la especie exacta (por ejemplo, en estudios epidemiológicos ), se pueden utilizar de manera eficaz los polimorfismos de longitud de fragmentos de restricción. La reacción en cadena de la polimerasa (PCR) se puede realizar en muestras de huevos purificados o en muestras fecales nativas después de la sonicación de los huevos para liberar su contenido. [6] Actualmente, la identificación molecular generalmente solo se utiliza en investigación. [7]
Una posible herramienta de diagnóstico y tratamiento es el medio de contraste gastrografin que, cuando se introduce en el duodeno , permite la visualización del parásito y también se ha demostrado que causa el desprendimiento y la eliminación de todo el parásito. [15]
Se debe evitar la ingestión de pescado de agua dulce crudo. La cocción o congelación adecuadas del pescado de agua dulce destruirán las larvas enquistadas de la tenia del pescado. El pescado que se cocina bien, se pone en salmuera o se congela a -10 °C durante 24 a 48 horas también se puede consumir sin riesgo de infección por D. latum . Se pueden emplear campañas de información de salud pública para educar al público sobre los riesgos de consumir pescado preparado de forma inadecuada . [ cita requerida ]
Debido a que las heces humanas son un mecanismo importante para la propagación de los huevos, la eliminación adecuada de las aguas residuales puede reducir las infecciones de los peces (y, por lo tanto, de los humanos). [ cita requerida ] La prevención de la contaminación del agua se puede lograr tanto mediante la sensibilización del público sobre los peligros de defecar en cuerpos de agua recreativos como mediante la aplicación de medidas básicas de saneamiento y la detección y el tratamiento exitoso de las personas infectadas con el parásito. [6]
Tras el diagnóstico, el tratamiento es sencillo y eficaz. [16] [17] [18]
Praziquantel
El tratamiento estándar para la difilobotriasis (así como muchas otras infecciones por tenia) es una dosis única de praziquantel , 5–10 mg/kg por vía oral una vez para adultos y niños. [16] [17] [18] El praziquantel no está aprobado por la FDA para esta indicación. [16] El praziquantel tiene pocos efectos secundarios, muchos de los cuales son similares a los síntomas de la difilobotriasis. [6]
Niclosamida
Un tratamiento alternativo es la niclosamida , 2 g por vía oral una vez para adultos o 50 mg/kg (máximo 2 g) para niños. [16] [17] [18] La niclosamida no está disponible para uso humano o incluso animal en los Estados Unidos. [16] Los efectos secundarios de la niclosamida son muy raros debido al hecho de que el medicamento no se absorbe en el tracto gastrointestinal. [6]
Otro
Según se informa, el albendazol también puede ser eficaz. [19] [20] La gastrografina puede usarse potencialmente tanto como un método diagnóstico como terapéutico; cuando se introduce en el duodeno permite la visualización del parásito, y también se ha demostrado que causa el desprendimiento y la eliminación de todo el gusano. [21] [22] Durante la década de 1940, el tratamiento preferido era de 6 a 8 gramos de oleorresina de aspidium , que se introducía en el duodeno a través de un tubo de Rehfuss. [23]
Las personas con mayor riesgo de infección han sido tradicionalmente aquellas que consumen regularmente pescado crudo. [6] Si bien personas de cualquier género o edad pueden enfermarse, la mayoría de los casos identificados ocurrieron en hombres de mediana edad. [8]
La difilobotriasis se presenta en áreas donde los lagos y ríos coexisten con el consumo humano de pescado de agua dulce crudo o poco cocido. [24] Dichas áreas se encuentran en Europa , los nuevos estados independientes de la ex Unión Soviética , América del Norte , Asia , Uganda , Perú (debido al ceviche ) y Chile . [24] Muchas cocinas regionales incluyen alimentos crudos o poco cocidos, incluidos el sushi y el sashimi en la cocina japonesa, el carpaccio di persico en Italia, el tartare maison en las poblaciones francófonas, el ceviche en la cocina latinoamericana y el arenque marinado en Escandinavia. Con la emigración y la globalización, la práctica de comer pescado crudo en estos y otros platos ha llevado la difilobotriasis a nuevas partes del mundo y ha creado nuevos focos endémicos de enfermedad. [6]
Las infecciones en Europa y América del Norte se asociaban tradicionalmente con las mujeres judías debido a la costumbre de probar trozos de pescado crudo durante la preparación del plato de pescado gefilte [25] y también se dieron en mujeres escandinavas por la misma razón. Por ello, la difilobotriasis también se conocía como la "enfermedad de las amas de casa judías" o la "enfermedad de las amas de casa escandinavas". [26]
La difilobotriasis nihonkaiense alguna vez fue endémica de las provincias costeras del centro y norte de Japón , donde prosperaban las pesquerías de salmón. [24] En las últimas décadas, las regiones con difilobotriasis nihonkaiense endémica han desaparecido de Japón, aunque se siguen reportando casos entre los habitantes urbanos que consumen sushi o sashimi . [24] En Kioto , se estima que la incidencia anual promedio en los últimos 20 años fue de 0,32/100 000, y que en 2008 fue de 1,0 caso por 100 000 habitantes, lo que sugiere que la infección por D. nihonkaiense es tan prevalente en Japón como lo es D. latum en algunos países europeos. [24]
La enfermedad es poco común en los Estados Unidos. [ cita requerida ]
La tenia del pescado tiene una larga historia documentada de infección de personas que consumen pescado regularmente y especialmente aquellas cuyas costumbres incluyen el consumo de pescado crudo o poco cocinado. En la década de 1970, la mayoría de los casos conocidos de difilobotriasis provenían de Europa (5 millones de casos) y Asia (4 millones de casos), con menos casos provenientes de América del Norte y América del Sur, y no hay datos confiables sobre casos de África o Australia. [6] A pesar del número relativamente pequeño de casos vistos hoy en América del Sur, algunas de las primeras evidencias arqueológicas de difilobotriasis provienen de sitios en América del Sur. Se han encontrado evidencias de Diphyllobothrium spp. en restos humanos de entre 4.000 y 10.000 años de antigüedad en la costa occidental de América del Sur. [27] No hay un momento claro en el que Diphyllobothrium latum y especies relacionadas fueron "descubiertas" en humanos, pero está claro que la difilobotriasis ha sido endémica en las poblaciones humanas durante mucho tiempo. Debido a los cambios en los hábitos alimentarios en muchas partes del mundo, recientemente se han documentado casos autóctonos o adquiridos localmente de difilobotriasis en áreas que anteriormente no eran endémicas, como Brasil. [28] De esta manera, la difilobotriasis representa una enfermedad infecciosa emergente en ciertas partes del mundo donde se están introduciendo prácticas culturales que implican comer pescado crudo o poco cocido. [ cita requerida ]