En cardiología , la remodelación ventricular (o remodelación cardíaca ) [1] se refiere a cambios en el tamaño, la forma, la estructura y la función del corazón . Esto puede suceder como resultado del ejercicio (remodelación fisiológica) o después de una lesión en el músculo cardíaco (remodelación patológica). [2] La lesión generalmente se debe a un infarto agudo de miocardio (generalmente infarto transmural o con elevación del segmento ST), pero puede deberse a varias causas que dan como resultado un aumento de la presión o el volumen , lo que causa una sobrecarga de presión o sobrecarga de volumen (formas de tensión) en el corazón. La hipertensión crónica , la cardiopatía congénita con derivación intracardíaca y la cardiopatía valvular también pueden provocar remodelación. Después de que ocurre la lesión , se producen una serie de cambios histopatológicos y estructurales en el miocardio ventricular izquierdo que conducen a una disminución progresiva del rendimiento ventricular izquierdo. En última instancia, la remodelación ventricular puede dar como resultado una disminución de la función contráctil ( sistólica ) y una reducción del volumen sistólico .
La remodelación fisiológica es reversible, mientras que la remodelación patológica es en su mayor parte irreversible. La remodelación de los ventrículos bajo demanda de presión izquierda/derecha hace que los desajustes sean inevitables. Los desajustes de presión patológicos entre la circulación pulmonar y sistémica guían la remodelación compensatoria de los ventrículos izquierdo y derecho. El término "remodelación inversa" en cardiología implica una mejora en la mecánica y la función ventricular después de una lesión remota o un proceso patológico. [3] [4] [5]
La remodelación ventricular puede incluir hipertrofia ventricular , dilatación ventricular , cardiomegalia y otros cambios. Es un aspecto de la miocardiopatía , de la que existen muchos tipos. La hipertrofia concéntrica se debe a la sobrecarga de presión , mientras que la hipertrofia excéntrica se debe a la sobrecarga de volumen . [6]
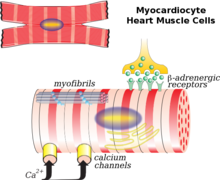
El miocito cardíaco es la célula principal involucrada en la remodelación. Los fibroblastos , el colágeno , el intersticio y los vasos coronarios en menor medida también desempeñan un papel. Un escenario común para la remodelación es después de un infarto de miocardio. Hay necrosis miocárdica (muerte celular) y adelgazamiento desproporcionado del corazón. Esta área delgada y debilitada es incapaz de soportar la carga de presión y volumen en el corazón de la misma manera que el resto del tejido sano. Como resultado, hay una dilatación de la cámara que surge de la región del infarto. La fase de remodelación inicial después de un infarto de miocardio da como resultado la reparación del área necrótica y la cicatrización miocárdica que, hasta cierto punto, puede considerarse beneficiosa ya que hay una mejora o mantenimiento de la función del VI y el gasto cardíaco . Sin embargo, con el tiempo, a medida que el corazón experimenta una remodelación continua, se vuelve menos elíptico y más esférico. La masa y el volumen ventriculares aumentan, lo que en conjunto afecta negativamente a la función cardíaca. Con el tiempo, la función diastólica , o la capacidad del corazón para relajarse entre contracciones, puede verse afectada, lo que provoca un mayor deterioro. [7]
Después de un infarto de miocardio (IM), la muerte de los miocitos cardíacos puede desencadenarse por necrosis , apoptosis o autofagia , lo que lleva al adelgazamiento de la pared cardíaca. [8] Los miocitos cardíacos supervivientes se organizan en paralelo o en serie entre sí, lo que contribuye a la dilatación ventricular o la hipertrofia ventricular, dependiendo del estrés de carga en la pared ventricular. [7] Además, también se cree que la expresión reducida de la miosina V1 y los canales de calcio de tipo L en los miocitos cardíacos causan remodelación cardíaca. En condiciones corporales normales, los ácidos grasos representan del 60 al 90% del suministro de energía del corazón. Después del infarto de miocardio, a medida que disminuye la oxidación de los ácidos grasos, se reduce el suministro de energía para los miocitos cardíacos, la acumulación de ácidos grasos a niveles tóxicos y la disfunción de las mitocondrias . Estas consecuencias también llevaron al aumento del estrés oxidativo en el corazón, lo que provocó la proliferación de fibroblastos , la activación de metaloproteinasas y la inducción de la apoptosis, que se explicará a continuación. Además, la respuesta inmune inflamatoria después de un infarto de miocardio también contribuye a los cambios mencionados anteriormente. [8]
Además, el intersticio cardíaco, que consiste principalmente en fibras de colágeno de tipo I y tipo III, también está involucrado en la remodelación cardíaca. El colágeno cardíaco es sintetizado por fibroblastos y degradado por metaloproteinasas. [7] Los fibroblastos se activan después del infarto de miocardio, lo que conduce a un aumento de la síntesis de colágeno y fibrosis del corazón. [8] El aumento de la expresión de MMP1 y MMP9 condujo a la degradación de las fibras de colágeno y, posteriormente, a la dilatación del corazón. [7] Se sabe que varias vías de señalización, como la angiotensina II , el factor de crecimiento transformante beta (TGF-beta) y la endotelina 1 , desencadenan la síntesis y degradación de las fibras de colágeno en el corazón. [8]
Otros factores, como la hipertensión arterial, la activación del sistema simpático que libera noradrenalina , la activación del sistema renina-angiotensina que libera renina y hormonas antidiuréticas, contribuyen de manera importante a la remodelación cardíaca. Sin embargo, se cree que el péptido natriurético auricular es cardioprotector. [7]
La remodelación del corazón se evalúa mediante un ecocardiograma . Mediante esta prueba se puede caracterizar el tamaño y la función de las aurículas y los ventrículos. [ cita requerida ]
Muchos factores influyen en la evolución temporal y la extensión de la remodelación, incluida la gravedad de la lesión, los eventos secundarios (isquemia recurrente o infarto), la activación neurohormonal , los factores genéticos y la expresión génica , y el tratamiento. Los medicamentos pueden atenuar la remodelación. Se ha demostrado de forma consistente que los inhibidores de la enzima convertidora de angiotensina (ECA) disminuyen la remodelación en modelos animales o infarto transmural y sobrecarga de presión crónica. Los ensayos clínicos han demostrado que la terapia con inhibidores de la ECA después del infarto de miocardio conduce a un mejor rendimiento miocárdico, una mejor fracción de eyección y una disminución de la mortalidad en comparación con los pacientes tratados con placebo. Asimismo, la inhibición de la aldosterona , ya sea directa o indirectamente, conduce a una mejora en la remodelación. [9] El carvedilol , un betabloqueante de tercera generación , puede revertir el proceso de remodelación al reducir los volúmenes ventriculares izquierdos y mejorar la función sistólica. [10] [11] La terapia de resincronización cardíaca (TRC) ha demostrado la capacidad de revertir la remodelación ventricular izquierda en algunos pacientes. [12] [13] La corrección temprana de los defectos cardíacos congénitos, si es adecuada, puede prevenir la remodelación, al igual que el tratamiento de la hipertensión crónica o la enfermedad cardíaca valvular . A menudo, también se observará una remodelación inversa o una mejora en la función del ventrículo izquierdo. [ cita requerida ]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )