Tujona ( / ˈ θ uː dʒ oʊ n / [2]) es unacetonay unmonoterpenoque se presenta predominantemente en dosdiastereoméricas(epiméricas):(-)-α-tujonay(+)-β-tujona.[3][4]
Aunque es más conocido como un compuesto químico del espíritu de absenta , es poco probable que sea responsable de los supuestos efectos estimulantes y psicoactivos de la absenta debido a las pequeñas cantidades presentes. [5] [6] [7]
La tujona actúa sobre el receptor GABA A como antagonista. Como antagonista competitivo del receptor GABA A , la tuyona sola se considera convulsiva , [8] aunque al interferir con el transmisor inhibidor GABA, puede transmitir efectos estimulantes que mejoran el estado de ánimo en dosis bajas. [ cita necesaria ] También se encuentra en perfumería como componente de varios aceites esenciales. [ cita necesaria ]
Además de las naturales (-)-α-tujona y (+)-β-tujona, son posibles otras dos formas: (+)-α-tujona y (-)-β-tujona . En 2016, también se encontraron en la naturaleza, [9] en Salvia officinalis .
La tujona se encuentra en varias plantas, como la arborvitae (género Thuja , de ahí la derivación del nombre), el ciprés de Nootka , algunos enebros , la artemisa , el orégano , la salvia común , el tanaceto y el ajenjo , sobre todo el ajenjo ( Artemisia absinthium ). , generalmente como una mezcla de isómeros en una proporción de 1:2. También se encuentra en varias especies de Mentha (menta).
La biosíntesis de tuyona es similar a la síntesis de otros monoterpenos y comienza con la formación de difosfato de geranilo (GPP) a partir de pirofosfato de dimetilalilo (DMAPP) y difosfato de isopentenilo (IPP), catalizada por la enzima geranil difosfato sintasa. [10] El análisis espectroscópico cuantitativo de 13 C NMR ha demostrado que las unidades de isopreno utilizadas para formar tuyona en las plantas se derivan de la vía del fosfato de metileritritol (MEP). [11]
Las reacciones que generan el esqueleto de tuyona en el sabineno a partir de GPP están mediadas por la enzima sabineno sintasa que tiene GPP como sustrato. [10] El GPP ( 1 ) primero se isomeriza a linalilo difosfato (LPP) ( 2 ) y neril difosfato (NPP) ( 3 ). El LPP forma preferentemente un catión difosfato alílico deslocalizado ( 4 ). El intermedio del par iónico luego se cicla en una adición electrófila para producir el catión terciario α-terpinilo ( 5 ). [10]
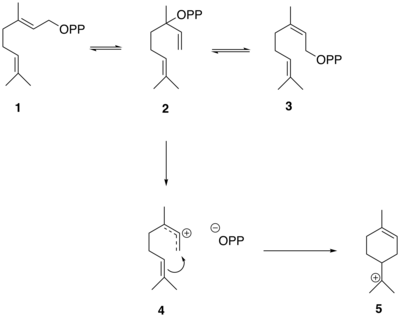
El catión α-terpinilo ( 5 ) luego sufre un cambio de hidruro 1,2 mediante un reordenamiento de Wagner-Meerwein , lo que lleva a la formación del catión terpinen-4-ilo ( 6 ). Este catión sufre una segunda ciclación para formar el catión tujilo intermedio ( 7 ) antes de la pérdida de un protón para formar el precursor de tujona, (+)-sabino ( 8 ).
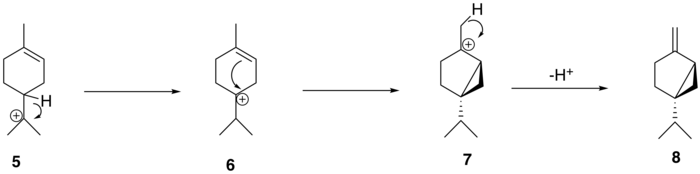
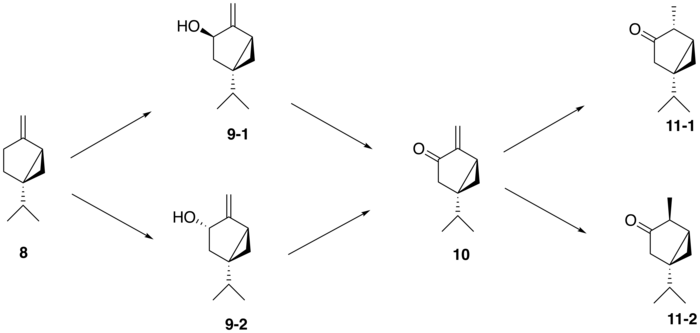
A partir de (+)-sabineno ( 8 ), la ruta biosintética propuesta para generar tuyona sigue una ruta de tres pasos: (+)-sabineno se oxida primero a un isómero de (+)-sabinol ( 9-1 , 9-2 ). por una enzima citocromo P450 , seguido de la conversión a (+)-sabinona ( 10 ) mediante una deshidrogenasa . Finalmente, una reductasa media la conversión a α-tujona ( 11-1 ) y β-tujona ( 11-2 ). [12] La isomería del intermedio (+)-sabinol varía entre las plantas productoras de tujona; por ejemplo, en el cedro rojo occidental ( Thuja plicata ), la tujona se deriva exclusivamente del intermedio (+)- trans -sabinol ( 9-1 ), mientras que en la salvia común ( Salvia officinalis ), la tujona se forma a partir del (+) - intermedio cis -sabinol ( 9-2 ). [13]

Según estudios que analizaban únicamente la forma molecular, durante muchos años se pensó que la tuyona actuaba de manera similar al THC en los receptores cannabinoides ; [14] sin embargo, desde entonces se ha demostrado que esto es falso. [15] La tujona es un antagonista del receptor GABA A [16] y , más específicamente, un antagonista competitivo del receptor GABA A. Al inhibir la activación del receptor GABA, las neuronas pueden activarse más fácilmente, lo que puede provocar espasmos musculares y convulsiones. [17] Esta interacción con el receptor GABA A es específica de la alfa-tujona. [18] La tujona también es un antagonista de 5-HT 3 . [19] [20]
La dosis letal media , o LD50 , de α-tujona, el más activo de los dos isómeros, en ratones, es de alrededor de 45 mg/kg, con una tasa de mortalidad del 0 % con 30 mg/kg y del 100 % con 60 mg/kg. . Los ratones expuestos a la dosis más alta sufren convulsiones que provocan la muerte en 1 minuto. De 30 a 45 mg/kg, los ratones experimentan espasmos musculares en las piernas, que progresan a convulsiones generales hasta la muerte o la recuperación. Estos efectos están en línea con otros antagonistas de GABA. Además, la α-tujona se metaboliza rápidamente en el hígado de ratones. [17] El tratamiento previo con moduladores alostéricos positivos para GABA como diazepam , fenobarbital o 1 g/kg de etanol protege contra una dosis letal de 100 mg/kg. [ cita necesaria ]
El rendimiento de la atención se ha probado con dosis altas y bajas de tuyona en alcohol. La dosis alta tuvo un efecto negativo a corto plazo sobre el rendimiento de la atención. La dosis más baja no mostró ningún efecto notable. [5]
La tujona es reportada [ ¿por quién? ] es tóxico para las células del cerebro, los riñones y el hígado y podría causar convulsiones si se usa en dosis demasiado altas. Otras plantas que contienen tujona, como el árbol de la vida ( Thuja occidentalis ), se utilizan en la medicina herbaria, principalmente por sus supuestos efectos estimulantes del sistema inmunológico [ cita requerida ] . Los efectos secundarios del aceite esencial de esta planta incluyen ansiedad, insomnio y convulsiones, lo que confirma los efectos de la tuyona sobre el sistema nervioso central. [8] [21]
La tujona es más conocida por ser un compuesto del espíritu de absenta . En el pasado, se pensaba que la absenta contenía entre 260 y 350 mg/l de tuyona, [22] pero las pruebas modernas han demostrado que esta estimación es demasiado alta. Un estudio de 2008 de 13 botellas anteriores a la prohibición (1895-1910) utilizando cromatografía de gases y espectrometría de masas (GC-MS) encontró que las botellas tenían entre 0,5 y 48,3 mg/L y un promedio de 25,4 mg/L [6] [23] A Un estudio de 2005 recreó tres recetas de 1899 con alto contenido de ajenjo y las probó con GC-MS, y encontró que la más alta contenía 4,3 mg/L de tuyona. [24] Las pruebas de GC-MS son importantes en esta capacidad, porque la cromatografía de gases por sí sola puede registrar una lectura alta e inexacta de tuyona, ya que otros compuestos pueden interferir y aumentar la cantidad aparente medida. [25]
El compuesto fue descubierto después de que la absenta se hiciera popular a mediados del siglo XIX. Valentin Magnan , que estudió el alcoholismo, probó el aceite puro de ajenjo en animales y descubrió que provocaba convulsiones independientemente de los efectos del alcohol. En base a esto, se suponía que la absenta, que contiene una pequeña cantidad de aceite de ajenjo, era más peligrosa que el alcohol común. Finalmente, se aisló la tuyona como la causa de estas reacciones. Magnan estudió a 250 personas que abusaban del alcohol y observó que quienes bebían absenta padecían convulsiones y alucinaciones . Las convulsiones son causadas por la interacción de la (+)-α-tujona con los receptores GABA, provocando actividad epiléptica. [18] A la luz de la evidencia moderna, estas conclusiones son cuestionables, ya que se basan en una comprensión deficiente de otros compuestos y enfermedades, [26] y están empañadas por la creencia de Magnan de que el alcohol y el ajenjo estaban degenerando la raza francesa. [27]
Después de que se prohibió la absenta, la investigación decayó hasta la década de 1970, cuando la revista científica británica Nature publicó un artículo comparando la forma molecular de la tujona con el tetrahidrocannabinol (THC), la principal sustancia psicoactiva que se encuentra en el cannabis , y planteó la hipótesis de que actuaría de la misma manera en el cerebro, lo que generó el mito de que la tuyona era un cannabinoide . [14] [28]
Más recientemente, siguiendo la Directiva del Consejo Europeo No. 88/388/EEC (1988) que permite ciertos niveles de tuyona en los productos alimenticios en la UE, [29] se realizaron los estudios descritos anteriormente y encontraron sólo niveles mínimos de tuyona en la absenta.
Los niveles máximos de tuyona en la UE son: [30] [31]
En los Estados Unidos, no se permite agregar tuyona pura a los alimentos. [32] Los alimentos o bebidas que contienen especies de Artemisia , cedro blanco , musgo de roble , tanaceto o milenrama deben estar libres de tujona, [33] lo que en la práctica significa que contienen menos de 10 partes por millón de tujona. [34] Otras hierbas que contienen tuyona no tienen restricciones. Por ejemplo, la salvia y el aceite de salvia (que puede contener hasta un 50% de tuyona) están en la lista de sustancias generalmente reconocidas como seguras (GRAS) de la Administración de Alimentos y Medicamentos . [35]
La absenta que se ofrece a la venta en los Estados Unidos debe estar libre de tujona según el mismo estándar que se aplica a otras bebidas que contienen artemisia, [34] por lo que la absenta con pequeñas cantidades de tujona puede importarse legalmente.
En Canadá, las leyes sobre bebidas alcohólicas son competencia de los gobiernos provinciales. Alberta, Ontario y Nueva Escocia permiten 10 mg/kg de tuyona; Quebec permite 15 mg por kg; [ cita necesaria ] Manitoba permite de 6 a 8 mg de tuyona por litro; Columbia Británica se adhiere a los mismos niveles que Ontario. Sin embargo, en Saskatchewan y Quebec se puede comprar cualquier licor disponible en el mundo con la compra de un máximo de una caja, generalmente 12 botellas de 750 ml o 9 litros. Las juntas de licores individuales deben aprobar cada producto antes de que pueda venderse en estantes.