Las toxinas AB 5 son complejos proteicos de seis componentes secretados por ciertas bacterias patógenas que se sabe que causan enfermedades humanas como el cólera , la disentería y el síndrome hemolítico-urémico . Un componente se conoce como subunidad A y los cinco componentes restantes son subunidades B. Todas estas toxinas comparten una estructura y un mecanismo similares para ingresar a las células huésped específicas. La subunidad B es responsable de unirse a los receptores para abrir una vía para que la subunidad A ingrese a la célula. La subunidad A luego puede usar su maquinaria catalítica para hacerse cargo de las funciones regulares de la célula huésped. [1] [2]



Existen cuatro familias principales de la toxina AB5, que se caracterizan por la secuencia de su subunidad A (catalítica), así como por su actividad catalítica. [4]
Esta familia también se conoce como Ct o Ctx, y también incluye la enterotoxina termolábil , conocida como LT. [5] Muchos atribuyen el descubrimiento de la toxina del cólera al Dr. Sambhu Nath De . Realizó su investigación en Calcuta (ahora Kolkata ) y realizó su descubrimiento en 1959, aunque Robert Koch la purificó por primera vez en 1883. La toxina del cólera está compuesta por un complejo proteico que secreta la bacteria Vibrio cholerae . [6] Algunos síntomas de esta toxina incluyen diarrea acuosa crónica y generalizada y deshidratación que, en algunos casos, conduce a la muerte.
Esta familia también se conoce como Ptx y contiene la toxina responsable de la tos ferina . La toxina de la tos ferina es secretada por la bacteria gramnegativa , Bordetella pertussis . La tos ferina es muy contagiosa y los casos están aumentando lentamente en los Estados Unidos a pesar de la vacunación. [7] Los síntomas incluyen tos paroxística con espasmos e incluso vómitos. [8] La bacteria Bordetella pertussis fue identificada por primera vez como la causa de la tos ferina y aislada por Jules Bordet y Octave Gengou en Francia en 1900. [9] La toxina comparte su mecanismo con la toxina del cólera. [5]
La toxina ArtAB de Salmonella enterica tiene componentes similares a los que se encuentran en dos familias diferentes: la subunidad ArtA ( Q404H4 ) es homóloga con la toxina A de la tos ferina, mientras que la subunidad ArtB ( Q404H3 ) es homóloga con la subunidad B, así como con las proteínas que se encuentran en otras cepas de Salmonella . Según la regla de categorización por A, es una toxina de la familia Ptx. [10] [4]
La toxina Shiga, también conocida como Stx, es una toxina producida por las bacterias Shigella dysenteriae y Escherichia coli (STEC), que tienen forma de bastón. Los alimentos y bebidas contaminados con estas bacterias son la fuente de infección y el medio por el cual se propaga esta toxina. [11] Los síntomas incluyen dolor abdominal y diarrea acuosa. Los casos graves que ponen en peligro la vida se caracterizan por colitis hemorrágica (HC). [12] El descubrimiento de la toxina Shiga se atribuye al Dr. Kiyoshi Shiga en 1898.
Esta familia también se conoce como SubAB [4] y fue descubierta durante la década de 1990. [13] Es producida por cepas de STEC que no tienen el locus de borramiento de enterocitos (LEE), [14] y se sabe que causa el síndrome hemolítico-urémico (SHU). Se llama citotoxina subtilasa porque su secuencia de subunidad A es similar a la de una serina proteasa similar a la subtilasa en Bacillus anthracis . Algunos síntomas causados por esta toxina son una disminución en el recuento de plaquetas en la sangre o trombocitopenia , un aumento en el recuento de glóbulos blancos o leucocitosis y daño en las células renales . [15]
La subunidad A de la citotoxina subtilasa (subA, Q6EZC2 ) es una proteasa que escinde la proteína de unión a inmunoglobulina (BiP), lo que provoca estrés en el retículo endoplásmico y muerte celular. Las subunidades B (subB, Q6EZC3 ) se unen a los glicanos del ácido N-glicolilneuramínico (Neu5Gc) en las células con alta afinidad. [16] Solo la subB es suficiente para provocar la vacuolización de las células vero. [17] Los seres humanos no producen Neu5GC, sino que se adquiere a partir de fuentes alimenticias como la carne roja y los productos lácteos, también fuentes frecuentes de infecciones por STEC, en el revestimiento intestinal humano. [18]
Un complejo de toxina AB5 completo contiene seis unidades proteicas. Cinco unidades son similares o idénticas en estructura y comprenden la subunidad B. La última unidad proteica es única y se conoce como subunidad A.


La subunidad A de una toxina AB5 es la porción responsable de la catálisis de objetivos específicos. Para la familia de toxinas Shiga, la subunidad A alberga una región sensible a la tripsina que emite dos dominios fragmentados cuando se escinde. Esta región aún no se ha confirmado para las otras familias de toxinas AB5. [2] En general, los dos dominios de la subunidad A, llamados A1 y A2, están unidos por un enlace disulfuro . El dominio A1 (aproximadamente 22 kDa en la toxina del cólera o enterotoxinas termolábiles) es la parte de la toxina responsable de sus efectos tóxicos. El dominio A2 (aproximadamente 5 kDa en la toxina del cólera o enterotoxina termolábil) proporciona un enlace no covalente a la subunidad B a través del poro central de la subunidad B. [5] La cadena A1 de la toxina del cólera cataliza la transferencia de ADP-ribosa desde el dinucleótido de nicotinamida y adenina (NAD) a la arginina u otros compuestos de guanidina mediante la utilización de factores de ribosilación de ADP (ARF). En ausencia de arginina o compuestos de guanidina simples, la actividad de la nucleosidasa NAD+ (NADasa) mediada por la toxina se lleva a cabo utilizando agua como nucleófilo . [19]
Las subunidades B forman un anillo pentamérico de cinco miembros, donde un extremo de la subunidad A entra y se mantiene. Este anillo de la subunidad B también es capaz de unirse a un receptor , generalmente una glicoproteína o un glicolípido, [5] en la superficie de la célula huésped. [20] Sin las subunidades B, la subunidad A no tiene forma de unirse o ingresar a la célula y, por lo tanto, no tiene forma de ejercer su efecto tóxico. La toxina del cólera, la toxina Shiga y la toxina SubAB tienen subunidades B que se componen de cinco componentes proteicos idénticos, lo que significa que sus subunidades B son homopentámeros. La toxina pertussis es diferente, ya que su anillo pentamérico está formado por cuatro componentes proteicos diferentes, donde uno de los componentes se repite para formar un heteropentámero. [5]
La toxina del cólera, la toxina de la tos ferina y la toxina Shiga tienen sus objetivos en el citosol de la célula. Después de que su subunidad B se une a los receptores en la superficie celular, la toxina queda envuelta por la célula y transportada al interior mediante endocitosis dependiente de clatrina o endocitosis independiente de clatrina . [21]
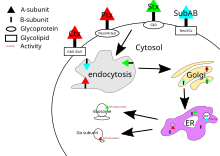
En el caso de la toxina del cólera, el principal receptor de glucolípidos para la toxina del cólera es el gangliósido GM1 . [20] Después de la endocitosis al aparato de Golgi , la toxina se redirige al retículo endoplasmático . [5] Para que la subunidad A alcance su objetivo, se debe romper un enlace disulfuro entre el dominio A1 y A2. Esta ruptura es catalizada por una proteína disulfuro-isomerasa [22] que se encuentra en el retículo endoplasmático. Después de la separación, el dominio A1 se despliega y se redirige de nuevo al citosol, donde se repliega [5] y cataliza la ADP-ribosilación de ciertas subunidades alfa de la proteína G. Al hacerlo, los efectos posteriores de la vía de transducción de señales de la proteína G se interrumpen [4] al activar la adenilato ciclasa . [20] Esto provoca una mayor concentración de AMPc en la célula, lo que interrumpe la regulación de los mecanismos de transporte de iones. [5]
La toxina de la tos ferina no tiene un receptor específico y se une a las glicoproteínas sialiladas . [13] Después de la endocitosis, el mecanismo de la toxina de la tos ferina es el mismo que el de la toxina del cólera.
El principal receptor de la toxina Shiga es la globotriaosilceramida o Gb3. [23] La toxina Shiga también es transportada al aparato de Golgi antes de ser dirigida al retículo endoplásmico para que la PDI rompa el enlace disulfuro. La subunidad A de la toxina Shiga es luego devuelta al citosol e inhibe la síntesis de proteínas eucariotas con su actividad de ARN N-glicosidasa [4] al escindir una base de adenina específica en el ARN ribosómico 28S [5] que finalmente causará la muerte celular.
El objetivo de SubAB está en el retículo endoplásmico de la célula y se introduce en la célula a través de la endocitosis mediada por clatrina . [20] El receptor de glicano para SubAB generalmente termina con un ácido N-glicolilneuramínico unido a α2-3 (Neu5Gc). [13] SubAB tiene una subunidad A donde actúa como una serina proteasa y escinde Bip/GRP78 , una chaperona del retículo endoplásmico . [4] La escisión de esta chaperona causa estrés celular a través de la inhibición de proteínas, [14] y, en consecuencia, la muerte de la célula. [5]
Las subunidades B de las toxinas AB5 tienen afinidad por unirse a los glicanos , característica que algunos tipos de tumores parecen poseer, lo que las convierte en un blanco fácil. Un ejemplo es el de StxB , que se une específicamente a CD77 (Gb3), que muestra expresión en la superficie de células cancerosas como las de colon, páncreas, mama y muchas más. Una vez que StxB se dirige a una célula cancerosa, libera la subunidad A de la toxina que finalmente mata a la célula cancerosa. [5]
Otro método consiste en utilizar fármacos que inducen estrés en el ER, que se han probado en ratones y han demostrado respuestas sinérgicas positivas. Esto se logra mediante la fusión del factor de crecimiento epidérmico (EGF) con la subunidad A de SubAB. Las células cancerosas que expresan receptores para EGF experimentarán toxicidad por SubAB. [24]
Otro uso de las toxinas AB5 es el uso de miembros de la familia LT como adyuvantes . Esto permite que la toxina promueva respuestas inmunológicas como IgG2a, IgA y Th17 para combatir, por ejemplo, la infección gástrica por Helicobacter pylori cuando se administra una vacuna . [25] [26]
Además de que algunas de estas toxinas AB5 se utilizan para crear vacunas para prevenir infecciones bacterianas, también se están investigando para que funcionen como conjugado para prevenir infecciones virales. Por ejemplo, la inmunización sistémica junto con la administración intranasal conjunta de la vacuna conjugada de toxina del cólera y el virus indujo una respuesta de anticuerpos específicos contra el virus y mostró cierto grado de protección del tracto respiratorio superior contra el virus Sendai . [27]
Los nuevos avances en métodos experimentales biotecnológicos, como el uso de la microscopía de iluminación del plano de haz de Bessel y las moléculas sensoras basadas en FRET, pueden demostrar mejor las estructuras dinámicas de las placas de unión en hendidura . Para estos experimentos, se pueden utilizar diferentes tipos de toxinas AB5 para inducir la formación rápida de tCDR en células de E. coli. La respuesta se puede registrar luego utilizando fluctuaciones de concentración de AMPc en células acopladas a uniones en hendidura utilizando construcciones de sensores basadas en FRET. La investigación sugiere que las CDR podrían quizás estar vinculadas con la rápida reorganización de lípidos y proteínas en los canales de conexina dentro de las placas de unión en hendidura. Esto puede ayudarnos a comprender mejor la cascada de señalización que sigue a una pérdida celular de K+ cuando se expone a una infección bacteriana. [28] [29]
Se ha observado que la toxina SubAB muestra especificidad para una proteína de unión, BiP . Esta característica se ha utilizado para estudiar el papel de la propia BiP celular, junto con la degradación asociada al retículo endoplasmático en células HeLa estresadas . [5]