
Los iluros de azometina son 1,3-dipolos basados en nitrógeno , que consisten en un ion iminio junto a un carbanión . Se utilizan en reacciones de cicloadición 1,3-dipolar para formar heterociclos de cinco miembros , incluidas las pirrolidinas y las pirrolinas . [1] [2] [3] Estas reacciones son altamente estereo- y regioselectivas , y tienen el potencial de formar cuatro nuevos estereocentros contiguos. Por lo tanto, los iluros de azometina tienen una gran utilidad en la síntesis total y la formación de ligandos quirales y productos farmacéuticos . Los iluros de azometina se pueden generar a partir de muchas fuentes, incluidas las aziridinas, las iminas y los iminios. A menudo se generan in situ y se hacen reaccionar inmediatamente con dipolarófilos.
Las estructuras de resonancia que se muestran a continuación muestran la contribución del dipolo 1,3 , en la que los dos átomos de carbono adyacentes al nitrógeno tienen una carga negativa o positiva. [1] La representación más común de los iluros de azometina es aquella en la que el nitrógeno tiene carga positiva y la carga negativa se comparte entre los dos átomos de carbono. Las contribuciones relativas de las diferentes estructuras de resonancia dependen de los sustituyentes de cada átomo. Los sustituyentes que atraen electrones que contienen carbono tendrán una carga negativa más parcial, debido a la capacidad del grupo cercano que atrae electrones para estabilizar la carga negativa.
Son posibles tres formas diferentes de iluros, cada una de las cuales conduce a una estereoquímica diferente en los productos de las reacciones de cicloadición 1,3-dipolar . Son posibles iluros en forma de W, en forma de U y en forma de S. [1] Los iluros en forma de W y U, en los que los sustituyentes R están en el mismo lado, dan como resultado productos de cicloadición sin , mientras que los iluros en forma de S dan como resultado productos anti . En los ejemplos siguientes, el lugar donde termina el sustituyente R 3 en el producto depende de la naturaleza estérica y electrónica del sustituyente (véase regioselectividad de cicloadiciones 1,3-dipolares ). La estereoquímica de R 1 y R 2 en el producto de cicloadición se deriva del dipolo. La estereoquímica de R 3 se deriva del dipolarófilo: si el dipolarófilo es más que monosustituido (y proquiral ), pueden dar como resultado hasta cuatro nuevos estereocentros en el producto.

Los iluros de azometina se pueden generar a partir de la apertura del anillo de aziridinas . [4] [5] De acuerdo con las reglas de Woodward-Hoffmann , la apertura térmica del anillo de cuatro electrones se realiza a través de un proceso conrotatorio , mientras que la reacción fotoquímica es disrotatoria.

En esta reacción de apertura de anillo, existe un problema de torqueselectividad . Los sustituyentes electronegativos prefieren rotar hacia afuera, hacia el mismo lado que el sustituyente R en el nitrógeno, mientras que los sustituyentes electropositivos prefieren rotar hacia adentro. [6]
Téngase en cuenta que con las aziridinas, la apertura del anillo puede dar como resultado un dipolo 1,3 diferente , en el que se rompe un enlace C–N (en lugar del enlace C–C). [7]

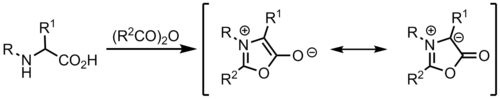
Uno de los métodos más sencillos para formar iluros de azometina es mediante la condensación de un aldehído con una amina . Si la amina contiene un grupo que atrae electrones en el carbono alfa, como un éster , la desprotonación se produce fácilmente. Una posible desventaja de utilizar este método es que el éster termina en el producto de cicloadición. Una alternativa es utilizar un ácido carboxílico , que puede eliminarse fácilmente durante el proceso de cicloadición mediante descarboxilación . [8]

Los iluros de azometina también pueden formarse directamente por desprotonación de iminios.

Los reactivos metálicos utilizados en esta reacción incluyen bromuro de litio y acetato de plata . [1] En este método, el metal se coordina con el nitrógeno para activar el sustrato para la desprotonación. Otra forma de formar iluros de azometina a partir de iminas es mediante prototropía y alquilación .
Los iluros se pueden formar a partir de münchnonas , que son heterociclos mesoiónicos , y actúan como iluros de azometino cíclicos. [9]

Al igual que con otras reacciones de cicloadición de un 1,3-dipolo con un sistema π, la cicloadición 1,3-dipolar que utiliza un iluro de azometino es un proceso de seis electrones. Según las reglas de Woodward-Hoffmann , esta adición es suprafacial con respecto tanto al dipolo como al dipolarófilo . La reacción generalmente se considera como concertada , en la que los dos enlaces carbono-carbono se forman al mismo tiempo, pero de forma asincrónica. Sin embargo, dependiendo de la naturaleza del dipolo y el dipolarófilo, son posibles intermediarios dirradicales o zwitteriónicos . [10] El producto endo generalmente es favorecido, como en la reacción isoelectrónica de Diels-Alder . En estas reacciones, el iluro de azometino es típicamente el HOMO y el dipolarófilo deficiente en electrones el LUMO, aunque se sabe que ocurren reacciones de cicloadición con sistemas π no activados, especialmente cuando la ciclización es intramolecular. [11] Para una discusión de la teoría de orbitales moleculares fronterizos de cicloadiciones 1,3-dipolares, véase Cicloadición 1,3-dipolar#Teoría de orbitales moleculares fronterizos .

Las reacciones de cicloadición 1,3-dipolar de iluros de azometina suelen utilizar alquenos o alquinos como dipolarófilos para formar pirrolidinas o pirrolinas , respectivamente. Arriba se muestra una reacción de un iluro de azometina con un alqueno, que da como resultado una pirrolidina. [12] Este tipo de reacciones se pueden utilizar para sintetizar ulazina. [13] Aunque los dipolarófilos son normalmente compuestos carbonílicos α,β-insaturados , ha habido muchos avances recientes en el desarrollo de nuevos tipos de dipolarófilos. [14]
Cuando el dipolo y el dipolarófilo forman parte de la misma molécula, una reacción de ciclización intramolecular puede dar lugar a un producto policíclico de considerable complejidad. [1] Si el dipolarófilo está unido a un carbono del dipolo, se forma una bicarbonato fusionado. Si está unido al nitrógeno, se obtiene una estructura en forma de puente. La naturaleza intramolecular de la reacción también puede ser útil, ya que la regioselectividad suele verse limitada. Otra ventaja de las reacciones intramoleculares es que el dipolarófilo no necesita ser deficiente en electrones; se han descrito muchos ejemplos de reacciones de ciclización con dipolarófilos sustituidos con alquilo y ricos en electrones, incluida la síntesis de ácido martinélico que se muestra a continuación.
A diferencia de la mayoría de las reacciones de cicloadición 1,3-dipolar, en las que la estereoquímica del dipolo se pierde o es inexistente, los iluros de azometina pueden conservar su estereoquímica. Esto se hace generalmente mediante la apertura del anillo de una aziridina y su posterior captura por un dipolarófilo antes de que la estereoquímica pueda alterarse.
Al igual que otras reacciones de cicloadición 1,3-dipolar, las cicloadiciones de iluro de azometina pueden formar productos endo o exo. Esta selectividad se puede ajustar mediante catálisis metálica. [15] [16]
La cicloadición enantioselectiva de iluros de azometina utilizando catalizadores quirales fue descrita por primera vez en un trabajo seminal de Allway y Grigg en 1991. [17] Este poderoso método fue desarrollado posteriormente por Jørgensen y Zhang. Estas reacciones generalmente utilizan complejos de zinc , plata , cobre , níquel y calcio .
Utilizando catalizadores de fosfina quirales , se pueden sintetizar espiroindolinonas enantioméricamente puras. El método descrito por Gong, et al. conduce a un resultado regioquímico inesperado que no sigue los efectos electrónicos. Esto se atribuye al apilamiento pi favorable con el catalizador. [18]
Los iluros de azometina conjugados son capaces de electrociclarse [1,5] y [1,7] . [19] A continuación se muestra un ejemplo de una electrociclación [1,7] de un iluro de azometina sustituido con difeniletenilo. Este cierre de anillo conrotatorio es seguido por un desplazamiento suprafacial del [1,5]-hidruro, que produce el producto rearomatizado. La estérica y la geometría del anillo de fenilo que reacciona desempeñan un papel importante en el éxito de la reacción. [20]

Los compuestos resultantes de este tipo de electrociclación se han utilizado como dienos en reacciones de Diels-Alder para unir compuestos a fulerenos . [21]

En la síntesis total de ácido martinelico se utilizó una cicloadición de un iluro de azometina con un alqueno inactivado. El paso de cicloadición formó dos anillos, que incluían una pirrolidina , y dos estereocentros. [22]

En la síntesis de espirotripsotatina B , se forma un iluro de azometina a partir de la condensación de una amina con un aldehído . El iluro luego reacciona con un alqueno deficiente en electrones en una indolinona, lo que da como resultado la formación de una pirrolidina espirocíclica y cuatro estereocentros contiguos. [23]
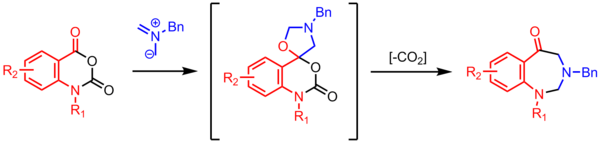
La ciclización de un iluro de azometina con un carbonilo produce una oxazolidina espirocíclica , que pierde CO2 para formar un anillo de siete miembros. Estas reacciones descarboxilativas de múltiples pasos de alta utilidad son comunes en la química del iluro de azometina. [24]