
En bioquímica , una fosfatasa es una enzima que utiliza agua para escindir un monoéster de ácido fosfórico en un ion fosfato y un alcohol . Debido a que una enzima fosfatasa cataliza la hidrólisis de su sustrato , es una subcategoría de las hidrolasas . [1] Las enzimas fosfatasas son esenciales para muchas funciones biológicas, porque la fosforilación (por ejemplo, por las proteínas quinasas ) y la desfosforilación (por las fosfatasas) cumplen diversas funciones en la regulación y señalización celular . [2] Mientras que las fosfatasas eliminan los grupos fosfato de las moléculas, las quinasas catalizan la transferencia de grupos fosfato a moléculas desde el ATP . Juntas, las quinasas y las fosfatasas dirigen una forma de modificación postraduccional que es esencial para la red reguladora de la célula. [3]
Las enzimas fosfatasas no deben confundirse con las enzimas fosforilasas , que catalizan la transferencia de un grupo fosfato desde el fosfato de hidrógeno a un aceptor. Debido a su prevalencia en la regulación celular, las fosfatasas son un área de interés para la investigación farmacéutica. [4] [5]

Las fosfatasas catalizan la hidrólisis de un fosfomonoéster, eliminando una fracción de fosfato del sustrato. El agua se divide en la reacción, con el grupo -OH uniéndose al ion fosfato y el H+ protonando el grupo hidroxilo del otro producto. El resultado neto de la reacción es la destrucción de un fosfomonoéster y la creación tanto de un ion fosfato como de una molécula con un grupo hidroxilo libre. [4]
Las fosfatasas son capaces de desfosforilar sitios aparentemente diferentes en sus sustratos con gran especificidad. La identificación del "código de la fosfatasa", es decir, los mecanismos y reglas que gobiernan el reconocimiento del sustrato por parte de las fosfatasas, todavía es un trabajo en progreso, pero ya está disponible el primer análisis comparativo de todas las fosfatasas proteínicas codificadas en nueve genomas de "fosfatomas" eucariotas . [6] Los estudios revelan que las llamadas "interacciones de acoplamiento" desempeñan un papel significativo en la unión del sustrato. [3] Una fosfatasa reconoce e interactúa con varios motivos (elementos de estructura secundaria) en su sustrato; estos motivos se unen con baja afinidad a los sitios de acoplamiento de la fosfatasa, que no están contenidos dentro de su sitio activo . Aunque cada interacción de acoplamiento individual es débil, muchas interacciones ocurren simultáneamente, lo que confiere un efecto acumulativo en la especificidad de unión. [7] Las interacciones de acoplamiento también pueden regular alostéricamente las fosfatasas y, por lo tanto, influir en su actividad catalítica. [8]
A diferencia de las quinasas, las enzimas fosfatasas reconocen y catalizan una gama más amplia de sustratos y reacciones. Por ejemplo, en los seres humanos, las quinasas Ser/Thr superan en número a las fosfatasas Ser/Thr por un factor de diez. [4] Hasta cierto punto, esta disparidad resulta del conocimiento incompleto del fosfatoma humano , es decir, el conjunto completo de fosfatasas expresadas en una célula, tejido u organismo. [3] Muchas fosfatasas aún están por descubrir, y para numerosas fosfatasas conocidas, aún no se ha identificado un sustrato. Sin embargo, entre los pares fosfatasa/quinasa bien estudiados, las fosfatasas exhiben una mayor variedad que sus contrapartes quinasas tanto en forma como en función; esto puede resultar del menor grado de conservación entre las fosfatasas. [4]

Las fosfatasas no deben confundirse con las fosforilasas , que añaden grupos fosfato.
Una proteína fosfatasa es una enzima que desfosforila un residuo de aminoácido de su sustrato proteico. Mientras que las proteínas quinasas actúan como moléculas de señalización al fosforilar proteínas, las fosfatasas eliminan el grupo fosfato, que es esencial para que el sistema de señalización intracelular pueda restablecerse para un uso futuro. El trabajo en tándem de las quinasas y las fosfatasas constituye un elemento significativo de la red reguladora de la célula. [9] La fosforilación (y desfosforilación) es uno de los modos más comunes de modificación postraduccional en proteínas, y se estima que, en un momento dado, hasta el 30% de todas las proteínas están fosforiladas. [10] [11] Dos proteínas fosfatasas notables son PP2A y PP2B. PP2A está involucrada en múltiples procesos reguladores, como la replicación del ADN, el metabolismo, la transcripción y el desarrollo. PP2B, también llamada calcineurina , está involucrada en la proliferación de células T ; Por ello, es el objetivo de algunos fármacos que buscan suprimir el sistema inmunológico. [9]
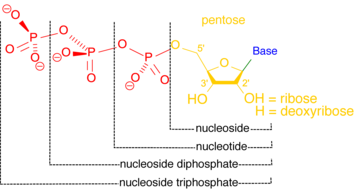
Una nucleotidasa es una enzima que cataliza la hidrólisis de un nucleótido , formando un nucleósido y un ion fosfato. [12] Las nucleotidasas son esenciales para la homeostasis celular , porque son parcialmente responsables de mantener una proporción equilibrada de nucleótidos a nucleósidos. [13] Algunas nucleotidasas funcionan fuera de la célula, creando nucleósidos que pueden transportarse a la célula y usarse para regenerar nucleótidos a través de vías de rescate . [14] Dentro de la célula, las nucleotidasas pueden ayudar a mantener los niveles de energía en condiciones de estrés. Una célula privada de oxígeno y nutrientes puede catabolizar más nucleótidos para aumentar los niveles de trifosfatos de nucleósidos como el ATP , la moneda energética primaria de la célula. [15]
Las fosfatasas también pueden actuar sobre los carbohidratos , como intermediarios en la gluconeogénesis . La gluconeogénesis es una vía biosintética en la que la glucosa se crea a partir de precursores no carbohidratos; la vía es esencial porque muchos tejidos solo pueden obtener energía de la glucosa. [9] Dos fosfatasas, la glucosa-6-fosfatasa y la fructosa-1,6-bisfosfatasa, catalizan pasos irreversibles en la gluconeogénesis. [16] [17] Cada una escinde un grupo fosfato de un intermediario de fosfato de azúcar de seis carbonos .
Dentro de la clase más amplia de fosfatasas, la Comisión de Enzimas reconoce 104 familias de enzimas distintas. Las fosfatasas se clasifican por especificidad de sustrato y homología de secuencia en dominios catalíticos. [3] A pesar de su clasificación en más de cien familias, todas las fosfatasas siguen catalizando la misma reacción general de hidrólisis. [1]
En experimentos in vitro, las enzimas fosfatasas parecen reconocer muchos sustratos diferentes, y un sustrato puede ser reconocido por muchas fosfatasas diferentes. Sin embargo, cuando se han llevado a cabo experimentos in vivo, se ha demostrado que las enzimas fosfatasas son increíblemente específicas. [3] En algunos casos, una fosfatasa proteica (es decir, una definida por su reconocimiento de sustratos proteicos) puede catalizar la desfosforilación de sustratos no proteicos. [4] De manera similar, las fosfatasas de tirosina de especificidad dual pueden desfosforilar no solo residuos de tirosina , sino también residuos de serina . Por lo tanto, una fosfatasa puede exhibir las cualidades de múltiples familias de fosfatasas. [9]
{{cite book}}: CS1 maint: multiple names: authors list (link)