
El cultivo de células en 3D mediante el método de levitación magnética (MLM) se refiere a un método de cultivo de tejido celular en 3D mediante la exposición de células tratadas con nanopartículas magnéticas a campos magnéticos que varían espacialmente mediante el uso de controladores magnéticos de neodimio que levitan las células hasta la interfaz aire/líquido de una placa de Petri estándar . Los conjuntos de nanopartículas magnéticas consisten en nanopartículas magnéticas de óxido de hierro , nanopartículas de oro y el polímero polilisina . El cultivo de células en 3D es escalable, con la capacidad de cultivar desde 500 células hasta millones de células, o desde una sola placa hasta sistemas de bajo volumen de alto rendimiento. [1] [2] [3] Una vez que se generan los cultivos magnetizados, se utilizan como material de construcción o la "tinta" para el proceso de bioimpresión 3D magnética .
El cultivo celular monocapa estándar sobre plástico para cultivo de tejidos no replica la compleja arquitectura 3D del tejido in vivo , pero tiene el potencial de modificar las propiedades morfológicas de las células. A pesar de estar sujetos a extensas pruebas prácticas y regulaciones de calidad, los plásticos para cultivo de tejidos aún pueden comprometer experimentos básicos de ciencias biológicas y posiblemente causar resultados engañosos en la detección de fármacos sobre eficacia y toxicidad . También se ha observado que este método de cultivo celular produce células que pueden carecer de las características necesarias para desarrollar terapias de regeneración tisular . [1] [2] [4] [5] [6] [7] [8] [9]
Un sistema de cultivo de células en 3D de este tipo utiliza reactivos basados en polímeros biocompatibles [1] para administrar nanopartículas magnéticas a células individuales, de modo que un impulsor magnético aplicado puede hacer levitar las células desde el fondo de la placa de cultivo celular y acercarlas rápidamente a la interfaz aire-líquido. Esto inicia interacciones célula-célula en ausencia de cualquier superficie o matriz artificial. Los campos magnéticos están diseñados para formar estructuras multicelulares en 3D, incluida la expresión de proteínas de la matriz extracelular . La matriz, la expresión de proteínas y la respuesta a agentes exógenos del tejido resultante muestran similitud con los resultados in vivo. [1]
El cultivo de células en 3D mediante MLM fue desarrollado a partir de la colaboración entre científicos de la Universidad Rice y el Centro Oncológico MD Anderson de la Universidad de Texas en 2008. [1] Desde entonces, la tecnología de cultivo de células en 3D ha sido autorizada y comercializada por Nano3D Bio-sciences. [10]

La figura de la derecha muestra un cultivo de células en 3D mediante levitación magnética utilizando un sistema posible. Las letras de la figura hacen referencia a lo siguiente:
(A) Se agrega un conjunto de nanopartículas de óxido de hierro magnético conocido como "nanoshuttle" y se dispersa sobre las células, y la mezcla se incuba.
(B) Después de la incubación con el nanoshuttle, las células se separan y se transfieren a una placa de Petri .
(C) Luego se coloca una unidad magnética en la parte superior de una placa de Petri .
(D) El campo magnético hace que las células se eleven hasta la interfaz aire-medio.
(E) Células endoteliales de la vena umbilical humana (HUVEC) levitadas durante 60 minutos (dos imágenes de la izquierda en E) y 4 horas (dos imágenes de la derecha en E) (barra de escala, 50 μm).
El inicio de la interacción célula-célula se produce en el momento en que las células levitan y comienzan a formarse las estructuras tridimensionales. Al cabo de una hora, las células todavía están relativamente dispersas, pero ya muestran algunos signos de estiramiento. La formación de las estructuras tridimensionales es visible después de cuatro horas de levitación (flechas en E). [1] [2]

Los patrones de expresión de proteínas en cultivos levitados guardan semejanza con los patrones observados in vivo . Por ejemplo, como se muestra en la figura de la derecha, la expresión de N-cadherina en células de glioblastoma humano (GBM) levitadas fue casi idéntica a la expresión observada en xenoinjertos de tumores humanos cultivados en ratones inmunodeficientes (comparando las imágenes de la izquierda y del medio), mientras que el cultivo 2D estándar mostró una expresión mucho más débil que no coincidía con la distribución del xenoinjerto (comparando las imágenes de la izquierda y la derecha). [1] La proteína transmembrana N-cadherina se utiliza a menudo como un indicador de ensamblaje de tejido similar al in vivo en cultivos 3D. [1]
En referencia a la figura, en el cultivo de ratón y levitado (imagen izquierda y central), la N-cadherina está claramente concentrada en la membrana y también presente en el citoplasma y las uniones celulares , mientras que el sistema 2D (imagen derecha) muestra N-cadherina en el citoplasma y el núcleo , pero notablemente ausente de la membrana. [1]

Uno de los desafíos a la hora de generar cultivos similares a los in vivo o tejidos in vitro es la dificultad de cocultivar diferentes tipos de células. El cocultivo de diferentes tipos de células se puede lograr al inicio de la levitación, ya sea mezclando diferentes tipos de células antes de la levitación o guiando magnéticamente cultivos 3D en un formato de ensayo de invasión . [1]
El cocultivo en una arquitectura tisular realista es importante para modelar con precisión las condiciones in vivo, como por ejemplo para aumentar la precisión de los ensayos celulares, como se muestra en la figura de la derecha. [1] En la figura, las células GBM humanas y los astrocitos humanos normales (NHA) se cultivan por separado y luego se guían magnéticamente juntos (izquierda, tiempo 0). La invasión de GBM en NHA en cultivo 3D proporciona un ensayo para la biología básica del cáncer y la detección de fármacos (derecha, 12 h a 252 h). [1] [2]
Al facilitar el ensamblaje de diferentes poblaciones de células utilizando el MLM, se puede lograr la generación consistente de organoides denominados adiposferas capaces de simular las complejas interacciones intercelulares del tejido adiposo blanco (WAT) endógeno. [11]
El cocultivo de preadipocitos 3T3-L1 en 3D con células endoteliales murinas bEND.3 crea un conjunto de red similar a la vascular con lipogénesis concomitante en células perivasculares (consulte la figura adjunta). [11]
Además de las líneas celulares, la organogénesis del tejido adiposo blanco se puede simular a partir de células primarias. [11]
Se cultivó en 3D la fracción vascular estromal (FVS) desprovista de adipocitos que contenía células estromales adiposas (CSA), células endoteliales y leucocitos infiltrados derivados del tejido adiposo blanco de ratón. Esto reveló organoides con una organización jerárquica sorprendente, con cápsulas distintivas y estructuras internas similares a grandes vasos revestidas de células endoteliales, así como una localización perivascular de las CSA. [11]
Tras la inducción de la adipogénesis de las adiposferas 3T3-L1 o de las adiposferas derivadas de SVF, las células formaron de manera eficiente gotas lipídicas grandes típicas de los adipocitos blancos in vivo, mientras que en 2D solo se logra la formación de gotas lipídicas más pequeñas. Esto indica una señalización intercelular que recapitula mejor la organogénesis del tejido adiposo blanco. [11]
Este MLM para cocultivo 3D crea adiposferas apropiadas para el modelado de tejido adiposo ex vivo y proporciona una nueva plataforma para análisis funcionales para identificar moléculas bioactivas hacia poblaciones de células adiposas individuales. También se puede adoptar para aplicaciones de trasplante de tejido adiposo y ayudar a otros enfoques de terapia celular basada en tejido adiposo. [11]
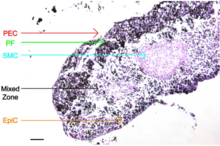
Puede ser necesario el uso de herramientas de manipulación adicionales para organizar co-cultivos 3D en una configuración lo suficientemente similar a la arquitectura del tejido nativo.
Las células endoteliales (PEC), las células musculares lisas (SMC), los fibroblastos (PF) y las células epiteliales (EpiC) cultivadas mediante levitación magnética se pueden colocar en capas secuenciales con el método de arrastrar y soltar para crear bronquiolos que mantengan el fenotipo e induzcan la formación de la matriz extracelular, como se muestra en las imágenes de la derecha. [12]
A continuación se enumeran los tipos de células (primarias y líneas celulares) que se han cultivado con éxito mediante el método de levitación magnética.