La isoquinolina es un espécimen químico individual -un compuesto orgánico aromático heterocíclico- así como el nombre de una familia de muchos miles de alcaloides vegetales naturales, cualquiera de los cuales podría ser denominado "una isoquinolina". Es un isómero estructural de la quinolina . La isoquinolina y la quinolina son benzopiridinas , que están compuestas por un anillo de benceno fusionado a un anillo de piridina . En un sentido más amplio, el término isoquinolina se utiliza para hacer referencia a los derivados de la isoquinolina . La 1-bencilisoquinolina es la estructura principal de muchos alcaloides naturales como la papaverina . El anillo de isoquinolina en estos compuestos naturales deriva del aminoácido aromático tirosina . [3] [4] [5] [6] [7] [8]
La isoquinolina es un líquido incoloro , higroscópico a temperaturas superiores a su punto de fusión, con un olor penetrante y desagradable . Las muestras impuras pueden tener un aspecto pardusco, como es habitual en el caso de los heterociclos de nitrógeno. Cristaliza en forma de plaquetas que tienen una baja solubilidad en agua, pero se disuelven bien en etanol , acetona , éter dietílico , disulfuro de carbono y otros disolventes orgánicos comunes . También es soluble en ácidos diluidos como derivado protonado.
Al ser un análogo de la piridina, la isoquinolina es una base débil , con un p K a de 5,14. [2] Se protona para formar sales tras el tratamiento con ácidos fuertes , como el HCl. Forma aductos con ácidos de Lewis , como el BF 3 .
La isoquinolina fue aislada por primera vez del alquitrán de hulla en 1885 por Hoogewerf y van Dorp. [9] La aislaron mediante cristalización fraccionada del sulfato ácido. Weissgerber desarrolló una ruta más rápida en 1914 mediante la extracción selectiva del alquitrán de hulla, aprovechando el hecho de que la isoquinolina es más básica que la quinolina. La isoquinolina puede luego aislarse de la mezcla mediante cristalización fraccionada del sulfato ácido.
Aunque los derivados de isoquinolina pueden sintetizarse por varios métodos, relativamente pocos métodos directos proporcionan la isoquinolina no sustituida. La reacción de Pomeranz-Fritsch proporciona un método eficiente para la preparación de isoquinolina. Esta reacción utiliza un benzaldehído y un acetal dietílico de aminoacetoaldehído, que en un medio ácido reaccionan para formar isoquinolina. [10] Alternativamente, se pueden utilizar bencilamina y un acetal de glioxal , para producir el mismo resultado utilizando la modificación de Schlittler-Müller. [11]
Existen otros métodos útiles para la preparación de diversos derivados de isoquinolina.
En la reacción de Bischler-Napieralski, una β-feniletilamina se acila y se ciclodeshidrata mediante un ácido de Lewis, como el cloruro de fosforilo o el pentóxido de fósforo . La 3,4-dihidroisoquinolina 1-sustituida resultante puede luego deshidrogenarse utilizando paladio. La siguiente reacción de Bischler-Napieralski produce papaverina.
La reacción de Pictet-Gams y la reacción de Pictet-Spengler son ambas variaciones de la reacción de Bischler-Napieralski. La reacción de Pictet-Gams funciona de manera similar a la reacción de Bischler-Napieralski; la única diferencia es que un grupo hidroxi adicional en el reactivo proporciona un sitio para la deshidratación en las mismas condiciones de reacción que la ciclización para dar la isoquinolina en lugar de requerir una reacción separada para convertir un intermediario de dihidroisoquinolina.
En una reacción de Pictet-Spengler, la condensación de una β -feniletilamina y un aldehído forma una imina, que sufre una ciclización para formar una tetrahidroisoquinolina en lugar de la dihidroisoquinolina. En enzimología , la (S) -norcoclaurina sintasa ( EC 4.2.1.78) es una enzima que cataliza una síntesis biológica de Pictect-Spengler:
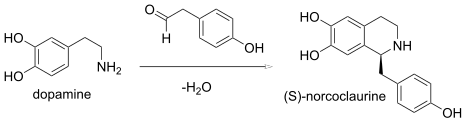
Las reacciones intramoleculares de aza Wittig también producen isoquinolinas.
Las isoquinolinas encuentran muchas aplicaciones, entre ellas:
Se cree que la enfermedad de Parkinson , un trastorno del movimiento de progresión lenta, es causada por ciertas neurotoxinas . Una neurotoxina llamada MPTP (1[ N ]-metil-4-fenil-1,2,3,6- tetrahidropiridina ), precursora de MPP + , fue descubierta y vinculada a la enfermedad de Parkinson en la década de 1980. Las neurotoxinas activas destruyen las neuronas dopaminérgicas , lo que conduce al parkinsonismo y la enfermedad de Parkinson. Se ha descubierto que varios derivados de la tetrahidroisoquinolina tienen las mismas propiedades neuroquímicas que la MPTP. Estos derivados pueden actuar como precursores de neurotoxinas activas. [13]
Las isoquinolinas se utilizan en la fabricación de tintes , pinturas , insecticidas y fungicidas . También se utilizan como disolvente para la extracción líquido-líquido de resinas y terpenos , y como inhibidor de corrosión .
. Encyclopædia Britannica . Vol. 22 (11.ª ed.). 1911. págs. 758–759.