
Las betalactamasas ( β-lactamasas ) son enzimas ( EC 3.5.2.6) producidas por bacterias que proporcionan multirresistencia a los antibióticos betalactámicos como penicilinas , cefalosporinas , cefamicinas , monobactámicos y carbapenémicos ( ertapenem ), aunque los carbapenémicos son relativamente resistentes a beta-lactamasa. La beta-lactamasa proporciona resistencia a los antibióticos al romper la estructura de los antibióticos . Todos estos antibióticos tienen un elemento común en su estructura molecular: un anillo de cuatro átomos conocido como anillo betalactámico (β-lactámico). Mediante hidrólisis , la enzima lactamasa rompe el anillo de β-lactámico, desactivando las propiedades antibacterianas de la molécula.
Las betalactamasas producidas por bacterias gramnegativas generalmente se secretan, especialmente cuando hay antibióticos presentes en el medio ambiente. [1]
La estructura de una serina β-lactamasa (SBL) de Streptomyces viene dada por 1BSG. El pliegue alfa-beta ( InterPro : IPR012338 ) se parece al de una DD-transpeptidasa , a partir de la cual se cree que evolucionó la enzima. Los antibióticos β-lactámicos se unen a las DD-transpeptidasas para inhibir la biosíntesis de la pared celular bacteriana. Las serina β-lactamasas se agrupan por similitud de secuencia en los tipos A, C y D.
El otro tipo de beta-lactamasa es del tipo metalo ("tipo B"). Las metalo-betalactamasas (MBL) necesitan iones metálicos (1 o 2 iones Zn 2+ [2] ) en su sitio activo para sus actividades catalíticas. [3] La estructura de la metalo-beta-lactamasa 1 de Nueva Delhi viene dada por 6C89. Se parece a una ARNasa Z , a partir de la cual se cree que evolucionó.
Los dos tipos de betalactamasas funcionan sobre la base de dos mecanismos básicos de apertura del anillo β-lactámico. [2]
Las SBL son similares en estructura y mecanismo a las proteínas de unión a penicilina (PBP) diana de los β-lactámicos, que son necesarias para la construcción y modificación de la pared celular. Tanto las SBL como las PBP cambian covalentemente un residuo de serina del sitio activo. La diferencia entre las PBP y las SBL es que estas últimas generan una enzima libre y un antibiótico inactivo mediante la muy rápida hidrólisis del intermedio acil-enzima. [ cita necesaria ]
Las MBL utilizan los iones Zn 2+ para activar una molécula de agua en el sitio de unión para la hidrólisis del anillo de β-lactama. Recientemente se han investigado los quelantes de zinc como inhibidores de las metalo-β-lactamasas, ya que a menudo pueden restaurar la susceptibilidad a los carbapenémicos. [4]
La penicilinasa es un tipo específico de β-lactamasa, que muestra especificidad por las penicilinas , nuevamente al hidrolizar el anillo β-lactámico . Los pesos moleculares de las diversas penicilinasas tienden a agruparse cerca de 50 kilodaltons.
La penicilinasa fue la primera β-lactamasa identificada. Abraham y Chain la aislaron por primera vez en 1940 a partir de E. coli (que son gramnegativas) incluso antes de que la penicilina entrara en uso clínico, [5] pero la producción de penicilinasa se extendió rápidamente a bacterias que anteriormente no la producían o que la producían sólo en raras ocasiones. Se desarrollaron betalactámicos resistentes a la penicilinasa, como la meticilina , pero ahora existe una resistencia generalizada incluso a estos.
Entre las bacterias Gram negativas, la aparición de resistencia a las cefalosporinas de espectro extendido ha sido una preocupación importante. Apareció inicialmente en un número limitado de especies bacterianas ( E. cloacae , C. freundii , S. marcescens y P. aeruginosa ) que podían mutar para hiperproducir su β-lactamasa cromosómica de clase C. Unos años más tarde, apareció resistencia en especies bacterianas que no producían naturalmente enzimas AmpC ( K. pneumoniae , Salmonella spp., P. mirabilis ) debido a la producción de BLEE (betalactamasas de espectro extendido) de tipo TEM o SHV. Característicamente, dicha resistencia ha incluido oxiimino-(por ejemplo, ceftizoxima , cefotaxima , ceftriaxona y ceftazidima , así como el oxiimino-monobactam aztreonam ), pero no 7-alfa-metoxi-cefalosporinas ( cefamicinas ; en otras palabras, cefoxitina y cefotetán ). ; ha sido bloqueado por inhibidores como el clavulanato , sulbactam o tazobactam y no intervienen carbapenémicos ni temocilina . Las β-lactamasas AmpC mediadas por cromosomas representan una nueva amenaza, ya que confieren resistencia a las 7-alfa-metoxi-cefalosporinas ( cefamicinas ) como la cefoxitina o el cefotetán , pero no se ven afectadas por los inhibidores de β-lactamasas disponibles comercialmente y pueden, en cepas con Pérdida de porinas de la membrana externa, proporcionan resistencia a los carbapenémicos. [6]
Los miembros de esta familia comúnmente expresan β-lactamasas (p. ej., TEM-3, TEM-4, [7] y SHV-2 [8] ) que confieren resistencia a las cefalosporinas de espectro expandido (espectro extendido). A mediados de la década de 1980 se detectó este nuevo grupo de enzimas, las β-lactamasas de espectro extendido (BLEE) (detectadas por primera vez en 1979). [9] La prevalencia de bacterias productoras de BLEE ha ido aumentando gradualmente en los hospitales de cuidados intensivos. [10] La prevalencia en la población general varía entre países, por ejemplo, aproximadamente el 6% en Alemania [11] y Francia, [12] el 13% en Arabia Saudita, [13] y el 63% en Egipto. [14] Las BLEE son beta-lactamasas que hidrolizan las cefalosporinas de espectro extendido con una cadena lateral oxiimino. Estas cefalosporinas incluyen cefotaxima , ceftriaxona y ceftazidima , así como el oxiiminomonobactam aztreonam . Por tanto, las BLEE confieren resistencia múltiple a estos antibióticos y a las oxiimino-betalactámicas relacionadas. En circunstancias típicas, derivan de genes para TEM-1, TEM-2 o SHV-1 mediante mutaciones que alteran la configuración de aminoácidos alrededor del sitio activo de estas β-lactamasas. Un conjunto más amplio de antibióticos β-lactámicos son susceptibles a la hidrólisis por estas enzimas. Recientemente se ha descrito un número cada vez mayor de BLEE que no pertenecen al linaje TEM o SHV. [15] Las BLEE frecuentemente están codificadas por plásmidos. Los plásmidos responsables de la producción de BLEE frecuentemente portan genes que codifican resistencia a otras clases de fármacos (por ejemplo, aminoglucósidos). Por lo tanto, las opciones de antibióticos en el tratamiento de organismos productores de BLEE son extremadamente limitadas. Los carbapenémicos son el tratamiento de elección para infecciones graves debidas a organismos productores de BLEE; sin embargo, recientemente se han informado aislados resistentes a carbapenems (principalmente resistentes a ertapenem ). [16] Los organismos productores de BLEE pueden parecer susceptibles a algunas cefalosporinas de espectro extendido . Sin embargo, el tratamiento con dichos antibióticos se ha asociado con altas tasas de fracaso. [ cita necesaria ]
TEM-1 es la beta-lactamasa que se encuentra con mayor frecuencia en las bacterias Gram-negativas . Hasta el 90% de la resistencia a la ampicilina en E. coli se debe a la producción de TEM-1. [17] También es responsable de la resistencia a la ampicilina y la penicilina que se observa en cantidades cada vez mayores en H. influenzae y N. gonorrhoeae . Aunque las betalactamasas de tipo TEM se encuentran con mayor frecuencia en E. coli y K. pneumoniae , también se encuentran en otras especies de bacterias gramnegativas con una frecuencia cada vez mayor. Las sustituciones de aminoácidos responsables del fenotipo de la beta lactamasa de espectro extendido (ESBL) se agrupan alrededor del sitio activo de la enzima y cambian su configuración, permitiendo el acceso a sustratos de oxiimino-betalactámico. La apertura del sitio activo a los sustratos betalactámicos también suele mejorar la susceptibilidad de la enzima a los inhibidores de las betalactamasas, como el ácido clavulánico. Las sustituciones de un solo aminoácido en las posiciones 104, 164, 238 y 240 producen el fenotipo ESBL, pero las ESBL con el espectro más amplio generalmente tienen más de una única sustitución de aminoácido. Basándose en diferentes combinaciones de cambios, actualmente se han descrito 140 enzimas de tipo TEM. TEM-10, TEM-12 y TEM-26 se encuentran entre los más comunes en los Estados Unidos. [18] [19] [20] El término TEM proviene del nombre del paciente ateniense (Temoniera) del cual se recuperó el aislado en 1963. [21]
SHV-1 comparte el 68 por ciento de sus aminoácidos con TEM-1 y tiene una estructura general similar. La beta-lactamasa SHV-1 se encuentra más comúnmente en K. pneumoniae y es responsable de hasta el 20% de la resistencia a ampicilina mediada por plásmidos en esta especie. Las BLEE de esta familia también tienen cambios de aminoácidos alrededor del sitio activo, más comúnmente en las posiciones 238 o 238 y 240. Se conocen más de 60 variedades de SHV. SHV-5 y SHV-12 se encuentran entre los más comunes. [18] Las iniciales significan "variable de reactivo de sulfhidrilo". [22]
Estas enzimas recibieron su nombre por su mayor actividad contra la cefotaxima que otros sustratos de oxiimino-betalactámico (p. ej., ceftazidima , ceftriaxona o cefepima ). En lugar de surgir por mutación, representan ejemplos de adquisición plasmídica de genes de betalactamasas que normalmente se encuentran en el cromosoma de las especies de Kluyvera , un grupo de organismos comensales raramente patógenos. Estas enzimas no están muy relacionadas con las betalactamasas TEM o SHV en el sentido de que muestran sólo aproximadamente un 40% de identidad con estas dos betalactamasas comúnmente aisladas. Actualmente se conocen más de 172 [23] enzimas CTX-M. A pesar de su nombre, algunos son más activos con ceftazidima que con cefotaxima . Están ampliamente descritas entre especies de Enterobacteriaceae , principalmente E. coli y K. pneumoniae. Detectadas en la década de 1980, se han extendido desde principios de la década de 2000 y ahora son el tipo de BLEE predominante en el mundo. Generalmente se agrupan en cinco grupos según homologías de secuenciación; CTX-M-1, CTX-M-2, CTX-M-8, CTX-M-9 y CTX-M-25. CTX-M-15 (perteneciente al grupo CTX-M-1) es el gen CTX-M más prevalente. [24] Se ha descubierto que un ejemplo de beta-lactamasa CTX-M-15, junto con IS Ecp1 , se ha transpuesto al cromosoma de Klebsiella pneumoniae ATCC BAA-2146. [25] Las iniciales significan "Cefotaxima-Munich". [26]
Las betalactamasas OXA fueron reconocidas durante mucho tiempo como una variedad de betalactamasa menos común pero también mediada por plásmidos que podía hidrolizar la oxacilina y las penicilinas antiestafilocócicas relacionadas. Estas betalactamasas se diferencian de las enzimas TEM y SHV en que pertenecen a la clase molecular D y al grupo funcional 2d. Las betalactamasas de tipo OXA confieren resistencia a la ampicilina y la cefalotina y se caracterizan por su alta actividad hidrolítica contra la oxacilina y la cloxacilina y por el hecho de que son poco inhibidas por el ácido clavulánico . Las sustituciones de aminoácidos en las enzimas OXA también pueden dar el fenotipo ESBL. Si bien la mayoría de las BLEE se han encontrado en E. coli , K. pneumoniae y otras enterobacterias , las BLEE de tipo OXA se han encontrado principalmente en P. aeruginosa . Se han encontrado BLEE de tipo OXA principalmente en aislamientos de Pseudomonas aeruginosa de Turquía y Francia. La familia de betalactamasas OXA se creó originalmente como un grupo fenotípico más que genotípico para unas pocas betalactamasas que tenían un perfil de hidrólisis específico. Por lo tanto, existe tan solo un 20% de homología de secuencia entre algunos de los miembros de esta familia. Sin embargo, las incorporaciones recientes a esta familia muestran cierto grado de homología con uno o más de los miembros existentes de la familia de beta-lactamasas OXA. Algunos confieren resistencia predominantemente a la ceftazidima, pero OXA-17 confiere mayor resistencia a la cefotaxima y la cefepima que a la ceftazidima.
Se han descrito otras betalactamasas mediadas por plásmidos, como PER, VEB, GES e IBC, pero son poco comunes y se han encontrado principalmente en P. aeruginosa y en un número limitado de sitios geográficos. PER-1 en aislamientos en Turquía, Francia e Italia; VEB-1 y VEB-2 en cepas del sudeste asiático; y GES-1, GES-2 e IBC-2 en aislamientos de Sudáfrica, Francia y Grecia. PER-1 también es común en especies de acinetobacter multirresistentes en Corea y Turquía. Algunas de estas enzimas también se encuentran en Enterobacteriaceae, mientras que otras BLEE poco comunes (como BES-1, IBC-1, SFO-1 y TLA-1) se han encontrado solo en Enterobacteriaceae.
Si bien los organismos productores de BLEE se asociaban anteriormente con hospitales y atención institucional, ahora estos organismos se encuentran cada vez más en la comunidad. E. coli CTX-M-15 positivo es una causa de infecciones urinarias adquiridas en la comunidad en el Reino Unido [27] y tiende a ser resistente a todos los antibióticos β-lactámicos orales, así como a quinolonas y sulfonamidas . Las opciones de tratamiento pueden incluir nitrofurantoína , fosfomicina , mecilinam y cloranfenicol . En casos desesperados, también se pueden utilizar inyecciones de ertapenem o gentamicina una vez al día.
Aunque las β-lactamasas resistentes a inhibidores no son BLEE, a menudo se las compara con las BLEE porque también son derivados de las enzimas clásicas de tipo TEM o SHV. Estas enzimas recibieron al principio la denominación IRT para TEM β-lactamasa resistente a inhibidores; sin embargo, posteriormente se les cambió el nombre a todos con designaciones numéricas TEM. Hay al menos 19 β-lactamasas TEM distintas resistentes a inhibidores. Se han encontrado β-lactamasas TEM resistentes a inhibidores principalmente en aislados clínicos de E. coli , pero también en algunas cepas de K. pneumoniae , Klebsiella oxytoca , P. mirabilis y Citrobacter freundii . Aunque las variantes de TEM resistentes a inhibidores son resistentes a la inhibición por ácido clavulánico y sulbactam , mostrando así resistencia clínica a las combinaciones de betalactámico-inhibidor de lactamasa de amoxicilina - clavulanato ( co-amoxiclav ), ticarcilina - clavulanato ( co-ticarclav ) y ampicilina/sulbactam , normalmente siguen siendo susceptibles a la inhibición por tazobactam y posteriormente por la combinación de piperacilina/tazobactam , [ cita necesaria ] aunque se ha descrito resistencia. Esta ya no es una epidemiología principalmente europea, sino que se encuentra a menudo en partes del norte de América y se debe realizar pruebas para detectar infecciones urinarias complejas. [19]
Las β-lactamasas tipo AmpC se aíslan comúnmente de bacterias Gram negativas resistentes a cefalosporinas de espectro extendido. Las β-lactamasas AmpC (también denominadas clase C o grupo 1) normalmente están codificadas en el cromosoma de muchas bacterias gramnegativas, incluidas las especies Citrobacter , Serratia y Enterobacter , donde su expresión suele ser inducible ; también puede ocurrir en Escherichia coli pero generalmente no es inducible, aunque puede hiperexpresarse. Las β-lactamasas de tipo AmpC también pueden transportarse en plásmidos. [6] Las β-lactamasas AmpC, a diferencia de las BLEE, hidrolizan las cefalosporinas de amplio y extendido espectro (cefamicinas y oxiimino-β-lactámicos), pero normalmente no son inhibidas por los inhibidores de β-lactamasa ácido clavulánico y tazobactam , mientras que avibactam puede mantener actividad inhibidora contra esta clase de β-lactamasas. [28] Los organismos β-lactamasa de tipo AmpC a menudo se agrupan clínicamente mediante el acrónimo "SPACE": Serratia , Pseudomonas o Proteus , Acinetobacter , Citrobacter y Enterobacter .
Los carbapenemes son famosos por su estabilidad frente a las β-lactamasas AmpC y a las β-lactamasas de espectro extendido. Las carbapenemasas son un grupo diverso de β-lactamasas que son activas no sólo contra las oxiiminocefalosporinas y las cefamicinas sino también contra los carbapenémicos. El aztreonam es estable frente a las metalo-β-lactamasas, pero muchos productores de IMP y VIM son resistentes debido a otros mecanismos. Anteriormente se creía que las carbapenemasas derivaban sólo de las clases A, B y D, pero se ha descrito una carbapenemasa de clase C.
Las carbapenemasas de tipo IMP mediadas por plásmidos (IMP significa activo sobre imipenem), de las cuales se conocen actualmente 19 variedades, se establecieron en Japón en la década de 1990 tanto en organismos entéricos gramnegativos como en especies de Pseudomonas y Acinetobacter . Las enzimas IMP se propagaron lentamente a otros países del Lejano Oriente, se informaron desde Europa en 1997 y se han encontrado en Canadá y Brasil.
En 1999 se informó en Italia de una segunda familia creciente de carbapenemasas, la familia VIM, que ahora incluye 10 miembros, que tienen una amplia distribución geográfica en Europa, América del Sur y el Lejano Oriente y se han encontrado en los Estados Unidos. VIM-1 fue descubierto en P. aeruginosa en Italia en 1996; desde entonces, VIM-2, ahora la variante predominante, se ha encontrado repetidamente en Europa y el Lejano Oriente; VIM-3 y -4 son variantes menores de VIM-2 y -1, respectivamente.
La diversidad de secuencias de aminoácidos es de hasta el 10% en la familia VIM, el 15% en la familia IMP y el 70% entre VIM e IMP. Sin embargo, las enzimas de ambas familias son similares. Ambos están asociados a integrones, a veces dentro de plásmidos. Ambos hidrolizan todos los β-lactámicos excepto los monobactámicos y evaden todos los inhibidores de β-lactámicos. Las enzimas VIM se encuentran entre las MBL más ampliamente distribuidas y se han informado más de 40 variantes de VIM. Los estudios bioquímicos y biofísicos revelaron que las variantes de VIM tienen sólo pequeñas variaciones en sus parámetros cinéticos pero diferencias sustanciales en sus estabilidades térmicas y perfiles de inhibición. [29]
El grupo OXA de β-lactamasas se encuentra principalmente en especies de Acinetobacter y se divide en dos grupos. Las carbapenemasas OXA hidrolizan los carbapenémicos muy lentamente in vitro , y las CIM altas observadas en algunos huéspedes de Acinetobacter (>64 mg/L) pueden reflejar mecanismos secundarios. A veces se ven aumentados en aislados clínicos por mecanismos de resistencia adicionales, como la impermeabilidad o el flujo de salida. Las carbapenemasas OXA también tienden a tener una eficacia hidrolítica reducida frente a penicilinas y cefalosporinas. [30]
Algunas enzimas de clase A, sobre todo las enzimas KPC mediadas por plásmidos, también son carbapenemasas eficaces. Se conocen diez variantes, KPC-2 a KPC-11, y se distinguen por una o dos sustituciones de aminoácidos (KPC-1 se volvió a secuenciar en 2008 y se encontró que era 100% homóloga a las secuencias publicadas de KPC-2). KPC-1 se encontró en Carolina del Norte, KPC-2 en Baltimore y KPC-3 en Nueva York. Tienen sólo un 45% de homología con las enzimas SME y NMC/IMI y, a diferencia de ellas, pueden codificarse mediante plásmidos autotransmisibles.
En febrero de 2009 [actualizar], la carbapenemasa de clase A de Klebsiella pneumoniae ( KPC ) ha sido la carbapenemasa más común a nivel mundial y se detectó por primera vez en 1996 en Carolina del Norte , EE. UU. [31] Una publicación de 2010 indicó que las enterobacterias productoras de KPC se estaban volviendo comunes en los Estados Unidos. [32]
La primera carbapenemasa de clase C se describió en 2006 y se aisló de una cepa virulenta de Enterobacter aerogenes . [33] Se transporta en un plásmido, pYMG-1, y por lo tanto es transmisible a otras cepas bacterianas. [34]
En general, estos tienen poca importancia clínica.
CcrA (CfiA). Su gen ocurre en ca. Entre el 1 y el 3% de los aislados de B. fragilis , pero menos producen la enzima ya que la expresión exige una migración adecuada de una secuencia de inserción. La CcrA se conocía antes de que se introdujera el imipenem y los productores han mostrado poco aumento posterior.
Descrito originalmente en Nueva Delhi en 2009, este gen ahora está muy extendido en Escherichia coli y Klebsiella pneumoniae de India y Pakistán. A mediados de 2010, la bacteria portadora de NDM-1 se introdujo en otros países (incluidos los Estados Unidos y el Reino Unido), muy probablemente debido a la gran cantidad de turistas que viajan por el mundo, quienes pueden haber contraído la cepa del medio ambiente. ya que se han encontrado cepas que contienen el gen NDM-1 en muestras ambientales de la India. [35] NDM tiene varias variantes que comparten diferentes propiedades. [29]
En general, se sospecha que un aislado es productor de BLEE cuando muestra susceptibilidad in vitro a las cefamicinas ( cefoxitina , cefotetán ) pero resistencia a las cefalosporinas de tercera generación y al aztreonam . Además, se debe sospechar de estas cepas cuando el tratamiento con estos agentes para infecciones por gramnegativos falla a pesar de la susceptibilidad in vitro informada . Una vez que se detecta una cepa productora de BLEE, el laboratorio debe informarla como "resistente" a todas las penicilinas, cefalosporinas y aztreonam, incluso si se prueba (in vitro) como susceptible. [ cita necesaria ] La resistencia asociada a los aminoglucósidos y trimetoprim - sulfametoxazol , así como la alta frecuencia de coexistencia de resistencia a las fluoroquinolonas , crea problemas. Los inhibidores de betalactamasa como clavulanato , sulbactam y tazobactam in vitro inhiben la mayoría de las BLEE, pero no se puede confiar de manera consistente en la eficacia clínica de las combinaciones de betalactámico/inhibidor de betalactamasa para el tratamiento. Las cefamicinas ( cefoxitina y cefotetán ) no son hidrolizadas por la mayoría de las BLEE, pero sí por la β-lactamasa de tipo AmpC asociada. Además, las combinaciones de β-lactámico/inhibidor de β-lactamasa pueden no ser efectivas contra organismos que producen β-lactamasa de tipo AmpC. A veces, estas cepas disminuyen la expresión de las proteínas de la membrana externa, haciéndolas resistentes a las cefamicinas. "Los estudios in vivo han arrojado resultados mixtos contra K. pneumoniae productora de BLEE" . ( La cefepima , una cefalosporina de cuarta generación, ha demostrado estabilidad in vitro en presencia de muchas cepas de BLEE/AmpC). Actualmente, los carbapenémicos se consideran, en general, el agente preferido para el tratamiento de infecciones debidas a organismos productores de BLEE. Los carbapenémicos son resistentes a la hidrólisis mediada por BLEE y exhiben una excelente actividad in vitro contra cepas de enterobacterias que expresan BLEE. [ cita necesaria ]
Las cepas que sólo producen BLEE son susceptibles a las cefamicinas y los carbapenémicos in vitro y muestran poco o ningún efecto de inóculo con estos agentes.
Para los organismos que producen BLEE de tipo TEM y SHV , la sensibilidad in vitro aparente a la cefepima y a la piperacilina/tazobactam es común, pero ambos fármacos muestran un efecto de inóculo, con una susceptibilidad disminuida a medida que el tamaño del inóculo aumenta de 10 5 a 10 7 organismos.
Las cepas con algunas BLEE tipo CTX-M y tipo OXA son resistentes a la cefepima en las pruebas, a pesar del uso de un inóculo estándar.
Aunque las variantes de TEM resistentes a inhibidores son resistentes a la inhibición por ácido clavulánico y sulbactam , mostrando así resistencia clínica a las combinaciones betalactámico-inhibidor de beta lactamasa de amoxicilina - clavulanato ( Co-amoxiclav ), ticarcilina - clavulanato y ampicilina/sulbactam , siguen siendo susceptibles a la inhibición por tazobactam y posteriormente por la combinación de piperacilina/tazobactam .
Las cepas productoras de AmpC suelen ser resistentes a las oxiimino-betalactámicas y a las cefamicinas y son susceptibles a los carbapenémicos ; sin embargo, la disminución de la expresión de porinas puede hacer que dicha cepa también sea resistente a los carbapenémicos.
Las cepas con carbapenemasas de tipo IMP, VIM y OXA suelen seguir siendo susceptibles. La resistencia a los antibióticos no betalactámicos es común en las cepas que producen cualquiera de estas enzimas, por lo que las opciones alternativas para la terapia no betalactámica deben determinarse mediante pruebas de susceptibilidad directa. La resistencia a las fluoroquinolonas y aminoglucósidos es especialmente alta.
Para las infecciones causadas por especies de Escherichia coli o Klebsiella productoras de BLEE , el tratamiento con imipenem o meropenem se ha asociado con mejores resultados en términos de supervivencia y eliminación bacteriológica. Cefepima y piperacilina/tazobactam han tenido menos éxito. La ceftriaxona , la cefotaxima y la ceftazidima han fracasado aún más a menudo, a pesar de la susceptibilidad del organismo al antibiótico in vitro . Varios informes han documentado el fracaso del tratamiento con cefamicina como resultado de la resistencia debida a la pérdida de porinas. Algunos pacientes han respondido a la terapia con aminoglucósidos o quinolonas , pero, en una comparación reciente de ciprofloxacina e imipenem para la bacteriemia que involucra K. pneumoniae productora de BLEE , el imipenem produjo el mejor resultado.
Se han realizado pocos estudios clínicos para definir la terapia óptima para las infecciones causadas por cepas de Pseudomonas aeruginosa productoras de BLEE .
En 1957, en medio de la preocupación por las reacciones alérgicas a los antibióticos que contenían penicilina, se vendió una beta-lactamasa como antídoto bajo la marca neutrapen. [36] Se teorizó que la degradación de la penicilina por la enzima trataría la reacción alérgica. [37] Si bien no fue útil en el shock anafiláctico agudo, mostró resultados positivos en casos de urticaria y dolor en las articulaciones que se sospechaba que eran causados por alergia a la penicilina. [38] [39] Su uso se propuso en casos pediátricos donde se descubrió alergia a la penicilina tras la administración de la vacuna contra la polio, que utilizaba penicilina como conservante. [40] Sin embargo, algunos pacientes desarrollaron alergias al neutrapen. [41] [42] El Hospital de Albany lo eliminó de su formulario en 1960, sólo dos años después de agregarlo, alegando falta de uso. [43] Algunos investigadores continuaron usándolo en experimentos sobre resistencia a la penicilina hasta 1972. [44] 3M Pharmaceuticals lo retiró voluntariamente del mercado estadounidense en 1997. [45]
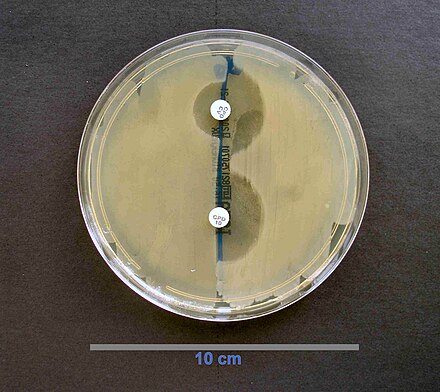
La actividad enzimática beta-lactamasa se puede detectar usando nitrocefina , un sustrato de cefalosporina cromogénico que cambia de color de amarillo a rojo tras la hidrólisis mediada por beta-lactamasa. [46]
La detección de beta lactamasas de espectro extendido (BLEE) se puede realizar mediante difusión en disco. Se utilizan discos de cefpodoxima, ceftazidima, aztreonam, cefotaxima y/o ceftriaxona. [47]
Las beta-lactamasas son enzimas bacterianas antiguas. Las metalo β-lactamasas ("clase B") son todas estructuralmente similares a la RNasa Z y pueden haber evolucionado a partir de ella. De las tres subclases B1, B2 y B3, se teoriza que B1 y B2 evolucionaron hace aproximadamente mil millones de años , mientras que B3 parece haber surgido de forma independiente, posiblemente antes de la divergencia de las eubacterias Gram positivas y Gram negativas aproximadamente dos mil millones. hace años que. [48] PNGM-1 (metalo-β-lactamasa-1 de Papúa Nueva Guinea) tiene actividades tanto metalo-β-lactamasa (MBL) como tRNasa Z, lo que sugiere que se cree que PNGM-1 evolucionó a partir de una tRNasa Z, y que la actividad B3 MBL de PNGM-1 es una actividad promiscua y se cree que las MBL de subclase B3 evolucionaron a través de la actividad PNGM-1. [49] Las subclases B1 y B3 se han subdividido aún más. [50]
Las serina beta-lactamasas (clases A, C y D) parecen haber evolucionado a partir de las DD-transpeptidasas , que son proteínas de unión a penicilina implicadas en la biosíntesis de la pared celular y, como tales, son uno de los principales objetivos de los antibióticos betalactámicos. [51] Estas tres clases muestran una similitud de secuencia indetectable entre sí, pero aún pueden compararse mediante homología estructural. Los grupos A y D son taxones hermanos y el grupo C divergió antes que A y D. [52] Estas enzimas basadas en serina, como las betalactamasas del grupo B, son de origen antiguo y se teoriza que evolucionaron hace unos dos mil millones de años. [53]
Se teoriza que el grupo OXA (en la clase D), en particular, evolucionó en los cromosomas y se trasladó a plásmidos en al menos dos ocasiones distintas. [54]
La "β" ( beta ) se refiere a la posición del nitrógeno en el segundo carbono del anillo. La lactama es una mezcla de lactona (del latín lactis , leche , ya que el ácido láctico se aisló de la leche agria) y amida . El sufijo -asa , que indica una enzima, se deriva de la diastasa (del griego diastasis , "separación"), la primera enzima descubierta en 1833 por Payen y Persoz. [55]