Los monosacáridos (del griego monos : único, sacchar : azúcar), también llamados azúcares simples , son las formas más simples del azúcar y las unidades más básicas ( monómeros ) a partir de las cuales se construyen todos los carbohidratos .
Suelen ser sólidos orgánicos incoloros , solubles en agua y cristalinos . Contrariamente a su nombre (azúcares), solo algunos monosacáridos tienen un sabor dulce . La mayoría de los monosacáridos tienen la fórmula (CH2O ) x ( aunque no todas las moléculas con esta fórmula son monosacáridos).
Los ejemplos de monosacáridos incluyen glucosa (dextrosa), fructosa (levulosa) y galactosa . Los monosacáridos son los componentes básicos de los disacáridos (como la sacarosa , la lactosa y la maltosa ) y los polisacáridos (como la celulosa y el almidón ). El azúcar de mesa que se usa en la jerga cotidiana es en sí mismo un disacárido sacarosa que comprende una molécula de cada uno de los dos monosacáridos D -glucosa y D -fructosa. [1]
Cada átomo de carbono que sostiene un grupo hidroxilo es quiral , excepto aquellos que se encuentran al final de la cadena. Esto da lugar a una serie de formas isoméricas , todas con la misma fórmula química. Por ejemplo, la galactosa y la glucosa son aldohexosas , pero tienen diferentes estructuras físicas y propiedades químicas.
El monosacárido glucosa desempeña un papel fundamental en el metabolismo , donde se extrae energía química a través de la glucólisis y el ciclo del ácido cítrico para proporcionar energía a los organismos vivos. La maltosa es el condensado de deshidratación de dos moléculas de glucosa.
Con pocas excepciones (por ejemplo, la desoxirribosa ), los monosacáridos tienen esta fórmula química : (CH 2 O) x , donde convencionalmente x ≥ 3. Los monosacáridos se pueden clasificar por el número x de átomos de carbono que contienen: triosa (3), tetrosa (4), pentosa (5), hexosa (6), heptosa (7), etc.
La glucosa, utilizada como fuente de energía y para la síntesis de almidón, glucógeno y celulosa, es una hexosa . La ribosa y la desoxirribosa (en el ARN y el ADN , respectivamente) son azúcares pentosas. Entre los ejemplos de heptosas se incluyen las cetosas , la manoheptulosa y la sedoheptulosa . Los monosacáridos con ocho o más carbonos rara vez se observan, ya que son bastante inestables. En soluciones acuosas, los monosacáridos existen como anillos si tienen más de cuatro carbonos.
Los monosacáridos simples tienen un esqueleto carbonado lineal y no ramificado con un grupo funcional carbonilo (C=O) y un grupo hidroxilo (OH) en cada uno de los átomos de carbono restantes . Por lo tanto, la estructura molecular de un monosacárido simple se puede escribir como H(CHOH) n (C=O)(CHOH) m H, donde n + 1 + m = x ; de modo que su fórmula elemental es C x H 2 x O x .
Por convención, los átomos de carbono se numeran del 1 al x a lo largo de la cadena principal, comenzando desde el extremo más cercano al grupo C=O. Los monosacáridos son las unidades más simples de carbohidratos y la forma más simple de azúcar.
Si el carbonilo está en la posición 1 (es decir, n o m es cero), la molécula comienza con un grupo formilo H(C=O)− y técnicamente es un aldehído . En ese caso, el compuesto se denomina aldosa . De lo contrario, la molécula tiene un grupo cetona , un carbonilo −(C=O)− entre dos carbonos; entonces es formalmente una cetona y se denomina cetosa. Las cetosas de interés biológico suelen tener el carbonilo en la posición 2.
Las diversas clasificaciones anteriores se pueden combinar y dar lugar a nombres como "aldohexosa" y "cetotriosa".
Una nomenclatura más general para los monosacáridos de cadena abierta combina un prefijo griego para indicar el número de carbonos (tri-, tetr-, pent-, hex-, etc.) con los sufijos "-osa" para las aldosas y "-ulosa" para las cetosas. [2] En el último caso, si el carbonilo no está en la posición 2, su posición se indica entonces mediante un infijo numérico. Así, por ejemplo, H(C=O)(CHOH) 4 H es pentosa, H(CHOH)(C=O)(CHOH) 3 H es pentulosa y H(CHOH) 2 (C=O)(CHOH) 2 H es pent-3-ulosa.
Dos monosacáridos con gráficos moleculares equivalentes (misma longitud de cadena y misma posición carbonílica) pueden ser estereoisómeros distintos , cuyas moléculas difieren en orientación espacial. Esto sucede solo si la molécula contiene un centro estereogénico , específicamente un átomo de carbono que es quiral (conectado a cuatro subestructuras moleculares distintas). Esos cuatro enlaces pueden tener cualquiera de dos configuraciones en el espacio que se distinguen por su lateralidad . En un monosacárido simple de cadena abierta, cada carbono es quiral excepto el primero y el último átomo de la cadena y (en las cetosas) el carbono con el grupo ceto.
Por ejemplo, la tricetosa H(CHOH)(C=O)(CHOH)H (glicerona, dihidroxiacetona ) no tiene centro estereogénico y, por lo tanto, existe como un solo estereoisómero. La otra triosa, la aldosa H(C=O)(CHOH) 2 H ( gliceraldehído ), tiene un carbono quiral (el central, el número 2) que está unido a los grupos −H, −OH, −C(OH)H 2 y −(C=O)H. Por lo tanto, existe como dos estereoisómeros cuyas moléculas son imágenes especulares una de la otra (como un guante izquierdo y uno derecho). Los monosacáridos con cuatro o más carbonos pueden contener múltiples carbonos quirales, por lo que normalmente tienen más de dos estereoisómeros. El número de estereoisómeros distintos con el mismo diagrama está limitado por 2 c , donde c es el número total de carbonos quirales.
La proyección de Fischer es una forma sistemática de dibujar la fórmula esquelética de un monosacárido acíclico de modo que la lateralidad de cada carbono quiral esté bien especificada. Cada estereoisómero de un monosacárido simple de cadena abierta se puede identificar por las posiciones (derecha o izquierda) en el diagrama de Fischer de los hidroxilos quirales (los hidroxilos unidos a los carbonos quirales).
La mayoría de los estereoisómeros son quirales (se diferencian de sus imágenes especulares). En la proyección de Fischer, dos isómeros que son imágenes especulares se diferencian porque las posiciones de todos los hidroxilos quirales están invertidas de derecha a izquierda. Los isómeros que son imágenes especulares son químicamente idénticos en entornos no quirales, pero suelen tener propiedades bioquímicas y ocurrencias muy diferentes en la naturaleza.
Si bien la mayoría de los estereoisómeros se pueden organizar en pares de formas de imagen especular, hay algunos estereoisómeros no quirales que son idénticos a sus imágenes especulares, a pesar de tener centros quirales. Esto sucede siempre que el gráfico molecular es simétrico, como en las 3-cetopentosas H(CHOH) 2 (CO)(CHOH) 2 H, y las dos mitades son imágenes especulares una de la otra. En ese caso, la imagen especular es equivalente a una rotación de media vuelta. Por esta razón, solo hay tres estereoisómeros de 3-cetopentosa distintos, aunque la molécula tiene dos carbonos quirales.
Los estereoisómeros distintos que no son imágenes especulares entre sí suelen tener propiedades químicas diferentes, incluso en entornos no quirales. Por lo tanto, a cada par especular y a cada estereoisómero no quiral se le puede dar un nombre de monosacárido específico . Por ejemplo, hay 16 estereoisómeros de aldohexosas distintos, pero el nombre "glucosa" significa un par específico de aldohexosas que son imágenes especulares. En la proyección de Fischer, uno de los dos isómeros de glucosa tiene el hidroxilo a la izquierda en C3 y a la derecha en C4 y C5; mientras que el otro isómero tiene el patrón invertido. Estos nombres de monosacáridos específicos tienen abreviaturas convencionales de tres letras, como "Glu" para glucosa y "Thr" para treosa .
En general, un monosacárido con n carbonos asimétricos tiene 2 n estereoisómeros. El número de estereoisómeros de cadena abierta para un monosacárido de aldosa es mayor en uno que el de un monosacárido de cetosa de la misma longitud. Cada cetosa tendrá 2 ( n −3) estereoisómeros donde n > 2 es el número de carbonos. Cada aldosa tendrá 2 ( n −2) estereoisómeros donde n > 2 es el número de carbonos. Estos también se conocen como epímeros que tienen la disposición diferente de los grupos −OH y −H en los átomos de carbono asimétricos o quirales (esto no se aplica a aquellos carbonos que tienen el grupo funcional carbonilo).
Al igual que muchas moléculas quirales, los dos estereoisómeros del gliceraldehído rotarán gradualmente la dirección de polarización de la luz polarizada linealmente a medida que pasa a través de ellos, incluso en solución. Los dos estereoisómeros se identifican con los prefijos D- y L- , según el sentido de rotación: el D -gliceraldehído es dextrógiro (rota el eje de polarización en el sentido de las agujas del reloj), mientras que el L -gliceraldehído es levógiro (lo rota en el sentido contrario a las agujas del reloj).

Los prefijos D y L también se utilizan con otros monosacáridos para distinguir dos estereoisómeros particulares que son imágenes especulares entre sí. Para este propósito, se considera el carbono quiral que está más alejado del grupo C=O. Sus cuatro enlaces deben conectarse a −H, −OH, −C(OH)H y al resto de la molécula. Si la molécula puede rotarse en el espacio de modo que las direcciones de esos cuatro grupos coincidan con las de los grupos análogos en el C2 del D -gliceraldehído, entonces el isómero recibe el prefijo D. De lo contrario, recibe el prefijo L.
En la proyección de Fischer, los prefijos D y L especifican la configuración del átomo de carbono que está segundo desde abajo: D si el hidroxilo está en el lado derecho, y L si está en el lado izquierdo.
Obsérvese que los prefijos D y L no indican la dirección de rotación de la luz polarizada, que es un efecto combinado de la disposición en todos los centros quirales. Sin embargo, los dos enantiómeros siempre harán girar la luz en direcciones opuestas, en la misma cantidad. Véase también sistema D/L .
Un monosacárido a menudo cambia de la forma acíclica (de cadena abierta) a una forma cíclica , a través de una reacción de adición nucleofílica entre el grupo carbonilo y uno de los grupos hidroxilo de la misma molécula. La reacción crea un anillo de átomos de carbono cerrado por un átomo de oxígeno que actúa como puente . La molécula resultante tiene un grupo hemiacetal o hemicetal , dependiendo de si la forma lineal era una aldosa o una cetosa. La reacción se revierte fácilmente, dando lugar a la forma original de cadena abierta.
En estas formas cíclicas, el anillo suele tener cinco o seis átomos. Estas formas se denominan furanosas y piranosas , respectivamente, por analogía con el furano y el pirano , los compuestos más simples con el mismo anillo de carbono-oxígeno (aunque carecen de los dobles enlaces de estas dos moléculas). Por ejemplo, la aldohexosa glucosa puede formar un enlace hemiacetal entre el grupo aldehído del carbono 1 y el hidroxilo del carbono 4, produciendo una molécula con un anillo de 5 miembros, llamada glucofuranosa . La misma reacción puede tener lugar entre los carbonos 1 y 5 para formar una molécula con un anillo de 6 miembros , llamada glucopiranosa . Las formas cíclicas con un anillo de siete átomos (el mismo del oxepano ), que rara vez se encuentran, se denominan heptosas .


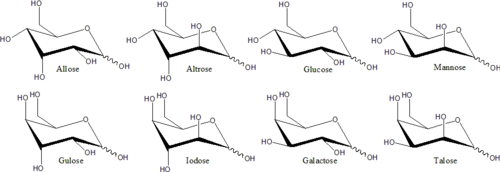
En el caso de muchos monosacáridos (incluida la glucosa), predominan las formas cíclicas, tanto en estado sólido como en solución, por lo que se suele utilizar el mismo nombre para los isómeros de cadena abierta y cerrada. Así, por ejemplo, el término "glucosa" puede significar glucofuranosa, glucopiranosa, la forma de cadena abierta o una mezcla de las tres.
La ciclización crea un nuevo centro estereogénico en el carbono que contiene el grupo carbonilo. El grupo −OH que reemplaza al oxígeno del grupo carbonilo puede terminar en dos posiciones distintas con respecto al plano medio del anillo. Por lo tanto, cada monosacárido de cadena abierta produce dos isómeros cíclicos ( anómeros ), denotados por los prefijos α- y β-. La molécula puede cambiar entre estas dos formas mediante un proceso llamado mutarrotación , que consiste en una inversión de la reacción de formación del anillo seguida de la formación de otro anillo. [3]
La estructura estereoquímica de un monosacárido cíclico se puede representar en una proyección de Haworth . En este diagrama, el isómero α para la forma de piranosa de una D -aldohexosa tiene el −OH del carbono anomérico debajo del plano de los átomos de carbono, mientras que el isómero β tiene el −OH del carbono anomérico sobre el plano. Las piranosas adoptan típicamente una conformación de silla, similar a la del ciclohexano . En esta conformación, el isómero α tiene el −OH del carbono anomérico en una posición axial, mientras que el isómero β tiene el −OH del carbono anomérico en posición ecuatorial (considerando los azúcares D -aldohexosas). [4]
Existe una gran cantidad de monosacáridos modificados biológicamente importantes: