Los compuestos aromáticos o arenos se refieren generalmente a compuestos orgánicos "con una química tipificada por el benceno " y "conjugados cíclicamente". [1] La palabra "aromático" se origina de la antigua agrupación de moléculas en función del olor, antes de que se comprendieran sus propiedades químicas generales. La definición actual de compuestos aromáticos no tiene ninguna relación con su olor. Los compuestos aromáticos ahora se definen como compuestos cíclicos que satisfacen la regla de Hückel . Los compuestos aromáticos tienen las siguientes propiedades generales:
Los arenos se dividen generalmente en dos categorías: benzoides, que contienen un derivado del benceno y siguen el modelo del anillo de benceno, y no benzoides, que contienen otros derivados cíclicos aromáticos. Los compuestos aromáticos se utilizan comúnmente en la síntesis orgánica y están involucrados en muchos tipos de reacciones, tanto después de adiciones y eliminaciones, como de saturación y desaromatización.
Los heteroarenos son compuestos aromáticos, donde al menos un grupo metino o vinílico (-C= o -CH=CH-) es reemplazado por un heteroátomo : oxígeno , nitrógeno o azufre . [3] Ejemplos de compuestos no bencénicos con propiedades aromáticas son el furano , un compuesto heterocíclico con un anillo de cinco miembros que incluye un solo átomo de oxígeno, y la piridina , un compuesto heterocíclico con un anillo de seis miembros que contiene un átomo de nitrógeno. Los hidrocarburos sin un anillo aromático se denominan alifáticos . Aproximadamente la mitad de los compuestos conocidos en el año 2000 se describen como aromáticos en cierta medida. [4]



Los compuestos aromáticos están muy extendidos en la naturaleza y en la industria. Los hidrocarburos aromáticos industriales clave son el benceno, el tolueno y el xileno (llamado BTX). Muchas biomoléculas tienen grupos fenilo, incluidos los llamados aminoácidos aromáticos .


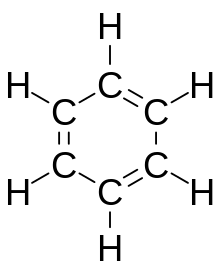
El benceno , C 6 H 6 , es el hidrocarburo aromático menos complejo, y fue el primero en definirse como tal. [6] Su naturaleza enlazante fue reconocida por primera vez de forma independiente por Joseph Loschmidt y August Kekulé en el siglo XIX. [6] Cada átomo de carbono en el ciclo hexagonal tiene cuatro electrones para compartir. Un electrón forma un enlace sigma con el átomo de hidrógeno, y uno se utiliza en la unión covalente con cada uno de los dos carbonos vecinos. Esto deja seis electrones, compartidos equitativamente alrededor del anillo en orbitales moleculares pi deslocalizados del tamaño del anillo mismo. [5] Esto representa la naturaleza equivalente de los seis enlaces carbono-carbono, todos de orden de enlace 1,5. Esta equivalencia también puede explicarse por formas de resonancia . [5] Los electrones se visualizan como flotando por encima y por debajo del anillo, con los campos electromagnéticos que generan actuando para mantener el anillo plano. [5]
El símbolo circular para aromaticidad fue introducido por Sir Robert Robinson y su alumno James Armit en 1925 y popularizado a partir de 1959 por el libro de texto de química orgánica de Morrison & Boyd. [7] El uso adecuado del símbolo es debatido: algunas publicaciones lo utilizan para cualquier sistema π cíclico, mientras que otras lo utilizan solo para aquellos sistemas π que obedecen la regla de Hückel . Algunos argumentan que, para mantenerse en línea con la propuesta original de Robinson, el uso del símbolo circular debería limitarse a sistemas monocíclicos de 6 electrones π. [8] De esta manera, el símbolo circular para un enlace de seis centros y seis electrones puede compararse con el símbolo Y para un enlace de tres centros y dos electrones . [8]

Los derivados del benceno tienen de uno a seis sustituyentes unidos al núcleo central del benceno. [2] Ejemplos de compuestos de benceno con un solo sustituyente son el fenol , que lleva un grupo hidroxilo , y el tolueno con un grupo metilo . Cuando hay más de un sustituyente presente en el anillo, su relación espacial se vuelve importante para la cual se idean los patrones de sustitución de areno orto , meta y para . [9] Cuando reaccionan para formar derivados de benceno más complejos, los sustituyentes en un anillo de benceno pueden describirse como activados o desactivados , que son donadores de electrones y atractores de electrones respectivamente. [9] Los activadores se conocen como directores orto-para, y los desactivadores se conocen como directores meta. [9] Al reaccionar, se agregarán sustituyentes en las posiciones orto, para o meta, dependiendo de la directividad de los sustituyentes actuales para formar derivados de benceno más complejos, a menudo con varios isómeros. El flujo de electrones que conduce a la rearomatización es clave para garantizar la estabilidad de dichos productos. [9]
Por ejemplo, existen tres isómeros para el cresol porque el grupo metilo y el grupo hidroxilo (ambos directores orto-para) pueden estar ubicados uno al lado del otro ( orto ), una posición eliminada uno del otro ( meta ) o dos posiciones eliminadas uno del otro ( para ). [10] Dado que tanto el grupo metilo como el hidroxilo son directores orto-para, los isómeros orto y para son típicamente los preferidos. [10] El xilenol tiene dos grupos metilo además del grupo hidroxilo y, para esta estructura, existen 6 isómeros. [ cita requerida ]
Los anillos de areno pueden estabilizar cargas, como se ve, por ejemplo, en el fenol (C 6 H 5 –OH), que es ácido en el hidroxilo (OH), ya que la carga del oxígeno (alcóxido –O − ) está parcialmente deslocalizada en el anillo de benceno.
Aunque los arenos bencílicos son comunes, los compuestos no bencílicos también son sumamente importantes. Cualquier compuesto que contenga una porción cíclica que se ajuste a la regla de Hückel y que no sea un derivado del benceno puede considerarse un compuesto aromático no bencílico. [5]
De los anulenos más grandes que el benceno, el [12]anuleno y el [14]anuleno son compuestos débilmente aromáticos y el [18]anuleno, ciclooctadecanonaeno , es aromático, aunque la tensión dentro de la estructura causa una ligera desviación de la estructura precisamente planar necesaria para la categorización aromática. [11] Otro ejemplo de un areno monocíclico no bencílico es el ciclopropenilo (catión ciclopropenio), que satisface la regla de Hückel con un n igual a 0. [12] Nótese que solo la forma catiónica de este propenilo cíclico es aromática, dado que la neutralidad en este compuesto violaría la regla del octeto o la regla de Hückel . [12]
Otros arenos monocíclicos no bencílicos incluyen los heteroarenos antes mencionados que pueden reemplazar átomos de carbono con otros heteroátomos como N, O o S. [5] Ejemplos comunes de estos son el pirrol de seis miembros y la piridina de cinco miembros , ambos con un nitrógeno sustituido [13].
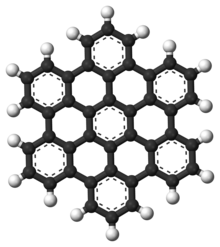
Los hidrocarburos aromáticos policíclicos , también conocidos como compuestos aromáticos polinucleares (HAP), son hidrocarburos aromáticos que consisten en anillos aromáticos fusionados y no contienen heteroátomos ni llevan sustituyentes . [14] El naftaleno es el ejemplo más simple de un HAP. Los HAP se encuentran en depósitos de petróleo , carbón y alquitrán , y se producen como subproductos de la quema de combustibles (ya sean combustibles fósiles o biomasa). [15] Como contaminantes, son motivo de preocupación porque algunos compuestos han sido identificados como cancerígenos , mutagénicos y teratogénicos . [16] [17] [18] [19] Los HAP también se encuentran en alimentos cocinados. [15] Los estudios han demostrado que se encuentran altos niveles de HAP, por ejemplo, en la carne cocinada a altas temperaturas, como a la parrilla o a la barbacoa, y en el pescado ahumado. [15] [16] También son una buena molécula candidata para actuar como base para las primeras formas de vida . [20] En el grafeno, el motivo PAH se extiende a grandes láminas 2D. [21]
Los sistemas de anillos aromáticos participan en muchas reacciones orgánicas.
En la sustitución aromática , un sustituyente en el anillo de areno, generalmente hidrógeno, se reemplaza por otro reactivo. [5] Los dos tipos principales son la sustitución aromática electrofílica , cuando el reactivo activo es un electrófilo, y la sustitución aromática nucleófila , cuando el reactivo es un nucleófilo. En la sustitución aromática radical-nucleófila , el reactivo activo es un radical . [22] [23]
Un ejemplo de sustitución aromática electrofílica es la nitración del ácido salicílico , donde se añade un grupo nitro en posición para al sustituyente hidróxido:

La sustitución aromática nucleófila implica el desplazamiento de un grupo saliente , como un haluro , en un anillo aromático . Los anillos aromáticos suelen ser nucleófilos, pero en presencia de grupos atractores de electrones , los compuestos aromáticos sufren una sustitución nucleófila. Desde el punto de vista mecanístico, esta reacción difiere de una reacción S N 2 común , porque ocurre en un átomo de carbono trigonal ( hibridación sp 2 ). [24]
La hidrogenación de arenos crea anillos saturados. El compuesto 1-naftol se reduce completamente a una mezcla de isómeros de decalin -ol . [25]
El compuesto resorcinol , hidrogenado con níquel Raney en presencia de hidróxido de sodio acuoso, forma un enolato que se alquila con yoduro de metilo a 2-metil-1,3-ciclohexandiona: [26]
En las reacciones de desaromatización se pierde la aromaticidad del reactivo. En este sentido, la desaromatización está relacionada con la hidrogenación. Un enfoque clásico es la reducción de Birch . La metodología se utiliza en síntesis. [27]
