Una mutación BRCA es una mutación en cualquiera de los genes BRCA1 y BRCA2 , que son genes supresores de tumores. Se han identificado cientos de tipos diferentes de mutaciones en estos genes, algunas de las cuales se ha determinado que son dañinas, mientras que otras no tienen ningún impacto comprobado. Mutaciones dañinas en estos genes pueden producir un síndrome de cáncer de mama-ovario hereditario en las personas afectadas. Sólo entre el 5% y el 10% de los casos de cáncer de mama en mujeres se atribuyen a mutaciones BRCA1 y BRCA2 (siendo las mutaciones BRCA1 ligeramente más comunes que las mutaciones BRCA2 ), pero el impacto en las mujeres con la mutación genética es más profundo. [2] Las mujeres con mutaciones dañinas en BRCA1 o BRCA2 tienen un riesgo de cáncer de mama que es aproximadamente cinco veces mayor que el riesgo normal, y un riesgo de cáncer de ovario que es aproximadamente de diez a treinta veces mayor que el riesgo normal. [3] El riesgo de cáncer de mama y de ovario es mayor para las mujeres con una mutación de BRCA1 de alto riesgo que con una mutación de BRCA2 . Tener una mutación de alto riesgo no garantiza que la mujer desarrollará ningún tipo de cáncer, ni implica que cualquier cáncer que aparezca en realidad fue causado por la mutación, y no por algún otro factor.
Las mutaciones de alto riesgo, que desactivan un importante proceso de reparación del ADN libre de errores ( reparación dirigida por homología ), aumentan significativamente el riesgo de que la persona desarrolle cáncer de mama , cáncer de ovario y otros tipos de cáncer. Se desconoce por qué las mutaciones de BRCA1 y BRCA2 conducen preferentemente a cánceres de mama y de ovario, pero la falta de función de BRCA1 parece conducir a una inactivación no funcional del cromosoma X. No todas las mutaciones son de alto riesgo; algunas parecen ser variaciones inofensivas. El riesgo de cáncer asociado con cualquier mutación determinada varía significativamente y depende del tipo exacto y la ubicación de la mutación y posiblemente de otros factores individuales.
Las mutaciones pueden heredarse de cualquiera de los padres y pueden transmitirse tanto a hijos como a hijas. Cada hijo de un portador genético , independientemente del sexo, tiene un 50% de posibilidades de heredar el gen mutado del padre que porta la mutación. Como resultado, la mitad de las personas con mutaciones en el gen BRCA son hombres, quienes luego transmitirían la mutación al 50% de su descendencia, sea hombre o mujer. El riesgo de cáncer de mama relacionado con BRCA para los hombres con la mutación es mayor que para otros hombres, pero aún es bajo. [4] Sin embargo, las mutaciones BRCA pueden aumentar el riesgo de otros cánceres, como el cáncer de colon , el cáncer de páncreas y el cáncer de próstata .
Los métodos para diagnosticar la probabilidad de que un paciente con mutaciones en BRCA1 y BRCA2 contraiga cáncer estaban cubiertos por patentes propiedad de Myriad Genetics o controladas por ella . [5] [6] El modelo de negocio de Myriad de ofrecer exclusivamente la prueba de diagnóstico llevó a Myriad a pasar de ser una startup en 1994 a ser una empresa que cotiza en bolsa con 1200 empleados y alrededor de $500 millones en ingresos anuales en 2012; [7] también generó controversia sobre los altos precios y la incapacidad de obtener segundas opiniones de otros laboratorios de diagnóstico, lo que a su vez llevó a la histórica demanda de la Asociación de Patología Molecular contra Myriad Genetics . [8]
La herencia bialélica y homocigótica de un gen BRCA conduce a una forma grave de anemia de Fanconi y es embrionariamente letal en la mayoría de los casos.
Las mujeres con mutaciones perjudiciales en los genes BRCA1 o BRCA2 tienen un alto riesgo de desarrollar cáncer de mama y/o de ovario . Debido a que diferentes estudios analizan diferentes poblaciones, y debido a que diferentes tipos de mutaciones tienen riesgos algo diferentes, el riesgo se expresa mejor como un rango, en lugar de un solo número. [9] : 89-111
Aproximadamente del 50% al 65% de las mujeres que nacen con una mutación nociva en BRCA1 desarrollarán cáncer de mama a los 70 años, y del 35% al 46% desarrollarán cáncer de ovario a los 70 años. Aproximadamente del 40% al 57% de las mujeres con una mutación nociva en BRCA1 desarrollarán cáncer de mama a los 70 años BRCA2 desarrollará cáncer de mama a los 70 años, y entre el 13 % y el 23 % desarrollará cáncer de ovario a los 70 años. [9] : 89–111 [10]
Las mujeres con un cáncer de mama asociado con una mutación BRCA tienen hasta un 40% de probabilidad de desarrollar un nuevo cáncer de mama primario dentro de los 10 años posteriores al diagnóstico inicial si no recibieron tratamiento con tamoxifeno ni se sometieron a una ooforectomía . [4] El riesgo de cáncer de ovario a diez años de la mujer también aumenta entre un 6% y un 12% en estas condiciones. [4]
Las estadísticas sobre el cáncer de ovario relacionado con BRCA generalmente abarcan no solo el cáncer de ovarios en sí, sino también el cáncer peritoneal y el cáncer de las trompas de Falopio , muy raro, pero algo más fácil de detectar . Las mujeres con una mutación BRCA tienen una tasa más de 100 veces mayor de cáncer de trompas de Falopio. [9] : 275–302 Estos tres tipos de cánceres pueden ser difíciles de distinguir en sus etapas avanzadas.
El cáncer de mama relacionado con BRCA aparece a una edad más temprana que el cáncer de mama esporádico. [9] : 89–111 Se ha afirmado que el cáncer de mama relacionado con BRCA es más agresivo que el cáncer de mama normal; sin embargo, la mayoría de los estudios en poblaciones específicas sugieren poca o ninguna diferencia en las tasas de supervivencia a pesar de los factores de pronóstico aparentemente peores. [11] [12] [13]
El cáncer de ovario y de trompas de Falopio relacionado con BRCA es más tratable que el promedio porque es inusualmente susceptible a la quimioterapia basada en platino como el cisplatino . [9] : 275–302 El cáncer de ovario relacionado con BRCA1 aparece a edades más tempranas, pero el riesgo para las mujeres con BRCA2 aumenta notablemente durante la menopausia o poco después. [9] : 275–302
Una mujer de 25 años sin mutación en sus genes BRCA tiene un 84% de probabilidad de alcanzar al menos los 70 años. [14] De las que no sobreviven, el 11% muere de cáncer de mama o de ovario, y el 89% de otras causas.
En comparación, una mujer con una mutación de alto riesgo en BRCA1 , si se sometiera a pruebas de detección de cáncer de mama pero no a una intervención médica o quirúrgica profiláctica, tendría sólo un 59% de posibilidades de llegar a los 70 años, veinticinco puntos porcentuales menos de lo normal. De las mujeres que no sobrevivieron, el 26% moriría de cáncer de mama, el 46% de cáncer de ovario y el 28% de otras causas. [14]
Las mujeres con mutaciones de alto riesgo en BRCA2 , con pruebas de detección pero sin intervención médica o quirúrgica profiláctica, tendrían sólo un 71% de posibilidades de llegar a los 70 años, trece puntos porcentuales menos de lo normal. De los que no sobrevivieron, el 21% moriría de cáncer de mama, el 25% de cáncer de ovario y el 54% de otras causas. [14]
La probabilidad de sobrevivir hasta los 70 años como mínimo puede mejorarse mediante varias intervenciones médicas, en particular la mastectomía profiláctica y la ooforectomía. [14]
Los hombres con una mutación BRCA tienen un riesgo relativo dramáticamente elevado de desarrollar cáncer de mama, pero debido a que la incidencia general de cáncer de mama en los hombres es tan baja, el riesgo absoluto es igual o menor que el riesgo para las mujeres sin una mutación BRCA . [9] : Ch8 Aproximadamente entre el 1% y el 2% de los hombres con una mutación BRCA1 desarrollarán cáncer de mama a los 70 años. Aproximadamente el 6% de los hombres con una mutación BRCA2 desarrollarán cáncer de mama a los 70 años, lo que es aproximadamente igual al riesgo de mujeres sin una mutación BRCA . Muy pocos hombres, con o sin una mutación predisponente, desarrollan cáncer de mama antes de los 50 años. [9] : Ch8
Aproximadamente la mitad de los hombres que desarrollan cáncer de mama tienen una mutación en un gen BRCA o en uno de los otros genes asociados con los síndromes hereditarios de cáncer de mama-ovario .
El cáncer de mama en los hombres puede tratarse con tanto éxito como el cáncer de mama en las mujeres, pero los hombres a menudo ignoran los signos y síntomas del cáncer, como un área dolorosa o una hinchazón inusual, que puede no ser más grande que un grano de arroz , hasta que desaparece. llegó a una etapa tardía. [9] : Ch8
A diferencia de otros hombres, los hombres con una mutación BRCA , especialmente una mutación BRCA2 , pueden beneficiarse de un examen de mama realizado por un profesional y por uno mismo . Por lo general, no se recomiendan las imágenes médicas, pero debido a que los hombres portadores de BRCA2 tienen un riesgo de cáncer de mama muy similar al de la población femenina general, el programa anual estándar de mamografías se puede adaptar a estos hombres de alto riesgo. [9] : Ch8
Las mutaciones se han asociado con un mayor riesgo de desarrollar cualquier tipo de cáncer invasivo, incluido el cáncer de estómago , el cáncer de páncreas , el cáncer de próstata y el cáncer de colon . [15] Los portadores tienen los riesgos normales de desarrollar cáncer (y otras enfermedades) asociados con el aumento de la edad, el tabaquismo, el consumo de alcohol, la mala alimentación, la falta de ejercicio y otros factores de riesgo conocidos, además del riesgo adicional de las mutaciones genéticas y una mayor susceptibilidad al daño causado por la radiación ionizante, incluida la radiación natural de fondo . [9] : 39–50
Los hombres con mutaciones BRCA no pueden padecer cáncer de ovario, pero pueden tener el doble de probabilidades que los no portadores de desarrollar cáncer de próstata a una edad más temprana. [9] : Ch8 El riesgo es menor y controvertido para los portadores de BRCA1 ; Se espera que hasta un tercio de los portadores de la mutación BRCA2 desarrollen cáncer de próstata antes de los 65 años. El cáncer de próstata en los portadores de la mutación BRCA tiende a aparecer una década antes de lo normal y tiende a ser más agresivo de lo normal. Como resultado, el examen anual de próstata, incluido un tacto rectal , es apropiado a los 40 años entre los portadores conocidos, en lugar de a los 50. [9] : Ch8
El cáncer de páncreas tiende a ser hereditario, incluso entre familias BRCA . [9] : La mutación Ch8 A BRCA1 aproximadamente duplica o triplica el riesgo de desarrollar cáncer de páncreas a lo largo de la vida; una mutación en BRCA2 la triplica o quintuplica. Entre el 4% y el 7% de las personas con cáncer de páncreas tienen una mutación BRCA . [15] Sin embargo, dado que el cáncer de páncreas es relativamente raro, las personas con una mutación BRCA2 probablemente enfrentan un riesgo absoluto de alrededor del 5%. Al igual que el cáncer de ovario, tiende a no producir síntomas en las primeras etapas tratables. Al igual que el cáncer de próstata, el cáncer de páncreas asociado con una mutación BRCA tiende a aparecer aproximadamente una década antes que los casos no hereditarios. [15] La detección asintomática es invasiva y puede recomendarse solo a portadores de BRCA2 que también tengan antecedentes familiares de cáncer de páncreas. [9] : Ch8
El melanoma es el cáncer de piel más mortal, aunque se cura fácilmente en las primeras etapas. La probabilidad normal de desarrollar melanoma depende de la raza, la cantidad de lunares que tiene la persona, los antecedentes familiares, la edad, el sexo y el grado de exposición de la persona a la radiación ultravioleta. Los portadores de la mutación BRCA2 tienen aproximadamente el doble o el triple del riesgo que normalmente tendrían, incluido un riesgo superior al promedio de melanoma ocular . [9] : Capítulo 8 [15]
El cáncer de colon es aproximadamente tan común tanto en hombres como en mujeres en el mundo desarrollado como lo es el cáncer de mama entre las mujeres con riesgo promedio; alrededor del 6% de las personas son diagnosticadas con él, generalmente mayores de 50 años. [9] : Ch8 Al igual que el cáncer de próstata esporádico, es una enfermedad multifactorial y se ve afectada por la edad, la dieta y factores similares. Los portadores de la mutación BRCA tienen un riesgo mayor que el promedio de padecer este cáncer común, pero el riesgo no es tan alto como en otros cánceres hereditarios . El riesgo podría ser hasta cuatro veces mayor que lo normal en algunas familias de BRCA1 y el doble del riesgo normal entre los portadores de BRCA2 . Al igual que el cáncer de páncreas, es posible que sólo algunas mutaciones de BRCA o algunas familias de BRCA tengan un riesgo adicional; a diferencia de otros cánceres causados por BRCA , no aparece a una edad más temprana de lo habitual. [9] : La detección del cáncer de colon normal Ch8 generalmente se recomienda a los portadores de la mutación BRCA .
Las mutaciones en BRCA1 y BRCA2 están fuertemente implicadas en algunas neoplasias hematológicas . Las mutaciones en BRCA1 están asociadas a leucemia mielógena aguda y leucemia mielógena crónica . [16] Las mutaciones de BRCA2 también se encuentran en muchos linfomas de células T y leucemias linfocíticas crónicas . [dieciséis]
El dilema de tener hijos o no puede ser una fuente de estrés para las mujeres que se enteran de sus mutaciones BRCA durante sus años fértiles. [17]
Es probable que una mutación del gen BRCA tenga poco o ningún efecto sobre la fertilidad general , [18] aunque las mujeres con una mutación BRCA pueden tener más probabilidades de tener insuficiencia ovárica primaria . [19] [20] Los portadores de la mutación BRCA pueden tener más probabilidades de dar a luz a niñas que a niños, [21] sin embargo, esta observación se ha atribuido a un sesgo de determinación . [22] [23]
Si ambos padres son portadores de una mutación BRCA , a veces se utiliza el diagnóstico genético previo a la implantación para prevenir el nacimiento de un niño con mutaciones BRCA . [9] : 82–85 Nunca se ha informado que se hereden dos mutaciones de BRCA1 (una de cada padre) y se cree que es un defecto de nacimiento letal. Ocasionalmente se ha informado que se hereda una mutación BRCA1 y una mutación BRCA2 ; El riesgo del niño de sufrir cualquier tipo de cáncer es el mayor riesgo de los dos genes (p. ej., el riesgo de cáncer de ovario por BRCA1 y el riesgo de cáncer de páncreas por BRCA2 ). Heredar dos mutaciones en BRCA2 produce anemia de Fanconi . [9] : 82–85
Cada embarazo en mujeres genéticamente típicas se asocia con una reducción significativa en el riesgo de que la madre desarrolle cáncer de mama después de los 40 años. [17] Cuanto más joven sea la mujer en el momento de su primer parto, más protección recibirá contra el cáncer de mama. [9] : 113–142 La lactancia materna durante más de un año protege contra el cáncer de mama. [9] : 113–142 El embarazo también protege contra el cáncer de ovario en mujeres genéticamente típicas. [17]
Aunque algunos estudios han producido resultados diferentes, generalmente no se espera que las mujeres con mutaciones BRCA reciban estos importantes beneficios protectores. [9] : 113–142 [17] La investigación actual es demasiado limitada e imprecisa para permitir el cálculo de riesgos específicos. [17] Sin embargo, se han identificado las siguientes tendencias generales:
Son raros los informes de pacientes bialélicos u homocigotos para un alelo BRCA nocivo que confiere un riesgo mucho mayor de cáncer de mama. Esto se debe a que los alelos BRCA nocivos son alelos letales ; esta condición es embrionariamente letal en la mayoría de los casos. [25] En los casos vivos, heredar ambas mutaciones conduce a un pronóstico grave, caracterizado por tumores de Wilms , leucemias y neoplasias malignas cerebrales de aparición temprana . [26]

Ambos genes BRCA son genes supresores de tumores que producen proteínas que la célula utiliza en una vía enzimática que realiza reparaciones muy precisas y perfectamente adaptadas a las moléculas de ADN que tienen roturas de doble cadena. [9] : 39–50 [27] La vía requiere proteínas producidas por varios otros genes, incluidos CHK2 , FANCD2 y ATM . [15] Las mutaciones dañinas en cualquiera de estos genes desactivan el gen o la proteína que produce.
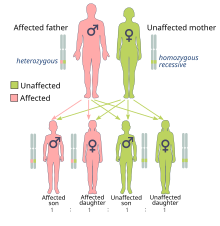
El riesgo de cáncer causado por las mutaciones BRCA1 y BRCA2 se hereda de forma dominante , aunque normalmente sólo se hereda directamente un alelo mutado. [28] Esto se debe a que es probable que las personas con la mutación adquieran una segunda mutación, lo que lleva a la expresión dominante del cáncer. Un gen BRCA mutado se puede heredar de cualquiera de los padres. Debido a que se heredan de los padres, se clasifican como mutaciones hereditarias o de línea germinal en lugar de mutaciones adquiridas o somáticas . El cáncer causado por un gen mutado heredado de los padres de un individuo es un cáncer hereditario y no un cáncer esporádico .
Debido a que los humanos tienen un genoma diploide , cada célula tiene dos copias del gen (una de cada padre biológico). Normalmente, sólo una copia contiene una mutación hereditaria incapacitante, por lo que la persona afectada es heterocigótica para la mutación. Sin embargo, si la copia funcional resulta dañada, la célula se ve obligada a utilizar mecanismos alternativos de reparación del ADN, que son más propensos a errores. La pérdida de la copia funcional se denomina pérdida de heterocigosidad (LOH). [29] Cualquier error resultante en la reparación del ADN puede provocar la muerte celular o una transformación cancerosa de la célula. [9] : 39–50
Existen muchas variaciones en los genes BRCA y no todos los cambios confieren los mismos riesgos. [9] : 39–50 Algunas variantes son inofensivas; se sabe que otros son muy dañinos. Algunos polimorfismos de un solo nucleótido pueden conferir sólo un pequeño riesgo, o pueden conferir riesgo sólo en presencia de otras mutaciones o en determinadas circunstancias. En otros casos, se desconoce si la variante es dañina. Las variantes se clasifican de la siguiente manera: [9] : 39–50 : 109
Las mutaciones nocivas tienen una penetrancia genética alta, pero no completa , lo que significa que las personas con la mutación tienen un alto riesgo de desarrollar una enfermedad como resultado, pero que algunas personas no desarrollarán cáncer a pesar de portar una mutación dañina.
Se recomienda el asesoramiento genético en mujeres cuyos antecedentes de salud personales o familiares sugieren una probabilidad mayor que la media de una mutación. [30] El propósito del asesoramiento genético es educar a la persona sobre la probabilidad de un resultado positivo, los riesgos y beneficios de hacerse la prueba, las limitaciones de las pruebas, el significado práctico de los resultados y las acciones de reducción de riesgos que podrían tomarse. tomarse si los resultados son positivos. También están capacitados para apoyar a las personas a través de cualquier reacción emocional y para ser una persona neutral que ayuda al cliente a tomar su propia decisión en un modelo de consentimiento informado , sin presionar al cliente a hacer lo que el consejero podría hacer. Debido a que el conocimiento de una mutación puede producir una ansiedad considerable, algunas personas optan por no hacerse la prueba o posponerla hasta una fecha posterior. [9] : 51–74
Las indicaciones relativas para realizar pruebas de una mutación en BRCA1 o BRCA2 para miembros recién diagnosticados o familiares incluyen antecedentes familiares entre parientes de primer (FDR), segundo (SDR) o tercer grado (TDR), generalmente del mismo lado de la familia, pero no limitados. : [31]
Hacer pruebas a niños pequeños se considera médicamente poco ético porque los resultados de las pruebas no cambiarían la forma en que se cuida la salud del niño. [9] : 82–85
Hay dos tipos de pruebas disponibles. [9] : 51–74 Ambos utilizan comúnmente una muestra de sangre , aunque la prueba se puede realizar en saliva. La prueba más rápida, sencilla y de menor costo utiliza resultados positivos de un pariente consanguíneo y busca solo la única mutación que se sabe que está presente en la familia. Si ningún familiar ha revelado previamente resultados positivos en la prueba, entonces se puede realizar una prueba completa que verifique la secuencia completa de BRCA1 y BRCA2 . En algunos casos, debido al efecto fundador , el origen étnico judío se puede utilizar para limitar las pruebas y comprobar rápidamente las tres mutaciones más comunes observadas entre los judíos asquenazíes . [9] : 51–74
Las pruebas suelen estar cubiertas por el seguro médico y los programas de atención sanitaria pública para personas con alto riesgo de tener una mutación, pero no para personas con bajo riesgo. [9] : 51–74 El propósito de limitar las pruebas a personas de alto riesgo es aumentar la probabilidad de que la persona reciba un resultado significativo y procesable de la prueba, en lugar de identificar una variante de significado desconocido (VUS). En Canadá, las personas que demuestran su condición de alto riesgo cumpliendo pautas específicas son remitidas inicialmente a un programa especializado en cánceres hereditarios y, si deciden hacerse la prueba, el costo de la prueba está totalmente cubierto. En Estados Unidos, en 2010, las pruebas en un solo sitio tenían un costo minorista de entre 400 y 500 dólares, y el análisis completo costaba alrededor de 3.000 dólares por gen, y los costos eran comúnmente cubiertos por seguros médicos privados para personas consideradas en alto riesgo.
La prueba la solicita un médico, generalmente un oncólogo , y los resultados siempre se envían al médico, en lugar de directamente al paciente. La rapidez con la que se obtienen los resultados depende de la prueba (el análisis en un solo sitio requiere menos tiempo de laboratorio) y de la infraestructura existente. En los EE. UU., los resultados de las pruebas suelen entregarse en un plazo de una a varias semanas; En Canadá, los pacientes suelen esperar entre ocho y diez meses para obtener los resultados de las pruebas. [9] : 51–74
Un resultado positivo de una prueba para una mutación nociva conocida es prueba de predisposición, aunque no garantiza que la persona desarrollará ningún tipo de cáncer. Un resultado negativo de la prueba, si se sabe que una mutación específica está presente en la familia, muestra que la persona no tiene una predisposición al cáncer relacionada con BRCA , aunque no garantiza que la persona no desarrollará un caso no hereditario de cáncer. cáncer. Por sí solo, un resultado negativo de la prueba no significa que la paciente no tenga predisposición hereditaria al cáncer de mama o de ovario. La familia puede tener alguna otra predisposición genética al cáncer, que involucre algún otro gen. [9] : 89-111
Se encuentran disponibles una variedad de opciones e intervenciones de detección para controlar los riesgos de cáncer relacionados con BRCA . Los exámenes de detección se ajustan a los factores de riesgo individuales y familiares. [ cita necesaria ]
Como estos métodos de detección no previenen el cáncer, sino que simplemente intentan detectarlo tempranamente, a veces se practican numerosos métodos de prevención, con resultados variables. [9] : 175-207
Por lo general, se recomienda un régimen intensivo de detección del cáncer para mujeres con mutaciones perjudiciales o presuntamente perjudiciales en BRCA para detectar nuevos cánceres lo antes posible. Una recomendación típica incluye exámenes frecuentes de detección del cáncer de mama , así como pruebas para detectar el cáncer de ovario. [9] : 175-207
Los estudios de imágenes de mama generalmente incluyen una resonancia magnética ( MRI) de mama una vez al año, comenzando entre los 20 y 30 años, dependiendo de la edad en la que algún familiar fue diagnosticado con cáncer de mama. Las mamografías normalmente se utilizan sólo en edades avanzadas, ya que hay motivos para creer que las portadoras de BRCA son más susceptibles a la inducción de cáncer de mama por daño de los rayos X que la población general. [34]
Las alternativas incluyen ecografía mamaria , tomografías computarizadas , tomografías por emisión de positrones (PET) , gammamografía , elastografía , termografía , lavado ductal y protocolos de detección experimentales, algunos de los cuales esperan identificar biomarcadores del cáncer de mama (moléculas que aparecen en la sangre cuando comienza el cáncer de mama). [9] : 175-207
La detección del cáncer de ovario generalmente implica una ecografía de la región pélvica, generalmente dos veces al año. [9] : 175–207 Las mujeres también pueden utilizar un análisis de sangre para CA-125 y exámenes pélvicos clínicos . El análisis de sangre tiene una sensibilidad y especificidad relativamente pobres para el cáncer de ovario. [9] : 175–207 [35]
Tanto en el examen de mama como en el de ovario, las áreas de tejido que parecen sospechosas se investigan con más imágenes, posiblemente usando un tipo diferente de imágenes o después de un retraso, o con biopsias de las áreas sospechosas.
Las píldoras anticonceptivas se asocian con un riesgo sustancialmente menor de cáncer de ovario en mujeres con mutaciones BRCA . [36] [37] Un metanálisis de 2013 encontró que el uso de anticonceptivos orales se asoció con una reducción del 42 % del riesgo relativo de cáncer de ovario; la asociación fue similar para las mutaciones BRCA1 y BRCA2. El uso de anticonceptivos orales no se asoció significativamente con el riesgo de cáncer de mama, aunque se observó un pequeño aumento del riesgo que no alcanzó significación estadística . [36] [37] Un metanálisis de 2011 encontró que el uso de AO se asoció con una reducción relativa del 43 % en el riesgo de cáncer de ovario en mujeres con mutaciones BRCA , mientras que los datos sobre el riesgo de cáncer de mama en portadoras de mutaciones BRCA con uso de anticonceptivos orales fueron heterogéneos y los resultados fueron inconsistentes. [38]
Se ha descubierto que los moduladores selectivos de los receptores de estrógeno , específicamente el tamoxifeno , reducen el riesgo de cáncer de mama en mujeres con mutaciones BRCA a quienes no se les extirpa la mama. [9] : 113–142 Es eficaz como prevención primaria (previniendo el primer caso de cáncer de mama) en mujeres con mutaciones BRCA2 , pero no con mutaciones BRCA1 , y para prevención secundaria (previniendo un segundo cáncer de mama independiente) en ambos grupos. De mujer. Se ha descubierto que tomar tamoxifeno durante cinco años reduce a la mitad el riesgo de cáncer de mama en mujeres que tienen un alto riesgo de padecer cáncer de mama por cualquier motivo, pero tiene efectos adversos potencialmente graves como cataratas , coágulos sanguíneos y cáncer de endometrio , además de problemas de calidad de vida como Los sofocos hacen que algunas mujeres suspendan su uso y algunos médicos limiten su uso a mujeres con crecimientos atípicos en los senos. El tamoxifeno está contraindicado para las mujeres que tienen más probabilidades de verse perjudicadas por las complicaciones comunes. El raloxifeno (Evista), que tiene un riesgo reducido de efectos secundarios, se utiliza como alternativa, pero no se ha estudiado específicamente en portadores de mutaciones BRCA . El uso de tamoxifeno se puede combinar con ooforectomía para una reducción aún mayor del riesgo de cáncer de mama, particularmente en mujeres con mutaciones BRCA2 . [9] : 113-142
Los inhibidores de la aromatasa son medicamentos que previenen la producción de estrógeno en las glándulas suprarrenales y el tejido adiposo . Tienen menos efectos secundarios que los moduladores selectivos de los receptores de estrógeno como el tamoxifeno, pero no funcionan en mujeres premenopáusicas porque no impiden que los ovarios produzcan estrógeno. [9] : 113-142
Se sabe que varios tipos de cirugías preventivas reducen sustancialmente el riesgo de cáncer en mujeres con mutaciones BRCA de alto riesgo . [39] Las cirugías se pueden utilizar solas, en combinación entre sí o en combinación con intervenciones no quirúrgicas para reducir el riesgo de cáncer de mama y de ovario. Cirugías como la mastectomía y la ooforectomía no eliminan la posibilidad de cáncer de mama; Según se informa, han surgido casos a pesar de estos procedimientos. [40]
Si realizar qué cirugías preventivas y cuándo realizarlas es una decisión personal compleja. El conocimiento médico actual ofrece alguna orientación sobre los riesgos y beneficios. Incluso los portadores de la misma mutación o de la misma familia pueden tener riesgos sustancialmente diferentes en cuanto al tipo y la gravedad del cáncer que probablemente padezcan, así como la edad a la que pueden contraerlo. Diferentes personas también tienen diferentes valores. Pueden optar por centrarse en la prevención total del cáncer, los beneficios psicológicos, la calidad de vida actual o la supervivencia general. El posible impacto de futuros avances médicos en el tratamiento o el pronóstico también puede ser de cierta importancia para las mujeres muy jóvenes y la planificación familiar. La decisión es individualizada y normalmente se basa en muchos factores, como la aparición más temprana de cáncer relacionado con BRCA en familiares cercanos.
Un número cada vez mayor de mujeres que dan positivo en los genes BRCA1 o BRCA2 defectuosos optan por someterse a una cirugía para reducir el riesgo. Al mismo tiempo, el tiempo medio de espera para someterse al procedimiento es de dos años, mucho más de lo recomendado. [42] [43]
El efecto protector de la cirugía profiláctica es mayor cuando se realiza a una edad temprana; sin embargo, la ooforectomía también tiene efectos adversos que son mayores cuando se realiza mucho antes de la menopausia natural. Por esta razón, la ooforectomía se recomienda principalmente después de los 35 o 40 años, suponiendo que la maternidad haya finalizado. El riesgo de cáncer de ovario es bajo antes de esta edad y los efectos negativos de la ooforectomía son menos graves a medida que la mujer se acerca a la menopausia natural. [14] [44]
En comparación, las mujeres de la población general tienen un 84% de posibilidades de vivir hasta los 70 años.
Las investigaciones han analizado los efectos de la cirugía reductora de riesgos en el bienestar psicológico y social de mujeres con una mutación BRCA. [45] Debido a la evidencia limitada, un metanálisis de 2019 no pudo sacar conclusiones sobre si las intervenciones pueden ayudar con los efectos psicológicos de la cirugía en mujeres portadoras de BRCA. Se necesita más investigación para concluir cuál es la mejor manera de apoyar a las mujeres que eligen la cirugía. [45]
En una mujer que no ha desarrollado cáncer de mama, la extirpación de los senos puede reducir su riesgo de que alguna vez le diagnostiquen cáncer de mama en un 90%, a un nivel que es aproximadamente la mitad del riesgo promedio de una mujer. [9] : 209–244
La mastectomía bilateral es la extirpación de ambos senos por parte de un cirujano mamario. [9] : 209–244 La mastectomía radical modificada sólo se utiliza en mujeres diagnosticadas con cáncer de mama invasivo. Las técnicas para mastectomías profilácticas incluyen: [9] : 209–244
La técnica que se utilice está determinada por la existencia de cáncer y el estado de salud general, así como por el deseo de la mujer, si lo hubiera, de someterse a una cirugía de reconstrucción mamaria con fines estéticos. [9] : 209–244 Las mujeres que eligen una apariencia de pecho plano o utilizan prótesis mamarias externas normalmente eligen la mastectomía simple, con su mayor reducción del riesgo. [9] : 209–244
La reconstrucción mamaria generalmente la realiza un cirujano plástico y puede iniciarse como parte de la misma cirugía de varias horas que extirpa los senos. Se han utilizado múltiples técnicas de reconstrucción, con diferentes ubicaciones y cantidades de cicatriz. Algunas técnicas utilizan tejido de otra parte del cuerpo, como tejido graso de la parte inferior del abdomen u ocasionalmente músculos de otras partes del torso. Otros utilizan implantes mamarios , posiblemente precedidos de expansores de tejido, para aportar volumen. Algunas técnicas de reconstrucción requieren múltiples cirugías. Luego, a algunas mujeres se les agregan tatuajes para simular las areolas de los senos o se les remodela la piel para formar un pezón. [9] : 209–244
Se recomienda encarecidamente la ooforectomía (extirpación quirúrgica de los ovarios) y la salpingectomía (extirpación quirúrgica de las trompas de Falopio) a las mujeres con mutaciones BRCA . [9] : 275–302 La salpingooforectomía es el método más eficaz para prevenir el cáncer de ovario y de trompas de Falopio en mujeres con una mutación BRCA . Sin embargo, persiste un pequeño riesgo de cáncer peritoneal primario , al menos entre las mujeres con mutaciones BRCA1 , ya que el revestimiento peritoneal es del mismo tipo de células que partes del ovario. Se estima que este riesgo produce alrededor de cinco casos de cáncer peritoneal por cada 100 mujeres con mutaciones dañinas en BRCA1 en los 20 años posteriores a la cirugía. [9] : 275–302
El cáncer de ovario relacionado con BRCA2 tiende a presentarse en mujeres perimenopáusicas o menopáusicas, por lo que se recomienda la salpingooforectomía entre los 45 y 50 años. [9] : 275–302
La cirugía a menudo se realiza junto con una histerectomía (extirpación quirúrgica del útero) y, a veces, una cervicectomía (extirpación quirúrgica del cuello uterino ), especialmente en mujeres que desean tomar tamoxifeno , que se sabe que causa cáncer de útero, o que tienen cáncer de útero . fibromas . [9] : 275–302 Hay múltiples estilos de cirugía disponibles, incluida la cirugía laparoscópica (ojo de cerradura). Debido a que alrededor del 5% de las mujeres con una mutación BRCA tienen cáncer de ovario no detectado en el momento de la cirugía planificada, la cirugía debe tratarse como si fuera la extirpación de un cáncer conocido. [9] : 275–302
La salpingooforectomía deja a la mujer estéril (incapaz de tener hijos). Los servicios de infertilidad se pueden utilizar para preservar sus óvulos , si así lo desea. Sin embargo, como los beneficios de la cirugía son mayores cerca de la menopausia, la mayoría de las mujeres simplemente posponen la cirugía hasta que ya hayan tenido tantos hijos como deseen. [9] : 275–302
La cirugía también induce artificialmente la menopausia, que provoca sofocos , alteraciones del sueño, cambios de humor, sequedad vaginal, dificultades sexuales, dificultad para recordar palabras y otros signos y síntomas médicos . Los efectos secundarios varían de leves a graves; la mayoría se puede tratar al menos parcialmente. Muchas mujeres con BRCA toman terapia de reemplazo hormonal para reducir estos efectos: combinaciones de estrógeno y progesterona para mujeres que tienen útero y estrógeno sin oposición para mujeres a quienes se les extirpó el útero. El estrógeno puede causar cáncer de mama, pero como la cantidad de estrógeno que se toma es menor que la cantidad producida por los ovarios ahora extirpados, el riesgo neto generalmente se considera aceptable. [9] : 303–317
Algunas fuentes suponen que la ooforectomía antes de los 50 años duplica el riesgo de enfermedad cardiovascular y aumenta el riesgo de fracturas de cadera causadas por osteoporosis en la población relevante. [14]
Dados los altos riesgos y los bajos beneficios de las elecciones de estilo de vida en los portadores de la mutación BRCA , ninguna elección de estilo de vida proporciona protección suficiente. [9] : 113-142
Tener su primer hijo a una edad más temprana, tener más hijos que el promedio y amamantar durante más de un año disminuye el riesgo de cáncer de mama para una mujer con riesgo promedio. [9] : 113–142 Los estudios sobre este efecto entre portadoras de mutaciones BRCA han producido resultados contradictorios, pero en términos generales, se cree que tener hijos proporciona poca o ninguna protección contra el cáncer de mama en mujeres con mutaciones BRCA1 y, paradójicamente, aumenta el riesgo de Cáncer de mama en mujeres con mutaciones BRCA2 . [9] : 113-142 [17]
Estar físicamente activo y mantener un peso corporal saludable previene el cáncer de mama y otros tipos de cáncer en la población general, además de prevenir enfermedades cardíacas y otras afecciones médicas. Entre las mujeres con una mutación BRCA , ser físicamente activa y haber tenido un peso corporal saludable en la adolescencia no tiene ningún efecto sobre el cáncer de ovario y retrasa, pero no previene por completo, el cáncer de mama después de la menopausia. [9] : 113–142 [46] En algunos estudios, sólo el ejercicio intenso y significativo produjo algún beneficio. [9] : 113–142 La obesidad y el aumento de peso en la edad adulta están asociados con el diagnóstico de cáncer de mama. [9] : 113-142
Los estudios sobre alimentos, dietas o suplementos dietéticos específicos generalmente han producido información contradictoria o, en el caso de las grasas dietéticas , el consumo de soja y el consumo de té verde , solo se han realizado en mujeres con riesgo promedio. [9] : 113–142 La única intervención dietética generalmente aceptada como prevención del cáncer de mama en portadoras de mutaciones BRCA es minimizar el consumo de bebidas alcohólicas . El consumo de más de una bebida alcohólica por día está fuertemente asociado con un mayor riesgo de desarrollar cáncer de mama y, por lo general, se recomienda a las portadoras que no consuman más de una bebida alcohólica por día y no más de cuatro en total por semana. [9] : 113-142
En un estudio realizado con mujeres judías asquenazíes se observó que las portadoras de mutaciones nacidas antes de 1940 tienen un riesgo mucho menor de ser diagnosticadas con cáncer de mama a los 50 años que las nacidas después de 1940; esto también se observó en la población no portadora. [46] Se desconocen las razones de la diferencia. A diferencia de la población general, la edad de la menarquia y la edad de la menopausia no tiene ningún efecto sobre el riesgo de cáncer de mama para las portadoras de la mutación BRCA . [9] : 113-142
Varias hipótesis proponen que las mutaciones BRCA podrían tener ventajas evolutivas, como una mayor inteligencia. La hipótesis de la inteligencia asquenazí fue propuesta por Gregory Cochran y afirma que un defecto en el gen BRCA1 podría desencadenar un crecimiento neuronal. [47]
Los estudios han demostrado que las mutaciones de BRCA1 no son aleatorias, sino que se someten a selección adaptativa, lo que indica que aunque las mutaciones de BRCA1 están relacionadas con el cáncer de mama, es probable que también tengan un efecto beneficioso. [48]
La Universidad de Utah, el Instituto Nacional de Ciencias de la Salud Ambiental (NIEHS) y Myriad Genetics presentaron una solicitud de patente para el gen BRCA1 aislado y las mutaciones que promueven el cáncer mencionadas anteriormente, así como métodos para diagnosticar la probabilidad de contraer cáncer de mama. en 1994; [5] Durante el año siguiente, Myriad, en colaboración con investigadores de Endo Recherche, Inc., HSC Research & Development Limited Partnership y la Universidad de Pensilvania, aisló y secuenció el gen BRCA2 e identificó mutaciones clave, y se obtuvo la primera patente de BRCA2 . presentada en los EE. UU. por Myriad y otras instituciones en 1995. [6] Myriad es el licenciatario exclusivo de estas patentes y las ha aplicado en los EE. UU. frente a los laboratorios de diagnóstico clínico. [8] Este modelo de negocio llevó a Myriad a crecer como una startup en 1994 hasta convertirse en una empresa que cotiza en bolsa con 1200 empleados y alrededor de 500 millones de dólares en ingresos anuales en 2012; [7] también generó controversia sobre los altos precios y la incapacidad de obtener segundas opiniones de otros laboratorios de diagnóstico, lo que a su vez llevó a la histórica demanda de la Asociación de Patología Molecular contra Myriad Genetics . [8] [49] Las patentes comenzaron a expirar en 2014.
Según un artículo publicado en la revista Genetic Medicine en 2010, "La historia de las patentes fuera de los Estados Unidos es más complicada... Por ejemplo, se han obtenido patentes, pero los sistemas de salud provinciales de Canadá las ignoran. En Australia y el Reino Unido, el licenciatario de Myriad permitió su uso en los sistemas de salud, pero anunció un cambio de planes en agosto de 2008. ... Sólo se ha patentado una mutación en la única patente europea de Myriad, aunque algunas patentes siguen bajo revisión de un procedimiento de oposición. De hecho, Estados Unidos es la única jurisdicción donde la sólida posición de patentes de Myriad le ha conferido el estatus de proveedor único". [50] [51] Peter Meldrum, director ejecutivo de Myriad Genetics, ha reconocido que Myriad tiene "otras ventajas competitivas que pueden hacer que dicha aplicación [de patentes] sea innecesaria" en Europa. [52]
Las decisiones legales relacionadas con las patentes BRCA1 y BRCA2 afectarán el campo de las pruebas genéticas en general. [53] En junio de 2013, en Association for Molecular Pathology v. Myriad Genetics (Nº 12-398), la Corte Suprema de Estados Unidos dictaminó por unanimidad que "un segmento de ADN de origen natural es un producto de la naturaleza y no es elegible para patente simplemente porque ha sido aislado", invalidando las patentes de Myriad sobre los genes BRCA1 y BRCA2. Sin embargo, el Tribunal también sostuvo que la manipulación de un gen para crear algo que no se encuentra en la naturaleza aún podría ser elegible para protección por patente. [54]
{{cite book}}: |journal=ignorado ( ayuda )