_-_Google_Art_Project.jpg/440px-The_Temple_Scroll_(11Q20)_-_Google_Art_Project.jpg)
La datación por radiocarbono (también conocida como datación por carbono o datación por carbono-14 ) es un método para determinar la edad de un objeto que contiene material orgánico utilizando las propiedades del radiocarbono , un isótopo radiactivo del carbono .
El método fue desarrollado a finales de la década de 1940 en la Universidad de Chicago por Willard Libby , basándose en la creación constante de radiocarbono (14
C ) en la atmósfera terrestre por la interacción de los rayos cósmicos con el nitrógeno atmosférico . El resultado14
El C se combina con el oxígeno atmosférico para formar dióxido de carbono radiactivo , que se incorpora a las plantas mediante la fotosíntesis ; los animales luego adquieren14
C al comer las plantas. Cuando el animal o la planta mueren, dejan de intercambiar carbono con su entorno y, a partir de entonces, la cantidad de14
El contenido de C comienza a disminuir a medida que14
El C sufre desintegración radiactiva . Medición de la proporción de14
El contenido de C en una muestra de una planta o un animal muerto, como un trozo de madera o un fragmento de hueso, proporciona información que se puede utilizar para calcular cuándo murió el animal o la planta. Cuanto más antigua sea una muestra, menos14
C debe detectarse, y debido a que la vida media de14
C (el período de tiempo después del cual la mitad de una muestra dada se habrá desintegrado) es de aproximadamente 5.730 años, las fechas más antiguas que se pueden medir de manera confiable mediante este proceso datan de aproximadamente hace 50.000 años (en este intervalo aproximadamente el 99,8% de la14
C se habrá desintegrado), aunque en ocasiones los métodos de preparación especiales permiten un análisis preciso de muestras más antiguas. En 1960, Libby recibió el Premio Nobel de Química por su trabajo.
Desde la década de 1960 se están realizando investigaciones para determinar cuál es la proporción de14
El C en la atmósfera ha sido durante los últimos 50.000 años. Los datos resultantes, en forma de curva de calibración , se utilizan ahora para convertir una medición dada de radiocarbono en una muestra en una estimación de la edad del calendario de la muestra. Se deben realizar otras correcciones para tener en cuenta la proporción de14
C en diferentes tipos de organismos (fraccionamiento) y los diferentes niveles de14
C en toda la biosfera (efectos de reservorio). Otras complicaciones son la quema de combustibles fósiles, como el carbón y el petróleo, y las pruebas nucleares en superficie realizadas en los años 1950 y 1960.
Porque el tiempo que lleva convertir materiales biológicos en combustibles fósiles es sustancialmente mayor que el tiempo que lleva su14
C se descompone por debajo de niveles detectables, los combustibles fósiles casi no contienen14
C. Como resultado, a partir de finales del siglo XIX, hubo una notable caída en la proporción de14
C en la atmósfera a medida que el dióxido de carbono generado por la quema de combustibles fósiles comenzó a acumularse. Por el contrario, las pruebas nucleares aumentaron la cantidad de14
C en la atmósfera, que alcanzó un máximo alrededor de 1965 de casi el doble de la cantidad presente en la atmósfera antes de las pruebas nucleares.
La medición del radiocarbono se realizó originalmente con dispositivos de conteo beta, que contaban la cantidad de radiación beta emitida por la descomposición14
Átomos de C en una muestra. Más recientemente, la espectrometría de masas con acelerador se ha convertido en el método de elección; cuenta todos los14
C átomos en la muestra y no sólo los pocos que se desintegran durante las mediciones; por lo tanto, se puede utilizar con muestras mucho más pequeñas (tan pequeñas como semillas de plantas individuales), y da resultados mucho más rápidamente. El desarrollo de la datación por radiocarbono ha tenido un profundo impacto en la arqueología . Además de permitir una datación más precisa dentro de los sitios arqueológicos que los métodos anteriores, permite la comparación de fechas de eventos a grandes distancias. Las historias de la arqueología a menudo se refieren a su impacto como la "revolución del radiocarbono". La datación por radiocarbono ha permitido fechar transiciones clave en la prehistoria, como el final de la última edad de hielo y el comienzo del Neolítico y la Edad del Bronce en diferentes regiones.
En 1939, Martin Kamen y Samuel Ruben , del Laboratorio de Radiación de Berkeley, comenzaron a realizar experimentos para determinar si alguno de los elementos comunes en la materia orgánica tenía isótopos con vidas medias lo suficientemente largas como para ser de utilidad en la investigación biomédica. Sintetizaron14
C usando el acelerador de ciclotrón del laboratorio y pronto descubrió que la vida media del átomo era mucho más larga de lo que se había pensado anteriormente. [1] Esto fue seguido por una predicción de Serge A. Korff , entonces empleado en el Instituto Franklin en Filadelfia , de que la interacción de los neutrones térmicos con14
El N en la atmósfera superior crearía14
C . [nota 1] [3] [4] Anteriormente se había pensado que14
Sería más probable que C se creara mediante la interacción de deuterones con13
C. [1] En algún momento durante la Segunda Guerra Mundial, Willard Libby , que entonces estaba en Berkeley, se enteró de la investigación de Korff y concibió la idea de que podría ser posible utilizar el radiocarbono para la datación. [3] [4]
En 1945, Libby se trasladó a la Universidad de Chicago , donde comenzó su trabajo sobre la datación por radiocarbono. En 1946 publicó un artículo en el que proponía que el carbono presente en la materia viva podría incluir14
C así como carbono no radiactivo. [5] [6] Libby y varios colaboradores procedieron a experimentar con metano recogido de plantas de tratamiento de aguas residuales de Baltimore, y después de enriquecer isotópicamente sus muestras pudieron demostrar que contenían14
C. Por el contrario, el metano creado a partir del petróleo no mostró actividad de radiocarbono debido a su edad. Los resultados se resumieron en un artículo en Science en 1947, en el que los autores comentaron que sus resultados implicaban que sería posible datar materiales que contuvieran carbono de origen orgánico. [5] [7]
Libby y James Arnold procedieron a probar la teoría de la datación por radiocarbono analizando muestras con edades conocidas. Por ejemplo, dos muestras tomadas de las tumbas de dos reyes egipcios, Zoser y Esnefru , datadas independientemente en 2625 a. C. más o menos 75 años, fueron datadas por medición de radiocarbono en un promedio de 2800 a. C. más o menos 250 años. Estos resultados fueron publicados en Science en diciembre de 1949. [8] [9] [nota 2] En los 11 años posteriores a su anuncio, se habían establecido más de 20 laboratorios de datación por radiocarbono en todo el mundo. [11] En 1960, Libby recibió el Premio Nobel de Química por este trabajo. [5]
En la naturaleza, el carbono existe como tres isótopos : el carbono-12 (12
C ) y carbono-13 (13
C ) son estables y no radiactivos; el carbono-14 (14
C ), también conocido como "radiocarbono", es radiactivo. La vida media del14
C (el tiempo que tarda en evaporarse la mitad de una cantidad dada de14
El tiempo de desintegración del C ) es de unos 5.730 años, por lo que se podría esperar que su concentración en la atmósfera disminuyera a lo largo de miles de años, pero14
El C se produce constantemente en la estratosfera inferior y la troposfera superior , principalmente por los rayos cósmicos galácticos y, en menor grado, por los rayos cósmicos solares. [5] [12] Estos rayos cósmicos generan neutrones a medida que viajan a través de la atmósfera que pueden golpear el nitrógeno-14 (14
N ) átomos y convertirlos en14
C . [5] La siguiente reacción nuclear es la vía principal por la cual14
Se crea C :
n+14
7norte
→14
6do
+ p
donde n representa un neutrón y p representa un protón . [13] [14] [nota 3]
Una vez producido, el14
El C se combina rápidamente con el oxígeno ( O ) en la atmósfera para formar primero monóxido de carbono ( CO ), [14] y finalmente dióxido de carbono ( CO
2). [15]
14 C + O2 → 14 CO + O
14CO2 + OH → 14CO2 + H
El dióxido de carbono producido de esta manera se difunde en la atmósfera, se disuelve en el océano y es absorbido por las plantas a través de la fotosíntesis . Los animales comen las plantas y, en última instancia, el radiocarbono se distribuye por toda la biosfera .14
C a12
C es aproximadamente 1,25 partes de14
C a 10 12 partes de12
C. [16] Además , aproximadamente el 1% de los átomos de carbono son del isótopo estable13
C . [5]
La ecuación para la desintegración radiactiva de14
C es: [17]
14
6do
→14
7norte
+
mi−
+
a
mi
Al emitir una partícula beta (un electrón , e − ) y un antineutrino electrónico (
a
mi), uno de los neutrones en el14
El núcleo C se transforma en un protón y el14
El núcleo C vuelve al isótopo estable (no radiactivo)14
N . [18]
Durante su vida, una planta o un animal se encuentra en equilibrio con su entorno intercambiando carbono ya sea con la atmósfera o a través de su dieta. Por lo tanto, tendrá la misma proporción de carbono.14
C como la atmósfera, o en el caso de los animales o plantas marinas, con el océano. Una vez que muere, deja de adquirir14
C , pero el14
El C dentro de su material biológico en ese momento continuará descomponiéndose, y por lo tanto la relación de14
C a12
El C en sus restos disminuirá gradualmente. Porque14
El C se desintegra a una velocidad conocida, la proporción de radiocarbono se puede utilizar para determinar cuánto tiempo ha pasado desde que una muestra dada dejó de intercambiar carbono: cuanto más antigua sea la muestra, menos14
C quedará a la izquierda. [16]
La ecuación que rige la desintegración de un isótopo radiactivo es: [5]
donde N 0 es el número de átomos del isótopo en la muestra original (en el tiempo t = 0, cuando murió el organismo del que se tomó la muestra), y N es el número de átomos que quedan después del tiempo t . [5] λ es una constante que depende del isótopo particular; para un isótopo dado es igual al recíproco de la vida media , es decir, el tiempo promedio o esperado que un átomo dado sobrevivirá antes de sufrir una desintegración radiactiva. [5] La vida media, denotada por τ , de14
C son 8.267 años, [nota 4] por lo que la ecuación anterior puede reescribirse como: [20]
Se supone que la muestra originalmente tenía el mismo14
C /12
La relación C es la relación en la atmósfera y, dado que se conoce el tamaño de la muestra, se puede calcular el número total de átomos en la muestra, lo que da como resultado N 0 , el número de14
Átomos de C en la muestra original. Medición de N , el número de14
Los átomos de C que se encuentran actualmente en la muestra permiten calcular t , la edad de la muestra, utilizando la ecuación anterior. [16]
La vida media de un isótopo radiactivo (generalmente denotada por t 1/2 ) es un concepto más familiar que la vida media, por lo que, aunque las ecuaciones anteriores se expresan en términos de la vida media, es más habitual citar el valor de14
La vida media de C es mayor que su vida media. El valor aceptado actualmente para la vida media de14
C es 5.700 ± 30 años. [21] Esto significa que después de 5.700 años, sólo la mitad de la14
Quedará C ; una cuarta parte quedará después de 11.400 años; una octava parte después de 17.100 años; y así sucesivamente.
Los cálculos anteriores parten de varias suposiciones, como por ejemplo que el nivel de14
El C en la atmósfera se ha mantenido constante a lo largo del tiempo. [5] De hecho, el nivel de14
La C en la atmósfera ha variado significativamente y, como resultado, los valores proporcionados por la ecuación anterior deben corregirse utilizando datos de otras fuentes. [22] Esto se hace mediante curvas de calibración (que se analizan a continuación), que convierten una medición de14
C en una muestra en una edad de calendario estimada. Los cálculos implican varios pasos e incluyen un valor intermedio llamado "edad de radiocarbono", que es la edad en "años de radiocarbono" de la muestra: una edad expresada en años de radiocarbono significa que no se ha utilizado una curva de calibración − los cálculos para los años de radiocarbono suponen que la atmósfera14
C /12
La relación C no ha cambiado con el tiempo. [23] [24]

Para calcular las edades del radiocarbono también se requiere el valor de la vida media.14
C. En el artículo de Libby de 1949, utilizó un valor de 5720 ± 47 años, basado en la investigación de Engelkemeir et al. [25] Esto era notablemente cercano al valor moderno, pero poco después el valor aceptado fue revisado a 5568 ± 30 años, [26] y este valor estuvo en uso durante más de una década. Fue revisado nuevamente a principios de la década de 1960 a 5730 ± 40 años, [27] [28] lo que significó que muchas fechas calculadas en artículos publicados antes de esto eran incorrectas (el error en la vida media es de aproximadamente el 3%). [nota 5] Para mantener la coherencia con estos primeros artículos, se acordó en la Conferencia de Radiocarbono de 1962 en Cambridge (Reino Unido) utilizar la "vida media de Libby" de 5568 años. Las edades de radiocarbono todavía se calculan utilizando esta vida media, y se conocen como "Edad de Radiocarbono Convencional". Dado que la curva de calibración (IntCal) también informa la temperatura atmosférica pasada14
Concentración de C utilizando esta edad convencional, cualquier edad convencional calibrada contra la curva IntCal producirá una edad calibrada correcta. Cuando se cita una fecha, el lector debe tener en cuenta que si es una fecha no calibrada (un término utilizado para las fechas dadas en años de radiocarbono) puede diferir sustancialmente de la mejor estimación de la fecha del calendario real, tanto porque utiliza el valor incorrecto para la vida media de14
C , y porque no se ha aplicado ninguna corrección (calibración) para la variación histórica de14
C en la atmósfera a lo largo del tiempo. [23] [24] [30] [nota 6]

El carbono se distribuye por toda la atmósfera, la biosfera y los océanos; estos se denominan colectivamente reservorio de intercambio de carbono, [33] y cada componente también se denomina individualmente reservorio de intercambio de carbono. Los diferentes elementos del reservorio de intercambio de carbono varían en la cantidad de carbono que almacenan y en el tiempo que tarda en almacenarse.14
C generado por los rayos cósmicos para mezclarse completamente con ellos. Esto afecta la proporción de14
C a12
C en los diferentes yacimientos, y por lo tanto las edades de radiocarbono de las muestras que se originaron en cada yacimiento. [5] La atmósfera, que es donde14
Se genera C , que contiene aproximadamente el 1,9% del carbono total en los reservorios y el14
C contiene mezclas en menos de siete años. [34] La relación de14
C a12
El C en la atmósfera se toma como base para los demás reservorios: si otro reservorio tiene una proporción menor de14
C a12
C , indica que el carbono es más antiguo y, por lo tanto, que alguno de los14
El carbono se ha desintegrado o el depósito está recibiendo carbono que no se encuentra en la línea de base atmosférica. [22] La superficie del océano es un ejemplo: contiene el 2,4% del carbono en el depósito de intercambio, pero solo hay alrededor del 95%14
C como sería de esperar si la proporción fuera la misma que en la atmósfera. [5] El tiempo que tarda el carbono de la atmósfera en mezclarse con la superficie del océano es de solo unos pocos años, [35] pero las aguas superficiales también reciben agua del océano profundo, que tiene más del 90% del carbono en el depósito. [22] El agua en el océano profundo tarda unos 1.000 años en circular de regreso a través de las aguas superficiales, por lo que las aguas superficiales contienen una combinación de agua más antigua, con agua agotada.14
C , y agua recientemente en la superficie, con14
C en equilibrio con la atmósfera. [22]
Las criaturas que viven en la superficie del océano tienen la misma14
Las proporciones de C son las mismas que las del agua en la que viven y, como resultado de la reducción14
C /12
En relación con el carbono C , la edad de radiocarbono de la vida marina suele ser de unos 400 años. [36] [37] Los organismos terrestres están en mayor equilibrio con la atmósfera y tienen la misma14
C /12
C ratio como la atmósfera. [5] [nota 8] Estos organismos contienen alrededor del 1,3% del carbono en el depósito; los organismos marinos tienen una masa de menos del 1% de los de la tierra y no se muestran en el diagrama. La materia orgánica muerta acumulada, tanto de plantas como de animales, excede la masa de la biosfera en un factor de casi 3, y como esta materia ya no intercambia carbono con su entorno, tiene una14
C /12
Relación C inferior a la de la biosfera. [5]
La variación en la14
C /12
La relación C en diferentes partes del depósito de intercambio de carbono significa que un cálculo sencillo de la edad de una muestra basada en la cantidad de14
El código C que contiene suele dar un resultado incorrecto. Hay otras posibles fuentes de error que deben tenerse en cuenta. Los errores son de cuatro tipos generales:
En los primeros años de uso de la técnica, se entendió que dependía de la atmósfera.14
C /12
La proporción de carbono se mantuvo igual durante los miles de años anteriores. Para verificar la precisión del método, se probaron varios artefactos que se podían datar con otras técnicas; los resultados de las pruebas coincidieron razonablemente con las edades reales de los objetos. Sin embargo, con el tiempo comenzaron a aparecer discrepancias entre la cronología conocida de las dinastías egipcias más antiguas y las fechas de radiocarbono de los artefactos egipcios. Ni la cronología egipcia preexistente ni el nuevo método de datación por radiocarbono podían considerarse precisos, pero una tercera posibilidad era que la14
C /12
La proporción de C había cambiado con el tiempo. La cuestión se resolvió mediante el estudio de los anillos de los árboles : [39] [40] [41] la comparación de series superpuestas de anillos de los árboles permitió la construcción de una secuencia continua de datos de anillos de los árboles que abarcaba 8.000 años. [39] (Desde entonces, la serie de datos de anillos de los árboles se ha ampliado a 13.900 años). [30] En la década de 1960, Hans Suess pudo utilizar la secuencia de anillos de los árboles para demostrar que las fechas derivadas del radiocarbono eran consistentes con las fechas asignadas por los egiptólogos. Esto fue posible porque, aunque las plantas anuales, como el maíz, tienen una14
C /12
Relación C que refleja la relación atmosférica en el momento en que crecieron, los árboles solo agregan material a su anillo más externo en un año determinado, mientras que los anillos internos no obtienen su14
C se repone y en cambio solo pierde14
C por desintegración radiactiva. Por lo tanto, cada anillo conserva un registro de la atmósfera.14
C /12
Relación C del año en que creció. La datación por carbono de la madera a partir de los propios anillos de los árboles proporciona la comprobación necesaria de la atmósfera.14
C /12
Relación C : con una muestra de fecha conocida y una medición del valor de N (el número de átomos de14
C restante en la muestra), la ecuación de datación por carbono permite calcular N 0 – el número de átomos de14
C en la muestra en el momento en que se formó el anillo del árbol, y por lo tanto14
C /12
Relación C en la atmósfera en ese momento. [39] [41] Equipados con los resultados de la datación por carbono de los anillos de los árboles, fue posible construir curvas de calibración diseñadas para corregir los errores causados por la variación a lo largo del tiempo en la14
C /12
Relación C. [42] Estas curvas se describen con más detalle a continuación.
El carbón y el petróleo comenzaron a quemarse en grandes cantidades durante el siglo XIX. Ambos son lo suficientemente antiguos como para contener poco o ningún contenido detectable.14
C y, como resultado, el CO
2liberado diluyó sustancialmente la atmósfera14
C /12
Relación C. Datar un objeto de principios del siglo XX da como resultado una fecha aparente más antigua que la verdadera. Por la misma razón,14
Las concentraciones de C en las proximidades de las grandes ciudades son inferiores a la media atmosférica. Este efecto de los combustibles fósiles (también conocido como efecto Suess, en honor a Hans Suess, quien lo informó por primera vez en 1955) sólo supondría una reducción del 0,2% en14
Actividad de C si el carbono adicional proveniente de combustibles fósiles se distribuyera a lo largo del reservorio de intercambio de carbono, pero debido a la larga demora en la mezcla con el océano profundo, el efecto real es una reducción del 3%. [39] [43]
Un efecto mucho mayor proviene de las pruebas nucleares en la superficie, que liberaron grandes cantidades de neutrones a la atmósfera, lo que resultó en la creación de14
C. Desde aproximadamente 1950 hasta 1963, cuando se prohibieron las pruebas nucleares atmosféricas , se estima que varias toneladas de14
C fueron creados. Si todo este extra14
Si el carbono se hubiera distribuido inmediatamente por todo el depósito de intercambio de carbono, habría provocado un aumento de la14
C /12
La proporción C es de sólo un pequeño porcentaje, pero el efecto inmediato fue casi duplicar la cantidad de14
C en la atmósfera, con el nivel máximo alcanzado en 1964 en el hemisferio norte y en 1966 en el hemisferio sur. Desde entonces, el nivel ha disminuido, ya que este pulso de bomba o "carbono de bomba" (como se lo llama a veces) se filtra al resto del depósito. [39] [43] [44] [38]
La fotosíntesis es el proceso principal por el cual el carbono pasa de la atmósfera a los seres vivos. En las vías fotosintéticas12
La vitamina C se absorbe un poco más fácilmente que13
C , que a su vez se absorbe más fácilmente que14
C. La absorción diferencial de los tres isótopos de carbono conduce a13
C /12
C y14
C /12
Las proporciones de C en las plantas difieren de las proporciones en la atmósfera. Este efecto se conoce como fraccionamiento isotópico. [45] [46]
Para determinar el grado de fraccionamiento que se lleva a cabo en una planta determinada, se miden las cantidades de ambos12
C y13
Se miden los isótopos C y se obtiene el resultado13
C /12
Luego, la relación C se compara con una relación estándar conocida como PDB. [ nota 9]13
C /12
Se utiliza la relación C en lugar de14
C /12
C porque el primero es mucho más fácil de medir y el segundo se puede derivar fácilmente: el agotamiento de13
C relativo a12
C es proporcional a la diferencia de masas atómicas de los dos isótopos, por lo que el agotamiento de14
C es el doble del agotamiento de13
C . [22] El fraccionamiento de13
C , conocido como δ 13 C , se calcula de la siguiente manera: [45]
‰
donde el signo ‰ indica partes por mil . [45] Debido a que el estándar PDB contiene una proporción inusualmente alta de13
C , [nota 10] el δ 13 C más medidoLos valores son negativos.

En el caso de los organismos marinos, los detalles de las reacciones de la fotosíntesis son menos conocidos y el δ 13 CLos valores de CO2 para los organismos fotosintéticos marinos dependen de la temperatura. A temperaturas más altas, el CO2
2Tiene poca solubilidad en agua, lo que significa que hay menos CO
2disponible para las reacciones fotosintéticas. En estas condiciones, el fraccionamiento se reduce y a temperaturas superiores a 14 °C (57 °F) el δ 13 CLos valores son correspondientemente más altos, mientras que a temperaturas más bajas, el CO
2se vuelve más soluble y, por lo tanto, más disponible para los organismos marinos. [46]
El δ 13 CEl valor para los animales depende de su dieta. Un animal que come alimentos con alto contenido de δ 13 CLos valores tendrán un δ 13 C más altoque uno que come alimentos con menor δ 13 Cvalores. [45] Los propios procesos bioquímicos del animal también pueden influir en los resultados: por ejemplo, tanto los minerales óseos como el colágeno óseo suelen tener una mayor concentración de13
C que el que se encuentra en la dieta del animal, aunque por razones bioquímicas diferentes. El enriquecimiento de los huesos13
C también implica que el material excretado se agota en13
C en relación con la dieta. [49]
Desde13
El C constituye aproximadamente el 1% del carbono en una muestra, el13
C /12
La relación C se puede medir con precisión mediante espectrometría de masas . [22] Valores típicos de δ 13 CSe han encontrado experimentalmente para muchas plantas, así como para diferentes partes de animales como el colágeno óseo , pero al fechar una muestra dada es mejor determinar el δ 13 Cvalor para esa muestra directamente en lugar de confiar en los valores publicados. [45]
El intercambio de carbono entre el CO atmosférico
2y el carbonato en la superficie del océano también está sujeto a fraccionamiento, con14
C en la atmósfera con mayor probabilidad que12
C se disuelve en el océano. El resultado es un aumento general de la14
C /12
Relación C en el océano del 1,5%, con respecto a la14
C /12
Relación C en la atmósfera. Este aumento en14
La concentración de C anula casi exactamente la disminución causada por el afloramiento de agua (que contiene agua vieja y, por lo tanto,14
C -agotado, carbono) de las profundidades del océano, por lo que las mediciones directas de14
Las mediciones de la radiación C son similares a las del resto de la biosfera. Si se corrige el fraccionamiento isotópico, como se hace para todas las fechas de radiocarbono para permitir la comparación entre los resultados de diferentes partes de la biosfera, se obtiene una edad aparente de unos 400 años para el agua superficial del océano. [22] [37]
La hipótesis original del depósito de intercambio de Libby suponía que14
C /12
La relación C en el depósito de intercambio es constante en todo el mundo, [50] pero desde entonces se ha descubierto que hay varias causas de variación en la relación en el depósito. [36]
El CO
2El dióxido de carbono presente en la atmósfera se transfiere al océano al disolverse en el agua superficial como iones de carbonato y bicarbonato; al mismo tiempo, los iones de carbonato en el agua regresan al aire como CO2.
2. [50] Este proceso de intercambio trae14
C de la atmósfera a las aguas superficiales del océano, pero la14
El C introducido de esta manera tarda mucho tiempo en filtrarse por todo el volumen del océano. Las partes más profundas del océano se mezclan muy lentamente con las aguas superficiales y la mezcla es desigual. El principal mecanismo que lleva las aguas profundas a la superficie es el afloramiento, que es más común en las regiones más cercanas al ecuador. El afloramiento también está influenciado por factores como la topografía del fondo oceánico local y las costas, el clima y los patrones de viento. En general, la mezcla de aguas profundas y superficiales lleva mucho más tiempo que la mezcla del CO atmosférico.
2con las aguas superficiales, y como resultado, el agua de algunas áreas profundas del océano tiene una edad radiocarbonada aparente de varios miles de años. La surgencia mezcla esta agua "vieja" con el agua superficial, dando al agua superficial una edad aparente de alrededor de varios cientos de años (después de corregir el fraccionamiento). [36] Este efecto no es uniforme: el efecto promedio es de unos 400 años, pero hay desviaciones locales de varios cientos de años para áreas que están geográficamente cercanas entre sí. [36] [37] Estas desviaciones se pueden tener en cuenta en la calibración, y los usuarios de software como CALIB pueden proporcionar como entrada la corrección apropiada para la ubicación de sus muestras. [15] El efecto también se aplica a organismos marinos como conchas y mamíferos marinos como ballenas y focas, que tienen edades radiocarbonadas que parecen tener cientos de años. [36]
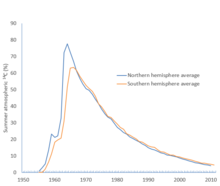
Los hemisferios norte y sur tienen sistemas de circulación atmosférica que son suficientemente independientes entre sí como para que haya un desfase temporal notable en la mezcla entre ambos.14
C /12
La proporción de carbono es menor en el hemisferio sur, con una edad adicional aparente de unos 40 años para los resultados de radiocarbono del sur en comparación con los del norte. [nota 11] Esto se debe a que la mayor superficie del océano en el hemisferio sur significa que hay más intercambio de carbono entre el océano y la atmósfera que en el norte. Dado que la superficie del océano se agota en14
C por el efecto marino,14
El C se elimina de la atmósfera del sur más rápidamente que en el norte. [36] [51] El efecto se ve reforzado por un fuerte afloramiento alrededor de la Antártida. [12]
Si el carbono en el agua dulce se adquiere en parte a partir de carbono antiguo, como las rocas, entonces el resultado será una reducción en la14
C /12
Relación C en el agua. Por ejemplo, los ríos que pasan sobre piedra caliza , que está compuesta principalmente de carbonato de calcio , adquirirán iones de carbonato. De manera similar, el agua subterránea puede contener carbono derivado de las rocas por las que ha pasado. Estas rocas suelen ser tan antiguas que ya no contienen ningún valor mensurable.14
C , por lo que este carbono reduce la14
C /12
C relación del agua en la que entra, lo que puede dar lugar a edades aparentes de miles de años tanto para el agua afectada como para las plantas y organismos de agua dulce que viven en ella. [22] Esto se conoce como el efecto del agua dura porque a menudo se asocia con iones de calcio, que son característicos del agua dura; otras fuentes de carbono como el humus pueden producir resultados similares y también pueden reducir la edad aparente si son de origen más reciente que la muestra. [36] El efecto varía mucho y no hay una compensación general que se pueda aplicar; por lo general, se necesita investigación adicional para determinar el tamaño de la compensación, por ejemplo, comparando la edad de radiocarbono de las conchas de agua dulce depositadas con el material orgánico asociado. [52]
Las erupciones volcánicas expulsan grandes cantidades de carbono al aire. El carbono es de origen geológico y no tiene rastros detectables.14
C , entonces el14
C /12
La proporción de carbono en las inmediaciones del volcán es baja en relación con las áreas circundantes. Los volcanes inactivos también pueden emitir carbono envejecido. Las plantas que realizan la fotosíntesis de este carbono también tienen niveles más bajos de carbono.14
C /12
Relaciones C : por ejemplo, se encontró que las plantas en las cercanías de la caldera de Furnas en las Azores tenían edades aparentes que variaban entre 250 años y 3320 años. [53]
Cualquier adición de carbono a una muestra de una edad diferente hará que la fecha medida sea inexacta. La contaminación con carbono moderno hace que una muestra parezca más joven de lo que realmente es: el efecto es mayor para las muestras más antiguas. Si una muestra de 17.000 años se contamina de modo que el 1% de la muestra es carbono moderno, parecerá 600 años más joven; para una muestra de 34.000 años, la misma cantidad de contaminación causaría un error de 4.000 años. La contaminación con carbono antiguo, sin restos14
C , provoca un error en la dirección opuesta, independientemente de la edad: una muestra contaminada con un 1% de carbono antiguo parecerá tener unos 80 años más de lo que realmente es, independientemente de la fecha de la muestra. [54]
Las muestras para datación deben convertirse a un formato adecuado para medir la14
Contenido de carbono ; esto puede significar la conversión a forma gaseosa, líquida o sólida, según la técnica de medición que se utilice. Antes de que esto se pueda hacer, la muestra debe ser tratada para eliminar cualquier contaminación y cualquier componente no deseado. [55] Esto incluye la eliminación de contaminantes visibles, como las raicillas que pueden haber penetrado en la muestra desde su enterramiento. [55] Se pueden utilizar lavados alcalinos y ácidos para eliminar la contaminación por ácido húmico y carbonato, pero se debe tener cuidado de evitar eliminar la parte de la muestra que contiene el carbono que se va a analizar. [56]
En particular, para muestras más antiguas, puede ser útil enriquecer la cantidad de14
C en la muestra antes de la prueba. Esto se puede hacer con una columna de difusión térmica. El proceso lleva alrededor de un mes y requiere una muestra aproximadamente diez veces más grande de lo que se necesitaría de otra manera, pero permite una medición más precisa de la14
C /12
La relación C en material antiguo amplía la edad máxima que se puede informar de manera confiable. [58]
Una vez eliminada la contaminación, las muestras deben convertirse a un formato adecuado para la tecnología de medición que se va a utilizar. [59] Cuando se requiere gas, se puede utilizar CO
2se utiliza ampliamente. [59] [60] Para que las muestras se utilicen en contadores de centelleo líquido , el carbono debe estar en forma líquida; la muestra normalmente se convierte en benceno . Para la espectrometría de masas con acelerador , los objetivos de grafito sólido son los más comunes, aunque el CO gaseoso
2También se puede utilizar. [59] [61]
La cantidad de material necesario para la prueba depende del tipo de muestra y de la tecnología que se utilice. Existen dos tipos de tecnología de prueba: detectores que registran la radiactividad, conocidos como contadores beta, y espectrómetros de masas con acelerador. Para los contadores beta, normalmente se requiere una muestra que pese al menos 10 gramos (0,35 onzas). [59] La espectrometría de masas con acelerador es mucho más sensible y se pueden utilizar muestras que contengan tan sólo 0,5 miligramos de carbono. [62]

Durante décadas después de que Libby realizó los primeros experimentos de datación por radiocarbono, la única forma de medir la14
El objetivo del método era detectar la desintegración radiactiva de átomos de carbono individuales en una muestra. [59] En este enfoque, lo que se mide es la actividad, en número de eventos de desintegración por unidad de masa por período de tiempo, de la muestra. [60] Este método también se conoce como "conteo beta", porque son las partículas beta emitidas por la desintegración14
Átomos de C que se detectan. [63] A finales de la década de 1970 se puso a disposición un enfoque alternativo: contar directamente el número de14
C y12
Átomos de C en una muestra dada, mediante espectrometría de masas con acelerador, generalmente denominada AMS. [59] La AMS cuenta los14
C /12
C ratio directamente, en lugar de la actividad de la muestra, pero las mediciones de actividad y14
C /12
La relación C se puede convertir entre sí con exactitud. [60] Durante algún tiempo, los métodos de conteo beta fueron más precisos que el AMS, pero ahora el AMS es más preciso y se ha convertido en el método de elección para las mediciones de radiocarbono. [64] [65] Además de una precisión mejorada, el AMS tiene otras dos ventajas significativas sobre el conteo beta: puede realizar pruebas precisas en muestras demasiado pequeñas para el conteo beta y es mucho más rápido: se puede lograr una precisión del 1% en minutos con el AMS, que es mucho más rápido de lo que se podría lograr con la tecnología anterior. [66]
El primer detector de Libby fue un contador Geiger de su propio diseño. Convirtió el carbono de su muestra en negro de humo (hollín) y recubrió con él la superficie interior de un cilindro. Este cilindro se insertó en el contador de tal manera que el alambre de conteo estuviera dentro del cilindro de muestra, para que no hubiera material entre la muestra y el alambre. [59] Cualquier material interpuesto habría interferido con la detección de radiactividad, ya que las partículas beta emitidas por la descomposición14
Los C son tan débiles que la mitad son detenidos por un espesor de aluminio de 0,01 mm (0,00039 pulgadas). [60]
El método de Libby pronto fue reemplazado por los contadores proporcionales de gas , que se vieron menos afectados por el carbono de la bomba (el14
C creado por pruebas de armas nucleares). Estos contadores registran ráfagas de ionización causadas por las partículas beta emitidas por la descomposición14
Átomos de C ; las explosiones son proporcionales a la energía de la partícula, por lo que se pueden identificar e ignorar otras fuentes de ionización, como la radiación de fondo. Los contadores están rodeados por un blindaje de plomo o acero, para eliminar la radiación de fondo y reducir la incidencia de los rayos cósmicos. Además, se utilizan detectores de anticoincidencia ; estos registran los eventos fuera del contador y cualquier evento registrado simultáneamente tanto dentro como fuera del contador se considera un evento extraño y se ignora. [60]
La otra tecnología común utilizada para medir14
La actividad C es el recuento por centelleo líquido, que se inventó en 1950, pero que tuvo que esperar hasta principios de los años 1960, cuando se desarrollaron métodos eficientes de síntesis de benceno, para poder competir con el recuento de gases; después de 1970, los contadores líquidos se convirtieron en la opción tecnológica más común para los laboratorios de datación de nueva construcción. Los contadores funcionan detectando destellos de luz causados por las partículas beta emitidas por14
C a medida que interactúan con un agente fluorescente añadido al benceno. Al igual que los contadores de gas, los contadores de centelleo líquido requieren contadores de protección y de anticoincidencia. [67] [68]
Tanto en el caso del contador proporcional de gas como en el de centelleo líquido, lo que se mide es el número de partículas beta detectadas en un período de tiempo determinado. Dado que se conoce la masa de la muestra, esta se puede convertir a una medida estándar de actividad en unidades de conteos por minuto por gramo de carbono (cpm/g C) o bequerelios por kg (Bq/kg C, en unidades del SI ). Cada dispositivo de medición también se utiliza para medir la actividad de una muestra en blanco, una muestra preparada a partir de carbono lo suficientemente antiguo como para no tener actividad. Esto proporciona un valor para la radiación de fondo, que se debe restar de la actividad medida de la muestra que se está datando para obtener la actividad atribuible únicamente a la actividad de esa muestra.14
C. Además, se mide una muestra con una actividad estándar, para proporcionar una línea base para la comparación. [69]
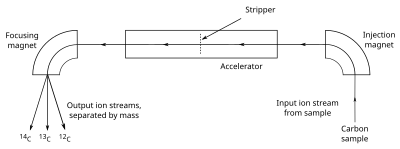
AMS cuenta los átomos de14
C y12
C en una muestra dada, determinando la14
C /12
C ratio directamente. La muestra, a menudo en forma de grafito, se hace emitir iones C − (átomos de carbono con una sola carga negativa), que se inyectan en un acelerador . Los iones se aceleran y pasan a través de un stripper, que elimina varios electrones para que los iones salgan con una carga positiva. Los iones, que pueden tener de 1 a 4 cargas positivas (C + a C 4+ ), según el diseño del acelerador, pasan a continuación a través de un imán que curva su trayectoria; los iones más pesados se curvan menos que los más ligeros, por lo que los diferentes isótopos emergen como corrientes separadas de iones. A continuación, un detector de partículas registra el número de iones detectados en el14
C corriente, pero dado que el volumen de12
C (y13
C , necesaria para la calibración) es demasiado grande para la detección de iones individuales, los conteos se determinan midiendo la corriente eléctrica creada en una copa de Faraday . [70] La gran carga positiva inducida por el separador fuerza a moléculas como13
CH , que tiene un peso bastante cercano a14
C para interferir con las mediciones, para disociarse, de modo que no se detecten. [71] La mayoría de las máquinas AMS también miden el δ 13 C de la muestra., para su uso en el cálculo de la edad de radiocarbono de la muestra. [72] El uso de AMS, a diferencia de formas más simples de espectrometría de masas, es necesario debido a la necesidad de distinguir los isótopos de carbono de otros átomos o moléculas que están muy cerca en masa, como14
N y13
CH . [59] Al igual que con el recuento beta, se utilizan tanto muestras en blanco como muestras estándar. [70] Se pueden medir dos tipos diferentes de blanco: una muestra de carbono muerto que no ha sufrido ningún procesamiento químico, para detectar cualquier fondo de máquina, y una muestra conocida como blanco de proceso hecho de carbono muerto que se procesa en material objetivo exactamente de la misma manera que la muestra que se está fechando. Cualquier14
Es probable que la señal C del fondo en blanco de la máquina sea causada por haces de iones que no han seguido el camino esperado dentro del detector o por hidruros de carbono como12
es
2o13
C. A14
La señal C del blanco de proceso mide la cantidad de contaminación introducida durante la preparación de la muestra. Estas mediciones se utilizan en el cálculo posterior de la edad de la muestra. [73]
Los cálculos a realizar sobre las mediciones realizadas dependen de la tecnología utilizada, ya que los contadores beta miden la radiactividad de la muestra mientras que el AMS determina la relación de los tres isótopos de carbono diferentes en la muestra. [73]
Para determinar la edad de una muestra cuya actividad se ha medido mediante recuento beta, se debe encontrar la relación entre su actividad y la actividad del estándar. Para determinar esto, se mide una muestra en blanco (de carbono viejo o muerto) y una muestra de actividad conocida. Las muestras adicionales permiten detectar y corregir errores como la radiación de fondo y los errores sistemáticos en la configuración del laboratorio. [69] El material de muestra estándar más común es el ácido oxálico, como el estándar HOxII, del cual el Instituto Nacional de Estándares y Tecnología (NIST) preparó 1000 lb (450 kg) en 1977 a partir de cosechas de remolacha francesa. [74] [75]
Los resultados de las pruebas AMS se presentan en forma de proporciones de12
C ,13
C , y14
C , que se utilizan para calcular Fm, la "fracción moderna". Esta se define como la relación entre la14
C /12
Relación C en la muestra y la14
C /12
Relación C en el carbono moderno, que a su vez se define como la14
C /12
Relación C que se habría medido en 1950 si no hubiera habido efecto de los combustibles fósiles. [73]
Tanto los resultados del recuento beta como los del AMS deben corregirse por fraccionamiento. Esto es necesario porque diferentes materiales de la misma edad, que debido al fraccionamiento tienen naturalmente diferentes14
C /12
Las proporciones C parecerán ser de diferentes edades porque14
C /12
La proporción C se toma como indicador de la edad. Para evitar esto, todas las mediciones de radiocarbono se convierten a la medición que se habría obtenido si la muestra hubiera sido de madera, que tiene un δ conocido.13
Valor C de −25‰. [23]
Una vez corregido14
C /12
Se conoce la relación C , se calcula una "edad de radiocarbono" utilizando: [76]
El cálculo utiliza 8.033 años, la vida media derivada de la vida media de Libby de 5.568 años, no 8.267 años, la vida media derivada del valor moderno más preciso de 5.730 años. El valor de Libby para la vida media se utiliza para mantener la coherencia con los primeros resultados de las pruebas de radiocarbono; las curvas de calibración incluyen una corrección para esto, por lo que se garantiza la precisión de las edades del calendario finales informadas. [76]
La fiabilidad de los resultados se puede mejorar alargando el tiempo de prueba. Por ejemplo, si contar las desintegraciones beta durante 250 minutos es suficiente para dar un error de ± 80 años, con un 68% de confianza, entonces duplicar el tiempo de conteo a 500 minutos permitirá obtener una muestra con solo la mitad de esa cantidad.14
C debe medirse con el mismo término de error de 80 años. [77]
La datación por radiocarbono generalmente se limita a la datación de muestras de no más de 50.000 años de antigüedad, ya que las muestras más antiguas tienen una datación insuficiente.14
C para que sea medible. Se han obtenido fechas más antiguas utilizando técnicas especiales de preparación de muestras, muestras de gran tamaño y tiempos de medición muy largos. Estas técnicas pueden permitir la medición de fechas de hasta 60.000 y, en algunos casos, de hasta 75.000 años antes del presente. [64]
Las fechas de radiocarbono se presentan generalmente con un rango de una desviación estándar (normalmente representada por la letra griega sigma como 1σ) a cada lado de la media. Sin embargo, un rango de fechas de 1σ representa solo un nivel de confianza del 68%, por lo que la edad real del objeto que se mide puede estar fuera del rango de fechas citado. Esto se demostró en 1970 mediante un experimento realizado por el laboratorio de radiocarbono del Museo Británico, en el que se tomaron mediciones semanales en la misma muestra durante seis meses. Los resultados variaron ampliamente (aunque consistentemente con una distribución normal de errores en las mediciones) e incluyeron múltiples rangos de fechas (de confianza de 1σ) que no se superponían entre sí. Las mediciones incluyeron una con un rango de aproximadamente 4.250 a aproximadamente 4.390 años atrás, y otra con un rango de aproximadamente 4.520 a aproximadamente 4.690. [78]
Los errores de procedimiento también pueden dar lugar a errores en los resultados. Si el 1% del benceno de una muestra de referencia moderna se evapora accidentalmente, el recuento de centelleo dará una edad de radiocarbono que es demasiado joven por unos 80 años. [79]

Los cálculos dados anteriormente producen fechas en años de radiocarbono: es decir, fechas que representan la edad que tendría la muestra si14
C /12
La relación C había sido constante históricamente. [80] Aunque Libby había señalado ya en 1955 la posibilidad de que esta suposición fuera incorrecta, no fue hasta que comenzaron a acumularse discrepancias entre las edades medidas y las fechas históricas conocidas de los artefactos que quedó claro que sería necesario aplicar una corrección a las edades de radiocarbono para obtener las fechas del calendario. [81]
Para producir una curva que pueda utilizarse para relacionar los años del calendario con los años de radiocarbono, se necesita una secuencia de muestras datadas de forma segura que puedan analizarse para determinar su edad de radiocarbono. El estudio de los anillos de los árboles condujo a la primera secuencia de este tipo: piezas individuales de madera muestran secuencias características de anillos que varían en grosor debido a factores ambientales como la cantidad de lluvia en un año determinado. Estos factores afectan a todos los árboles de una zona, por lo que examinar las secuencias de anillos de los árboles de madera antigua permite la identificación de secuencias superpuestas. De esta manera, una secuencia ininterrumpida de anillos de los árboles puede extenderse mucho más allá del pasado. La primera secuencia publicada de este tipo, basada en anillos de árboles de pino longevo, fue creada por Wesley Ferguson . [41] Hans Suess utilizó estos datos para publicar la primera curva de calibración para la datación por radiocarbono en 1967. [39] [40] [81] La curva mostró dos tipos de variación de la línea recta: una fluctuación de largo plazo con un período de aproximadamente 9.000 años, y una variación de corto plazo, a menudo denominada "movimientos", con un período de décadas. Suess dijo que trazó la línea que muestra los movimientos mediante " schwung cósmico ", con lo que quiso decir que las variaciones fueron causadas por fuerzas extraterrestres. Durante algún tiempo no estuvo claro si los movimientos eran reales o no, pero ahora están bien establecidos. [39] [40] [82] Estas fluctuaciones de corto plazo en la curva de calibración ahora se conocen como efectos de Vries, en honor a Hessel de Vries . [83]
Se utiliza una curva de calibración tomando la fecha de radiocarbono informada por un laboratorio y leyéndola en sentido opuesto a esa fecha en el eje vertical del gráfico. El punto donde esta línea horizontal interseca la curva dará la edad calendárica de la muestra en el eje horizontal. Esto es lo inverso de la forma en que se construye la curva: un punto en el gráfico se deriva de una muestra de edad conocida, como un anillo de un árbol; cuando se prueba, la edad de radiocarbono resultante da un punto de datos para el gráfico. [42]

Durante los siguientes treinta años se publicaron muchas curvas de calibración utilizando una variedad de métodos y enfoques estadísticos. [42] Estas fueron reemplazadas por la serie de curvas IntCal, comenzando con IntCal98, publicada en 1998 y actualizada en 2004, 2009, 2013 y 2020. [84] Las mejoras de estas curvas se basan en nuevos datos recopilados de anillos de árboles, varvas , corales , macrofósiles de plantas , espeleotemas y foraminíferos . Hay curvas separadas para el hemisferio norte (IntCal20) y el hemisferio sur (SHCal20), ya que difieren sistemáticamente debido al efecto del hemisferio. La secuencia continua de fechas de anillos de árboles para el hemisferio norte se remonta a 13.910 AP a partir de 2020, y esto proporciona una datación cercana a la anual para IntCal20 durante gran parte del período, reducida donde hay mesetas de calibración y aumentada cuando los picos de 14 C a corto plazo debido a los eventos de Miyake proporcionan una correlación adicional. La datación por radiocarbono anterior a la secuencia continua de anillos de árboles se basa en la correlación con registros más aproximados. [85] SHCal20 se basa en datos independientes cuando es posible y se deriva de la curva norte agregando el desplazamiento promedio para el hemisferio sur donde no había datos directos disponibles. También hay una curva de calibración marina separada, MARINE20. [86] [87] Para un conjunto de muestras que forman una secuencia con una separación conocida en el tiempo, estas muestras forman un subconjunto de la curva de calibración. La secuencia se puede comparar con la curva de calibración y se puede establecer la mejor coincidencia con la secuencia. Esta técnica de "coincidencia de ondulaciones" puede conducir a una datación más precisa que la que es posible con las fechas de radiocarbono individuales. [88] El método de comparación de oscilaciones se puede utilizar en lugares donde hay una meseta en la curva de calibración, [nota 12] y por lo tanto puede proporcionar una fecha mucho más precisa que la que pueden producir los métodos de intersección o probabilidad. [90] La técnica no se limita a los anillos de los árboles; por ejemplo, una secuencia de tefra estratificada en Nueva Zelanda, que se cree que es anterior a la colonización humana de las islas, ha sido datada en 1314 d. C. ± 12 años mediante el método de comparación de oscilaciones. [91] Las oscilaciones también significan que leer una fecha a partir de una curva de calibración puede dar más de una respuesta: esto ocurre cuando la curva se mueve hacia arriba y hacia abajo lo suficiente como para que la edad del radiocarbono intercepte la curva en más de un lugar, lo que puede llevar a que un resultado de radiocarbono se informe como dos rangos de edad separados, correspondientes a las dos partes de la curva que la edad del radiocarbono interceptó. [42]
Las técnicas estadísticas bayesianas se pueden aplicar cuando hay varias fechas de radiocarbono que deben calibrarse. Por ejemplo, si se toma una serie de fechas de radiocarbono de diferentes niveles en una secuencia estratigráfica, el análisis bayesiano se puede utilizar para evaluar fechas que son atípicas y calcular distribuciones de probabilidad mejoradas, basándose en la información previa de que la secuencia debe ordenarse en el tiempo. [88] Cuando se introdujo el análisis bayesiano, su uso estaba limitado por la necesidad de utilizar computadoras centrales para realizar los cálculos, pero desde entonces la técnica se ha implementado en programas disponibles para computadoras personales, como OxCal. [92]
Desde que se dataron las primeras muestras se han utilizado varios formatos para citar los resultados de radiocarbono. A partir de 2019, el formato estándar requerido por la revista Radiocarbon es el siguiente. [93]
Las fechas no calibradas deben informarse como " laboratorio : año ± rango BP", donde:
Por ejemplo, la fecha no calibrada "UtC-2020: 3510 ± 60 BP" indica que la muestra fue analizada por el Laboratorio Utrecht van der Graaff ("UtC"), donde tiene un número de muestra de "2020", y que la edad no calibrada es 3510 años antes del presente, ± 60 años. A veces se utilizan formas relacionadas: por ejemplo, "2,3 ka BP" significa 2300 años de radiocarbono antes del presente (es decir, 350 a. C.), y "14
Se podría utilizar "C año BP" para distinguir la fecha no calibrada de una fecha derivada de otro método de datación como la termoluminiscencia . [93]
Calibrado14
Las fechas C se informan con frecuencia como "cal BP", "cal BC" o "cal AD", nuevamente con "BP" haciendo referencia al año 1950 como la fecha cero. [94] El radiocarbono ofrece dos opciones para informar las fechas calibradas. Un formato común es "calibración de rango de confianza de fecha ", donde:
Por ejemplo, "cal 1220–1281 d. C. (1σ)" significa una fecha calibrada para la cual la fecha verdadera se encuentra entre 1220 d. C. y 1281 d. C., con un nivel de confianza de '1 sigma', o aproximadamente 68% . Las fechas calibradas también se pueden expresar como "BP" en lugar de usar "BC" y "AD". La curva utilizada para calibrar los resultados debe ser la última curva IntCal disponible. Las fechas calibradas también deben identificar cualquier programa, como OxCal, utilizado para realizar la calibración. [93] Además, un artículo en Radiocarbon en 2014 sobre las convenciones de informes de fechas de radiocarbono recomienda que se proporcione información sobre el tratamiento de la muestra, incluido el material de la muestra, los métodos de pretratamiento y las mediciones de control de calidad; que la cita del software utilizado para la calibración debe especificar el número de versión y cualquier opción o modelo utilizado; y que la fecha calibrada debe darse con las probabilidades asociadas para cada rango. [95]
Un concepto clave en la interpretación de las fechas de radiocarbono es la asociación arqueológica : ¿cuál es la verdadera relación entre dos o más objetos en un sitio arqueológico? Con frecuencia sucede que una muestra para la datación por radiocarbono puede tomarse directamente del objeto de interés, pero también hay muchos casos en los que esto no es posible. Los ajuares funerarios de metal, por ejemplo, no pueden fecharse por radiocarbono, pero pueden encontrarse en una tumba con un ataúd, carbón u otro material que se puede suponer que se depositó al mismo tiempo. En estos casos, una fecha para el ataúd o el carbón es indicativa de la fecha de deposición de los ajuares funerarios, debido a la relación funcional directa entre los dos. También hay casos en los que no hay una relación funcional, pero la asociación es razonablemente fuerte: por ejemplo, una capa de carbón en un pozo de basura proporciona una fecha que tiene una relación con el pozo de basura. [96]
La contaminación es un tema de especial preocupación cuando se trata de datar material muy antiguo obtenido de excavaciones arqueológicas y se requiere un gran cuidado en la selección y preparación de los especímenes. En 2014, Thomas Higham y sus colaboradores sugirieron que muchas de las fechas publicadas para artefactos neandertales son demasiado recientes debido a la contaminación por "carbono joven". [97]
A medida que un árbol crece, solo el anillo más externo intercambia carbono con su entorno, por lo que la edad medida para una muestra de madera depende de dónde se toma la muestra. Esto significa que las fechas de radiocarbono en las muestras de madera pueden ser más antiguas que la fecha en la que se taló el árbol. Además, si un trozo de madera se utiliza para múltiples propósitos, puede haber un retraso significativo entre la tala del árbol y el uso final en el contexto en el que se encuentra. [98] Esto a menudo se conoce como el problema de la madera vieja . [5] Un ejemplo es la pista de la Edad de Bronce en Withy Bed Copse, en Inglaterra; la pista se construyó con madera que claramente había sido trabajada para otros fines antes de ser reutilizada en la pista. Otro ejemplo es la madera flotante , que puede usarse como material de construcción. No siempre es posible reconocer la reutilización. Otros materiales pueden presentar el mismo problema: por ejemplo, se sabe que algunas comunidades neolíticas usaron betún para impermeabilizar cestas; La edad radiocarbónica del betún será mayor que la que se puede medir en el laboratorio, independientemente de la edad real del contexto, por lo que las pruebas del material de la cesta darán una edad engañosa si no se tiene cuidado. Un problema aparte, relacionado con la reutilización, es el del uso prolongado o la deposición tardía. Por ejemplo, un objeto de madera que permanece en uso durante un período prolongado tendrá una edad aparente mayor que la edad real del contexto en el que se deposita. [98]
La arqueología no es el único campo en el que se utiliza la datación por radiocarbono. Las dataciones por radiocarbono también se pueden utilizar en geología, sedimentología y estudios de lagos, por ejemplo. La capacidad de datar muestras diminutas mediante AMS ha significado que los paleobotánicos y paleoclimatólogos pueden utilizar la datación por radiocarbono directamente en polen purificado a partir de secuencias de sedimentos, o en pequeñas cantidades de material vegetal o carbón. Las fechas en material orgánico recuperado de estratos de interés se pueden utilizar para correlacionar estratos en diferentes lugares que parecen ser similares desde el punto de vista geológico. La datación del material de un lugar proporciona información sobre la fecha del otro lugar, y las fechas también se utilizan para ubicar los estratos en la cronología geológica general. [99]
El radiocarbono también se utiliza para datar el carbono liberado de los ecosistemas, en particular para monitorear la liberación de carbono antiguo que anteriormente estaba almacenado en los suelos como resultado de perturbaciones humanas o del cambio climático. [100] Los avances recientes en las técnicas de recolección de datos en el campo también permiten la datación por radiocarbono del metano y el dióxido de carbono , que son importantes gases de efecto invernadero . [101] [102]
El Pleistoceno es una época geológica que comenzó hace unos 2,6 millones de años. El Holoceno , la época geológica actual, comienza hace unos 11.700 años cuando termina el Pleistoceno. [103] Establecer la fecha de este límite −que está definido por un fuerte calentamiento climático− con la mayor precisión posible ha sido un objetivo de los geólogos durante gran parte del siglo XX. [103] [104] En Two Creeks , en Wisconsin, se descubrió un bosque fósil ( Two Creeks Buried Forest State Natural Area ), y la investigación posterior determinó que la destrucción del bosque fue causada por el avance del hielo de Valders, el último movimiento de hielo hacia el sur antes del final del Pleistoceno en esa zona. Antes de la llegada de la datación por radiocarbono, los árboles fosilizados se habían datado correlacionando secuencias de capas de sedimentos depositadas anualmente en Two Creeks con secuencias en Escandinavia. Esto llevó a estimaciones de que los árboles tenían entre 24.000 y 19.000 años de antigüedad, [103] y por lo tanto se tomó como la fecha del último avance de la glaciación de Wisconsin antes de que su retroceso final marcara el final del Pleistoceno en América del Norte. [105] En 1952, Libby publicó fechas de radiocarbono para varias muestras del sitio Two Creeks y dos sitios similares cercanos; las fechas se promediaron en 11.404 AP con un error estándar de 350 años. Este resultado no estaba calibrado, ya que aún no se entendía la necesidad de calibrar las edades de radiocarbono. Otros resultados durante la siguiente década respaldaron una fecha promedio de 11.350 AP, y se pensó que los resultados más precisos promediaban 11.600 AP. Hubo resistencia inicial a estos resultados por parte de Ernst Antevs , el paleobotánico que había trabajado en la serie de varvas escandinavas, pero sus objeciones finalmente fueron descartadas por otros geólogos. En la década de 1990, se analizaron muestras con AMS, obteniéndose fechas (sin calibrar) que iban desde 11.640 AP hasta 11.800 AP, ambas con un error estándar de 160 años. Posteriormente, se utilizó una muestra del bosque fósil en una prueba interlaboratorio, cuyos resultados fueron proporcionados por más de 70 laboratorios. Estas pruebas produjeron una edad media de 11.788 ± 8 AP (confianza de 2σ) que, cuando se calibra, da un rango de fechas de 13.730 a 13.550 cal AP. [103] Las fechas de radiocarbono de Two Creeks se consideran ahora un resultado clave para desarrollar la comprensión moderna de la glaciación norteamericana a fines del Pleistoceno. [105]

En 1947, se descubrieron rollos en cuevas cerca del Mar Muerto que resultaron contener escritura en hebreo y arameo , la mayoría de los cuales se cree que fueron producidos por los esenios , una pequeña secta judía. Estos rollos son de gran importancia en el estudio de los textos bíblicos porque muchos de ellos contienen la versión más antigua conocida de los libros de la Biblia hebrea. [106] Una muestra de la envoltura de lino de uno de estos rollos, el Gran Rollo de Isaías , fue incluida en un análisis de 1955 por Libby, con una edad estimada de 1.917 ± 200 años. [106] [107] Con base en un análisis del estilo de escritura, se hicieron estimaciones paleográficas de la edad de 21 de los rollos, y muestras de la mayoría de estos, junto con otros rollos que no habían sido datados paleográficamente, fueron analizadas por dos laboratorios de AMS en la década de 1990. Los resultados oscilaron en edad desde principios del siglo IV a. C. hasta mediados del siglo IV d. C. En todos los casos, excepto dos, se determinó que los rollos estaban dentro de los 100 años de la edad determinada paleográficamente. El rollo de Isaías se incluyó en la prueba y se encontró que tenía dos rangos de fechas posibles con un nivel de confianza de 2σ, debido a la forma de la curva de calibración en ese punto: hay una probabilidad del 15% de que data de 355 a 295 a. C., y una probabilidad del 84% de que data de 210 a 45 a. C. Posteriormente, estas fechas fueron criticadas con el argumento de que antes de que se probaran los rollos, se habían tratado con aceite de ricino moderno para facilitar la lectura de la escritura; se argumentó que no eliminar el aceite de ricino lo suficiente habría causado que las fechas fueran demasiado jóvenes. Se han publicado múltiples artículos que apoyan y se oponen a la crítica. [106]
Poco después de la publicación del artículo de Libby de 1949 en Science , universidades de todo el mundo comenzaron a establecer laboratorios de datación por radiocarbono y, a fines de la década de 1950, había más de 20 laboratorios activos.14
C. Enseguida se hizo evidente que los principios de la datación por radiocarbono eran válidos, a pesar de ciertas discrepancias, cuyas causas entonces seguían siendo desconocidas. [108]
El desarrollo de la datación por radiocarbono ha tenido un profundo impacto en la arqueología, a menudo descrito como la "revolución del radiocarbono". [109] En palabras del antropólogo R. E. Taylor, "14
Los datos de C hicieron posible una prehistoria mundial al aportar una escala de tiempo que trasciende las fronteras locales, regionales y continentales". Proporciona una datación más precisa dentro de los sitios que los métodos anteriores, que generalmente se derivaban de la estratigrafía o de las tipologías (por ejemplo, de herramientas de piedra o cerámica); también permite la comparación y sincronización de eventos a grandes distancias. El advenimiento de la datación por radiocarbono puede incluso haber llevado a mejores métodos de campo en arqueología, ya que un mejor registro de datos conduce a una asociación más firme de los objetos con las muestras que se van a analizar. Estos métodos de campo mejorados a veces estuvieron motivados por intentos de demostrar que un14
La fecha C era incorrecta. Taylor también sugiere que la disponibilidad de información precisa sobre la fecha liberó a los arqueólogos de la necesidad de centrar gran parte de su energía en determinar las fechas de sus hallazgos y condujo a una expansión de las cuestiones que los arqueólogos estaban dispuestos a investigar. Por ejemplo, a partir de la década de 1970, las preguntas sobre la evolución del comportamiento humano se vieron con mucha más frecuencia en la arqueología. [110]
El marco de datación proporcionado por el radiocarbono condujo a un cambio en la visión predominante de cómo las innovaciones se propagaron a través de la Europa prehistórica. Los investigadores habían pensado anteriormente que muchas ideas se propagaron por difusión a través del continente, o por invasiones de pueblos que trajeron consigo nuevas ideas culturales. A medida que las dataciones por radiocarbono comenzaron a demostrar que estas ideas eran erróneas en muchos casos, se hizo evidente que estas innovaciones a veces debían haber surgido localmente. Esto se ha descrito como una "segunda revolución del radiocarbono". En términos más generales, el éxito de la datación por radiocarbono estimuló el interés en los enfoques analíticos y estadísticos de los datos arqueológicos. [110] Taylor también ha descrito el impacto de la AMS y la capacidad de obtener mediciones precisas a partir de muestras muy pequeñas como el comienzo de una tercera revolución del radiocarbono. [111]
En ocasiones, las técnicas de datación por radiocarbono permiten datar un objeto de interés popular, por ejemplo, el Santo Sudario de Turín , un trozo de tela de lino que algunos creen que lleva una imagen de Jesucristo después de su crucifixión. Tres laboratorios separados dataron muestras de lino del Santo Sudario en 1988 ; los resultados apuntaron a orígenes del siglo XIV, lo que generó dudas sobre la autenticidad del Santo Sudario como una supuesta reliquia del siglo I. [17]
Los investigadores han estudiado otros isótopos creados por los rayos cósmicos para determinar si también podrían utilizarse para ayudar a datar objetos de interés arqueológico; dichos isótopos incluyen3Él ,10
Ser ,21No ,26Al , y36Cl . Con el desarrollo de AMS en la década de 1980, se hizo posible medir estos isótopos con la suficiente precisión para que fueran la base de técnicas de datación útiles, que se han aplicado principalmente a la datación de rocas. [112] Los isótopos radiactivos naturales también pueden formar la base de los métodos de datación, como la datación potasio-argón , la datación argón-argón y la datación en serie del uranio . [113] Otras técnicas de datación de interés para los arqueólogos incluyen la termoluminiscencia , la luminiscencia ópticamente estimulada , la resonancia de espín electrónico y la datación por trazas de fisión , así como técnicas que dependen de bandas o capas anuales, como la dendrocronología , la tefrocronología y la cronología de varvas . [114]
![]() Este artículo fue enviado a WikiJournal of Science para su revisión académica externa por pares en 2017 (informes de los revisores). El contenido actualizado fue reintegrado a la página de Wikipedia bajo una licencia CC-BY-SA-3.0 ( 2018 ). La versión de registro revisada es: Mike Christie; et al. (1 de junio de 2018). "Datación por radiocarbono" (PDF) . WikiJournal of Science . 1 (1): 6. doi : 10.15347/WJS/2018.006 . ISSN 2470-6345. Wikidata Q55120317.
Este artículo fue enviado a WikiJournal of Science para su revisión académica externa por pares en 2017 (informes de los revisores). El contenido actualizado fue reintegrado a la página de Wikipedia bajo una licencia CC-BY-SA-3.0 ( 2018 ). La versión de registro revisada es: Mike Christie; et al. (1 de junio de 2018). "Datación por radiocarbono" (PDF) . WikiJournal of Science . 1 (1): 6. doi : 10.15347/WJS/2018.006 . ISSN 2470-6345. Wikidata Q55120317.