El ácido clavulánico es un fármaco β-lactámico que funciona como un inhibidor de la β-lactamasa basado en mecanismos . Si bien no es eficaz por sí solo como antibiótico , cuando se combina con antibióticos del grupo de las penicilinas , puede superar la resistencia a los antibióticos en las bacterias que secretan β-lactamasa , que de otro modo inactiva la mayoría de las penicilinas.
En sus preparaciones más comunes, el clavulanato de potasio (ácido clavulánico como sal de potasio) se combina con:
El ácido clavulánico fue patentado en 1974. [3] Además de su inhibición de la β-lactamasa, el ácido clavulánico muestra una actividad fuera del objetivo en el sistema nervioso al regular positivamente el transportador de glutamato 1 (GLT-1) y se ha estudiado en el tratamiento potencial de una variedad de trastornos del sistema nervioso central . [1] [4]
La amoxicilina-ácido clavulánico es un tratamiento de primera línea para muchos tipos de infecciones, incluidas las infecciones de los senos nasales y las infecciones del tracto urinario , incluida la pielonefritis . Esto se debe, en parte, a su eficacia contra las bacterias gramnegativas , que tienden a ser más difíciles de controlar que las bacterias grampositivas con antibióticos quimioterapéuticos. [ Aclaración necesaria ]
El uso de ácido clavulánico con penicilinas se ha asociado con una mayor incidencia de ictericia colestásica y hepatitis aguda durante el tratamiento o poco después. La ictericia asociada suele ser autolimitada y muy raramente mortal. [5] [6]
El Comité de Seguridad de Medicamentos del Reino Unido (CSM) recomienda que los tratamientos como las preparaciones de amoxicilina/ácido clavulánico se reserven para infecciones bacterianas que probablemente sean causadas por cepas productoras de β-lactamasa resistentes a la amoxicilina, y que el tratamiento normalmente no debe exceder los 14 días.
Se han reportado reacciones alérgicas . [7]
El nombre se deriva de cepas de Streptomyces clavuligerus , que produce ácido clavulánico. [8] [9]

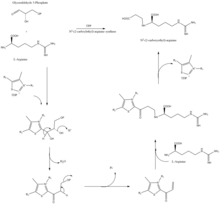
La estructura similar a la β-lactama del ácido clavulánico se parece estructuralmente a la penicilina , pero la biosíntesis de esta molécula implica una vía bioquímica diferente. El ácido clavulánico es producido por la bacteria Streptomyces clavuligerus , utilizando gliceraldehído-3-fosfato y L -arginina como materiales de partida. [10] [11] Aunque se conoce cada uno de los intermediarios de la vía, el mecanismo exacto para todas las reacciones enzimáticas no se entiende completamente. El proceso involucra principalmente 3 enzimas: clavaminato sintasa , β-lactama sintetasa y N 2 -(2-carboxietil)-L-arginina (CEA) sintasa . [10] La clavaminato sintasa es una oxigenasa no hemo dependiente de hierro y α-ceto-glutarato y está codificada por orf5 del grupo de genes del ácido clavulánico . El mecanismo específico de funcionamiento de esta enzima no se conoce por completo, pero regula tres pasos en la síntesis general del ácido clavulánico. Los tres pasos ocurren en la misma región del centro de reacción catalítico que contiene hierro, pero no ocurren en secuencia y afectan a diferentes áreas de la estructura del ácido clavulánico. [12]
La β-lactama sintetasa es una proteína de 54,5 kDa codificada por el gen orf3 del ácido clavulánico y muestra similitud con la asparagina sintasa , enzimas de clase B. El mecanismo exacto por el cual esta enzima funciona para sintetizar la β-lactama no está comprobado, pero se cree que ocurre en coordinación con una CEA sintasa y ATP . [13]

La CEA sintasa es una proteína de 60,9 kDA y es el primer gen que se encuentra en el grupo de genes de la biosíntesis del ácido clavulánico, codificado por el orf2 del grupo de genes del ácido clavulánico. El mecanismo específico de cómo funciona esta enzima aún está bajo investigación; sin embargo, se sabe que esta enzima tiene la capacidad de acoplar el gliceraldehído-3-fosfato con L-arginina en presencia de difosfato de tiamina (TDP o pirofosfato de tiamina ), que es el primer paso de la biosíntesis del ácido clavulánico. [14]
El ácido clavulánico fue descubierto alrededor de 1974-75 por científicos británicos que trabajaban en la compañía farmacéutica Beecham a partir de la bacteria Streptomyces clavuligerus . [15] Después de varios intentos, Beecham finalmente solicitó protección de patente en EE. UU. para el medicamento en 1981, y se otorgaron las patentes estadounidenses 4.525.352, 4.529.720 y 4.560.552 en 1985.
El ácido clavulánico tiene una actividad antimicrobiana intrínseca insignificante, a pesar de compartir el anillo β-lactámico característico de los antibióticos β-lactámicos . Sin embargo, la similitud en la estructura química permite que la molécula interactúe con la enzima β-lactamasa secretada por ciertas bacterias para conferir resistencia a los antibióticos β-lactámicos.
El ácido clavulánico es un inhibidor suicida que se une covalentemente a un residuo de serina en el sitio activo de la β-lactamasa. Esto reestructura la molécula de ácido clavulánico, creando una especie mucho más reactiva que ataca a otro aminoácido en el sitio activo, inactivándolo permanentemente y, por lo tanto, inactivando la enzima.
Esta inhibición restablece la actividad antimicrobiana de los antibióticos β-lactámicos contra las bacterias resistentes que secretan lactamasa. A pesar de ello, han surgido algunas cepas bacterianas que son resistentes incluso a estas combinaciones.
En 2005, se descubrió a través de la evaluación de 1.040 fármacos y nutracéuticos aprobados por la Administración de Alimentos y Medicamentos (FDA) que muchas β-lactámicas, como la ceftriaxona , regulan positivamente la expresión del transportador de glutamato astrocítico 1 (GLT-1) . [1] [16] [17] Posteriormente, se descubrió que el ácido clavulánico, también una β-lactámica, comparte esta acción. [1] [18] Los efectos asociados incluyen una mayor expresión de GLT-1 en el núcleo accumbens , la corteza prefrontal medial y la médula espinal , modulación de la neurotransmisión glutamatérgica , dopaminérgica y serotoninérgica , y efectos antiinflamatorios a través de la modulación de las citocinas factor de necrosis tumoral α (TNF-α) e interleucina-10 (IL-10). [1] [19] [4] La ceftriaxona carece de biodisponibilidad oral , tiene poca permeabilidad cerebral y tiene actividad antibiótica concomitante. [1] Estas limitaciones han dado lugar a un mayor interés en el ácido clavulánico, que no comparte estos inconvenientes y es más potente que la ceftriaxona in vivo . [1] Se desconoce el mecanismo de acción subyacente a la regulación positiva de la expresión de GLT-1 por las β-lactáminas. [1] [17] Sin embargo, las interacciones con las proteínas SNARE Munc18-1 y Rab4 pueden estar implicadas en algunos de los efectos del ácido clavulánico, como el aumento de la liberación de dopamina. [20] [21]
En relación con sus acciones en el sistema nervioso central , el ácido clavulánico se ha estudiado preclínicamente en modelos de ansiedad , comportamiento sexual , adicción , dolor neuropático , dolor inflamatorio , epilepsia , enfermedad de Parkinson , demencia y accidente cerebrovascular . [1] [19] [22] [20] En animales, incluidos roedores y/o monos, el ácido clavulánico ha mostrado efectos similares a los ansiolíticos , similares a los antidepresivos , prosexuales , potenciadores de la memoria , analgésicos , antiadictivos , prodopaminérgicos , prooxitocinérgicos y neuroprotectores . [1] [20] [18] [23] El fármaco se ha estudiado clínicamente en humanos en el tratamiento de la disfunción eréctil , [19] depresión , [24] [25] [26] dependencia de sustancias , [27] y dolor , [20] con resultados preliminares positivos o mixtos para estas afecciones informados. [4] [19] [24] [26]
El ácido clavulánico estaba bajo desarrollo formal por Revaax Pharmaceuticals (ahora Ocuphire Pharma) para el tratamiento de la disfunción eréctil, los trastornos de ansiedad , el trastorno depresivo mayor , los trastornos neurodegenerativos y la enfermedad de Parkinson. [4] [19] [24] Sin embargo, el desarrollo para estas indicaciones se interrumpió en 2014. [4] El nombre en código de desarrollo del ácido clavulánico era RX-10100 y sus nombres de marca tentativos eran Serdaxin y Zoraxel. [4] Aunque su desarrollo se interrumpió, el interés en el ácido clavulánico para posibles usos relacionados con el sistema nervioso ha continuado hasta 2024. [1] [27]