El calor latente (también conocido como energía latente o calor de transformación ) es la energía liberada o absorbida por un cuerpo o un sistema termodinámico durante un proceso de temperatura constante, generalmente una transición de fase de primer orden , como la fusión o la condensación.
El calor latente puede entenderse como la energía oculta que se suministra o se extrae para cambiar el estado de una sustancia sin cambiar su temperatura o presión. Esto incluye el calor latente de fusión (de sólido a líquido), el calor latente de vaporización (de líquido a gas) y el calor latente de sublimación (de sólido a gas). [1] [2]
El término fue introducido alrededor de 1762 por el químico escocés Joseph Black . Black utilizó el término en el contexto de la calorimetría , donde una transferencia de calor causaba un cambio de volumen en un cuerpo mientras su temperatura era constante.
A diferencia del calor latente, el calor sensible es energía transferida en forma de calor , con un cambio de temperatura resultante en un cuerpo.
Los términos calor sensible y calor latente se refieren a la energía transferida entre un cuerpo y su entorno, definida por la ocurrencia o no de un cambio de temperatura; dependen de las propiedades del cuerpo. El calor sensible se percibe o se siente en un proceso como un cambio en la temperatura del cuerpo. El calor latente es la energía transferida en un proceso sin cambio de la temperatura del cuerpo, por ejemplo, en un cambio de fase (sólido/líquido/gas).
Tanto el calor sensible como el latente se observan en muchos procesos de transferencia de energía en la naturaleza. El calor latente está asociado con el cambio de fase del agua atmosférica o del océano, la vaporización , la condensación , la congelación o la fusión , mientras que el calor sensible es la energía transferida que se evidencia en el cambio de la temperatura de la atmósfera o del océano, o del hielo, sin esos cambios de fase, aunque está asociada con cambios de presión y volumen.
El uso original del término, introducido por Black, se aplicaba a sistemas que se mantenían intencionalmente a temperatura constante. Este uso se refería al calor latente de expansión y a varios otros calores latentes relacionados. Estos calores latentes se definen independientemente del marco conceptual de la termodinámica. [3]
Cuando un cuerpo se calienta a temperatura constante mediante radiación térmica en un campo de microondas, por ejemplo, puede expandirse en una cantidad descrita por su calor latente con respecto al volumen o calor latente de expansión , o aumentar su presión en una cantidad descrita por su calor latente con respecto a la presión . [4]
El calor latente es la energía liberada o absorbida por un cuerpo o un sistema termodinámico durante un proceso a temperatura constante. Dos formas comunes de calor latente son el calor latente de fusión ( fusión ) y el calor latente de vaporización ( ebullición ). Estos nombres describen la dirección del flujo de energía al cambiar de una fase a la siguiente: de sólido a líquido y de líquido a gas.
En ambos casos el cambio es endotérmico , es decir, el sistema absorbe energía. Por ejemplo, cuando el agua se evapora, se requiere un aporte de energía para que las moléculas de agua superen las fuerzas de atracción entre ellas y realicen la transición de agua a vapor.
Si luego el vapor se condensa en líquido sobre una superficie, la energía latente del vapor absorbida durante la evaporación se libera como calor sensible del líquido sobre la superficie.
El gran valor de la entalpía de condensación del vapor de agua es la razón por la que el vapor es un medio de calentamiento mucho más efectivo que el agua hirviendo, y es más peligroso.
En meteorología , el flujo de calor latente es el flujo de energía desde la superficie de la Tierra hacia la atmósfera que está asociado con la evaporación o transpiración de agua en la superficie y la posterior condensación de vapor de agua en la troposfera . Es un componente importante del balance energético de la superficie de la Tierra. El flujo de calor latente se ha medido comúnmente con la técnica de la relación de Bowen o, más recientemente, desde mediados del siglo XX, con el método de covarianza de remolinos .
.jpg/440px-William_Cullen_(cropped).jpg)
En 1748, se publicó un relato en The Edinburgh Physical and Literary Essays de un experimento realizado por el médico y químico escocés William Cullen . Cullen había utilizado una bomba de aire para reducir la presión en un recipiente con éter dietílico . No se extrajo calor del éter, pero el éter hirvió, pero su temperatura disminuyó. [5] [6] Y en 1758, en un día cálido en Cambridge , Inglaterra, Benjamin Franklin y su colega científico John Hadley experimentaron mojando continuamente la bola de un termómetro de mercurio con éter y utilizando fuelles para evaporar el éter. [7] Con cada evaporación posterior , el termómetro marcó una temperatura más baja, llegando finalmente a 7 °F (−14 °C). Otro termómetro mostró que la temperatura ambiente era constante a 65 °F (18 °C). En su carta Cooling by Evaporation , Franklin señaló que "Uno puede ver la posibilidad de congelar a un hombre hasta la muerte en un cálido día de verano". [8]
.jpg/440px-Black_Joseph_(cropped).jpg)
La palabra inglesa latente proviene del latín latēns , que significa que yace oculto . [9] [10] El término calor latente fue introducido en la calorimetría alrededor de 1750 por Joseph Black , encargado por los productores de whisky escocés en busca de cantidades ideales de combustible y agua para su proceso de destilación para estudiar los cambios del sistema, como el volumen y la presión, cuando el sistema termodinámico se mantenía a temperatura constante en un baño termal.
Se sabía que cuando la temperatura del aire supera el punto de congelación (y el aire se convierte entonces en la fuente obvia de calor), la nieve se derrite muy lentamente y la temperatura de la nieve derretida está cerca de su punto de congelación. [5] En 1757, Black comenzó a investigar si, por lo tanto, se necesitaba calor para la fusión de un sólido, independientemente de cualquier aumento de temperatura. Hasta donde Black sabía, la opinión general en ese momento era que la fusión iba acompañada inevitablemente de un pequeño aumento de temperatura y que no se necesitaba más calor que el que requeriría el aumento de temperatura en sí mismo. Sin embargo, pronto Black pudo demostrar que se necesitaba mucho más calor durante la fusión del que podía explicarse solo por el aumento de temperatura. [11] [12] También pudo demostrar que un líquido libera calor durante su congelación; nuevamente, mucho más del que podía explicarse solo por la disminución de su temperatura. [13]
Black compararía el cambio de temperatura de dos cantidades idénticas de agua, calentadas por medios idénticos, una de las cuales, por ejemplo, se había fundido a partir de hielo, mientras que la otra se había calentado a partir de un estado líquido simplemente frío. Al comparar las temperaturas resultantes, podría concluir que, por ejemplo, la temperatura de la muestra fundida a partir de hielo era 140 °F más baja que la otra muestra, por lo que al fundir el hielo se absorbían 140 "grados de calor" que no se podían medir con el termómetro, pero que era necesario suministrar, por lo que estaba "latente" (oculto). Black también dedujo que tanto calor latente como se suministraba para hervir el destilado (lo que daba la cantidad de combustible necesaria) también tenía que absorberse para condensarlo de nuevo (lo que daba el agua de refrigeración necesaria). [14]
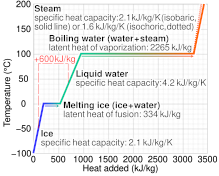
En 1762, Black anunció la siguiente investigación y los resultados a una sociedad de profesores de la Universidad de Glasgow. [15] Black había colocado masas iguales de hielo a 32 °F (0 °C) y agua a 33 °F (0,6 °C) respectivamente en dos recipientes idénticos y bien separados. El agua y el hielo se calentaron de manera uniforme a 40 °F por el aire de la habitación, que estaba a una temperatura constante de 47 °F (8 °C). Por lo tanto, el agua había recibido 40 – 33 = 7 “grados de calor”. El hielo se había calentado durante 21 veces más y, por lo tanto, había recibido 7 × 21 = 147 “grados de calor”. [a] La temperatura del hielo había aumentado en 8 °F. El hielo ahora almacenaba, por así decirlo, 8 “grados de calor” adicionales en una forma que Black llamó calor sensible , manifestado como temperatura, que podía sentirse y medirse. 147 – 8 = 139 “grados de calor” se almacenaban, por así decirlo, como calor latente , sin manifestarse. [16] [17] (En la termodinámica moderna se ha abandonado la idea del calor contenido , por lo que se han redefinido el calor sensible y el calor latente. No residen en ninguna parte.)
Black demostró a continuación que se necesitaba una temperatura del agua de 176 °F para derretir una masa igual de hielo hasta que toda la temperatura alcanzara los 32 °F. Por lo tanto, ahora parecía que se necesitaban 176 – 32 = 144 “grados de calor” para derretir el hielo. El valor moderno del calor de fusión del hielo sería 143 “grados de calor” en la misma escala (79,5 “grados de calor Celsius”). [18] [15]
Finalmente, Black aumentó la temperatura y vaporizó respectivamente dos masas iguales de agua mediante un calentamiento uniforme. Demostró que se necesitaban 830 “grados de calor” para la vaporización; nuevamente basándose en el tiempo requerido. El valor moderno para el calor de vaporización del agua sería 967 “grados de calor” en la misma escala. [19]
Más tarde, James Prescott Joule caracterizó la energía latente como la energía de interacción en una configuración dada de partículas, es decir, una forma de energía potencial , y el calor sensible como una energía que era indicada por el termómetro, [20] relacionando este último con la energía térmica .
Un calor latente específico ( L ) expresa la cantidad de energía en forma de calor ( Q ) necesaria para efectuar completamente un cambio de fase de una unidad de masa ( m ), normalmente 1 kg , de una sustancia como una propiedad intensiva :
Las propiedades intensivas son características del material y no dependen del tamaño o la extensión de la muestra. En la literatura, se citan y tabulan comúnmente el calor latente específico de fusión y el calor latente específico de vaporización para muchas sustancias.
A partir de esta definición, el calor latente para una masa dada de una sustancia se calcula mediante
dónde:
La siguiente tabla muestra los calores latentes específicos y las temperaturas de cambio de fase (a presión estándar) de algunos fluidos y gases comunes. [ cita requerida ]
El calor latente específico de condensación del agua en el rango de temperatura de -25 °C a 40 °C se aproxima mediante la siguiente función cúbica empírica:
donde la temperatura se toma como valor numérico en °C.
Para la sublimación y deposición desde y hacia el hielo, el calor latente específico es casi constante en el rango de temperatura de −40 °C a 0 °C y se puede aproximar mediante la siguiente función cuadrática empírica:

A medida que la temperatura (o presión) aumenta hasta el punto crítico , el calor latente de vaporización cae a cero.
Me inclino a creer que ambas hipótesis serán válidas: en algunos casos, particularmente en el caso del calor sensible, o tal como lo indica el termómetro, se encontrará que el calor consiste en la fuerza viva de las partículas de los cuerpos en los que se induce; mientras que en otros, particularmente en el caso del calor latente, los fenómenos se producen por la separación de partícula de partícula, de modo que hacen que se atraigan entre sí a través de un espacio mayor.Conferencia sobre la materia, la fuerza viva y el calor. 5 y 12 de mayo de 1847