El bacterioplancton se refiere al componente bacteriano del plancton que flota en la columna de agua . El nombre proviene de la palabra griega antigua πλαγκτός ( planktós ), que significa "errante" o "a la deriva", y bacteria , un término latino acuñado en el siglo XIX por Christian Gottfried Ehrenberg . Se encuentran tanto en agua de mar como en agua dulce .
El bacterioplancton ocupa una variedad de nichos ecológicos en los ecosistemas marinos y acuáticos. Son tanto productores primarios como consumidores primarios en estos ecosistemas e impulsan el ciclo biogeoquímico global de elementos esenciales para la vida (por ejemplo, carbono y nitrógeno). Muchas especies de bacterioplancton son autótrofas y obtienen energía de la fotosíntesis o la quimiosíntesis . El bacterioplancton fotosintético a menudo se clasifica como picofitoplancton e incluye grupos importantes de cianobacterias como Prochlorococcus y Synechococcus . Otro bacterioplancton heterótrofo es saprotrófico y obtiene energía al consumir material orgánico producido por otros organismos. Este material puede disolverse en el medio y tomarse directamente de allí, o las bacterias pueden vivir y crecer en asociación con material particulado como la nieve marina . El bacterioplancton juega un papel crítico en la fijación global de nitrógeno , la nitrificación , la desnitrificación , la remineralización y la metanogénesis .
La abundancia de bacterioplancton depende de variables ambientales como la temperatura, la disponibilidad de nutrientes y la depredación. Al igual que otros pequeños plancton, el bacterioplancton es depredado por el zooplancton (generalmente protozoos ) y su número también se controla mediante infecciones por bacteriófagos .

El bacterioplancton fotosintético es responsable de una gran proporción de la producción primaria total de las redes alimentarias acuáticas, suministrando compuestos orgánicos a niveles tróficos superiores. Estas bacterias realizan la fotosíntesis oxigénica y anoxigénica . Las diferencias entre estos procesos se pueden ver en los subproductos producidos, el donante primario de electrones y los pigmentos captadores de luz utilizados para la captura de energía.

Las cianobacterias son un gran grupo de bacterioplancton fotosintético, que a menudo crece como células o en colonias filamentosas. [1] Estos organismos son el grupo dominante de bacterioplancton que utiliza la fotosíntesis oxigénica en los ecosistemas acuáticos. Las cianobacterias, junto con los eucariotas fotosintéticos, son responsables de aproximadamente la mitad de la producción primaria global total [2], lo que los convierte en actores clave en la red alimentaria. Utilizan la fotosíntesis para generar energía en forma de compuestos orgánicos y producen oxígeno como subproducto. [3] Los principales pigmentos que captan luz incluyen clorofilas , ficoeriterina , ficocianina y carotenoides . [4] La mayoría de las cianobacterias que se encuentran en entornos marinos están representadas por los géneros Synechococcus y Prochlorococcus . Synechococcus es cosmopolita, habiéndose informado de su presencia en aguas templadas y tropicales. [5] Prochlorococcus es de tamaño muy pequeño y se encuentra principalmente en la zona eufótica de las aguas tropicales. [6] [7] Factores como la luz, los nutrientes y la temperatura pueden provocar que las cianobacterias proliferen y formen floraciones dañinas. [8] Las floraciones de cianobacterias pueden causar hipoxia y producir altos niveles de toxinas, lo que afecta a otros organismos acuáticos y causa enfermedades en los humanos.
Algunas cianobacterias son capaces de fijar nitrógeno . El género Anabaena utiliza células especializadas llamadas heterocistos para separar físicamente la fijación de nitrógeno y la fotosíntesis. [9] Trichodesmium es un ejemplo de cianobacteria que es capaz de fijar nitrógeno a través de una vía fotosintética alternativa. [10]
Otros bacterioplancton fotosintéticos, incluidas las bacterias púrpuras y verdes, realizan la fotosíntesis anoxigénica en condiciones anaeróbicas. Los pigmentos sintetizados en estos organismos son sensibles al oxígeno. En las bacterias púrpuras, los pigmentos principales incluyen bacterioclorofilas a y b y carotenoides. Las bacterias verdes tienen diferentes pigmentos que captan luz, que consisten en bacterioclorofilas c, d y e. [1] Estos organismos no producen oxígeno a través de la fotosíntesis ni utilizan agua como agente reductor. Muchos de estos organismos utilizan azufre, hidrógeno u otros compuestos como fuente de energía para impulsar la fotosíntesis. La mayoría de estos bacterioplancton se encuentran en aguas anóxicas , incluidos ambientes estancados e hipersalinos. [11]
El bacterioplancton heterótrofo depende de la concentración disponible de materia orgánica disuelta en la columna de agua. Por lo general, estos organismos son saprofitos y absorben nutrientes de su entorno. Estos heterótrofos también desempeñan un papel clave en el ciclo microbiano y la remineralización de compuestos orgánicos como el carbono y el nitrógeno. Las Pelagibacterales (sinónimo SAR11), también conocidas como miembros de un clado de Alphaproteobacteria , son el bacterioplancton más abundante en los océanos. Los miembros de este grupo se encuentran en aguas con baja disponibilidad de nutrientes y son depredados por protistos. [12] [13]
Roseobacter es un clado diverso y ampliamente distribuido que constituye una contribución significativa del bacterioplancton marino, representando aproximadamente el 20% de las aguas costeras y el 15% de los océanos superficiales de capa mixta . Aunque muchos son heterótrofos, algunos son capaces de realizar una forma única de fotosíntesis llamada fototrofia anoxigénica aeróbica , que requiere oxígeno en lugar de producirlo. [14] [15]
El carbono atmosférico es secuestrado en el océano por tres bombas principales que se conocen desde hace 30 años: la bomba de solubilidad , la bomba de carbonato y la bomba biológica de carbono (BCP). [16] La bomba biológica de carbono es una bomba de transmisión vertical impulsada principalmente por el hundimiento de partículas ricas en materia orgánica. El fitoplancton bacteriano cerca de la superficie incorpora CO2 atmosférico y otros nutrientes a su biomasa durante la fotosíntesis. En el momento de su muerte, este fitoplancton, junto con su carbono incorporado, se hunde hasta el fondo del océano, donde el carbono permanece durante miles de años. [17] El otro secuestro de carbono mediado biológicamente en el océano se produce a través de la bomba microbiana. La bomba microbiana es responsable de la producción de carbono orgánico disuelto (COD) recalcitrante antiguo que tiene más de 100 años. [16] El plancton del océano es incapaz de descomponer este COD recalcitrante y, por lo tanto, permanece en los océanos durante miles de años sin ser respirado. Las dos bombas funcionan simultáneamente y se cree que el equilibrio entre ellas varía según la disponibilidad de nutrientes. [18] En general, los océanos actúan como un sumidero de CO2 atmosférico, pero también liberan algo de carbono a la atmósfera. [19] Esto ocurre cuando el bacterioplancton y otros organismos en el océano consumen materia orgánica y respiran CO2 , y como resultado del equilibrio de solubilidad entre el océano y la atmósfera.
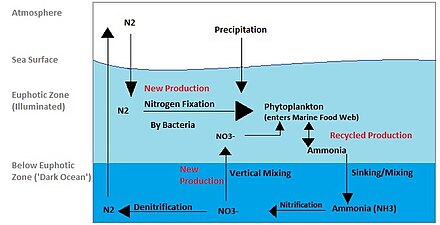
El ciclo del nitrógeno en los océanos está mediado por microorganismos, muchos de los cuales son bacterias, que realizan múltiples conversiones como: fijación de nitrógeno , desnitrificación , asimilación y oxidación anaeróbica del amoníaco ( anammox ). Existen muchas estrategias diferentes de metabolismo del nitrógeno empleadas por el bacterioplancton. Empezando por el nitrógeno molecular en la atmósfera (N2 ) , que es fijado por diazótrofos como el tricodesmio en formas utilizables como el amoníaco ( NH+
4). [20] Este amoniaco puede luego ser asimilado en materia orgánica como aminoácidos y ácidos nucleicos, tanto por el plancton fotoautótrofo como por el heterotrófico, y también puede ser nitrificado a NO.−
3para la producción de energía por bacterias nitrificantes. Finalmente, el uso de NO−
3o NO−
2como aceptores terminales de electrones reducen el nitrógeno a N 2 , que luego se libera de nuevo a la atmósfera, cerrando así el ciclo. [21] Otro proceso importante involucrado en la regeneración del N 2 atmosférico es el anammox. [21] [22] El anammox, un proceso en el que se combina el amoníaco con el nitrito para producir nitrógeno diatómico y agua, podría representar entre el 30 y el 50% de la producción de N 2 en el océano. [22]
Un análisis de los metagenomas de 83 especies de cianobacterias ha sugerido la posible actividad de reducción de nitrato disimilatorio a amonio (DNRA) en ciertas cianobacterias. [23] Es decir, el estudio encontró la presencia del gen NirBD , que es un marcador de la función de DNRA, en las familias Leptolyngbyaceae y Nostocaceae . Además, el estudio indicó que las cianobacterias que tenían NirBD son en gran medida también fijadores de nitrógeno no heterocistos , lo que sugiere posibles estrategias alternativas de adquisición de nitrógeno en condiciones ambientales variables. No obstante, también se sabe que el gen NirBD desempeña un papel en la asimilación de nitrógeno [24] y se requieren más estudios para determinar la función de NirBD en las cianobacterias.
La materia orgánica disuelta (DOM) está disponible en muchas formas en el océano y es responsable de sustentar el crecimiento de bacterias y microorganismos en el océano. Las dos fuentes principales de esta materia orgánica disuelta son; la descomposición de organismos de nivel trófico superior como plantas y peces, y en segundo lugar DOM en escorrentías que pasan a través del suelo con altos niveles de material orgánico. Es importante señalar que la edad y la calidad de la DOM son importantes para su uso por los microbios. [25] La mayoría de la DOM en los océanos es refractaria o semilábil y no está disponible para la biodegradación. [26] Como se mencionó anteriormente, la bomba microbiana es responsable de la producción de DOM refractaria que no está disponible para la biodegradación y permanece disuelta en los océanos durante miles de años. [16] La rotación de material orgánico DOM lábil es bastante alta debido a la escasez, esto es importante para el soporte de múltiples niveles tróficos en la comunidad microbiana. [27] La captación y respiración de DOM por los heterótrofos cierra el ciclo produciendo CO 2.
Se sabe que el bacterioplancton, como los miembros de Roseobacter , SAR11 y Gammaproteobacteria , contribuye significativamente al ciclo del azufre, [15] [28] principalmente a través del metabolismo del dimetilsulfoniopropionato (DMSP). El DMSP puede catabolizarse mediante escisión a dimetilsulfuro (DMS) o desmetilación por el bacterioplancton, [29] [30] en la que ambos tienen efectos contrastantes en el ciclo del azufre . La formación de DMS contribuye al flujo de azufre hacia la atmósfera y, según la hipótesis CLAW , desempeña un papel en la regulación del clima global. [31] El aumento de la producción de aerosoles de sulfato a partir de la oxidación de DMS es capaz de promover el enfriamiento a escala global, a través de la promoción de la formación de nubes. [31] [32] Por el contrario, la vía de desmetilación del DMSP al metanotiol da como resultado la integración de carbono y azufre en el propio organismo en lugar de liberar los elementos al medio ambiente. [33] Se cree que la degradación del DMSP por bacterioplancton prevalece en las aguas superficiales marinas, aunque la distribución espacial de las dos rutas de degradación mencionadas anteriormente muestra una alta variación. [34]
De manera similar al DNRA, el mismo estudio indicó la presencia de un gen similar a dsyB en ciertos genomas de cianobacterias, lo que sugiere la capacidad de producir DMSP. [23] Sin embargo, aún no ha habido confirmación empírica de la síntesis de DMSP en las cianobacterias.
Las diatomeas son un grupo importante de fitoplancton en el que la mayoría necesita silicio en forma de sílice biogénica para formar su pared celular (conocida como frústula ). Tras la depredación o la muerte, las diatomeas liberan sílice en partículas, pero deben disolverse para su reciclaje y recaptación por las diatomeas; de lo contrario, la sílice se exportará y se depositará en los sedimentos. Por lo tanto, la productividad de las diatomeas estará limitada por el silicio si las tasas de disolución son lentas. Sin embargo, se sabe que el bacterioplancton (es decir, los miembros de Cytophaga - Flavobacterium - Bacteroides , Alphaproteobacteria y Gammaproteobacteria ) promueve significativamente la disolución de sílice en partículas, manteniendo así la importante producción de sílice biogénica en la zona fótica del océano. También se sugiere que este proceso ayuda a regular la productividad de las diatomeas y sus correspondientes efectos biogeoquímicos. [35] [36]

Las variaciones en la abundancia del bacterioplancton son generalmente resultado de la temperatura, el pastoreo del zooplancton y la disponibilidad de sustrato. [37] La abundancia y productividad bacterianas están constantemente relacionadas con la abundancia y productividad de las algas, así como con el carbono orgánico. Además, el fósforo influye directamente tanto en la abundancia de algas como de bacterias y, a su vez, las algas y las bacterias influyen directamente en la abundancia de cada una [37] En ambientes extremadamente oligotróficos, tanto el crecimiento bacteriano como el de las algas está limitado por el fósforo, pero debido a que las bacterias son mejores competidoras, obtienen una porción mayor del sustrato inorgánico y aumentan en abundancia más rápidamente que las algas.
En ambientes marinos pelágicos , los nanoflagelados heterotróficos son los consumidores más probables de la producción de células bacterianas. [38] Los flagelados cultivados en experimentos de laboratorio demuestran que están adaptados a la depredación de partículas del tamaño de bacterias y se encuentran en concentraciones que controlan la biomasa bacteriana. [39] Se han encontrado fluctuaciones ajustadas en el número de bacterias y flagelados en un estuario eutrófico , particularmente en verano. [38] [40] La amplitud de estas fluctuaciones aumenta en respuesta a la eutrofización artificial con nutrientes inorgánicos y disminuye en respuesta a la depredación. Las pérdidas de bacterioplancton por pastoreo están indirectamente relacionadas con los balances de carbono y directamente relacionadas con los inhibidores procariotas . [41] Un excedente de sustrato causaría un aumento de la biomasa de flagelados, un aumento del pastoreo de bacterioplancton y, por lo tanto, una disminución de la biomasa bacteriana en general. La depredación de ciliados es análoga a la depredación de bacterias por flagelados también.
Con el uso estacional de inhibidores procariotas, existe una relación positiva entre la abundancia bacteriana y las tasas de pastoreo del nanoplancton heterotrófico y se observó que solo el 40-45 % de la producción de bacterioplancton era consumida por protozoos fagotróficos. [42] Además, los experimentos de inhibición eucariota muestran que el pastoreo de protozoos tiene un efecto positivo en la producción de bacterioplancton, lo que sugiere que la regeneración de nitrógeno por parte de los protozoos podría ser muy importante para el crecimiento bacteriano. Los inhibidores eucariotas no demostraron ser útiles para determinar las tasas de pastoreo de protozoos en el bacterioplancton, sin embargo, pueden ayudar a comprender los mecanismos de control en la red alimentaria microbiana. [42]

El bacterioplancton, como las cianobacterias, puede producir floraciones tóxicas en lagos eutróficos que pueden provocar la muerte de muchos organismos, como peces, aves, ganado, mascotas y seres humanos. [43] Algunos ejemplos de estas floraciones dañinas son la floración de Microcystis en el año 2000 en el estuario del río Swan, Australia, [44] y la de Oostvaarderplassen en los Países Bajos en 2003. [45] Los efectos perjudiciales de estas floraciones pueden ir desde malformaciones cardíacas en los peces [46] hasta la limitación de la reproducción de los copépodos. [47]
Las altas temperaturas causadas por la estacionalidad aumentan la estratificación y evitan la mezcla turbulenta vertical, lo que aumenta la competencia por la luz que favorece a las cianobacterias flotantes. [48] [49] Las temperaturas más altas también reducen la viscosidad del agua, lo que permite un movimiento más rápido que también favorece a las especies flotantes de cianobacterias. [43] Estas especies también son muy competitivas y tienen la capacidad de crear una cubierta superficial que evita que la luz llegue a las especies de plancton más profundas. [48] [50] [49]
Los estudios climáticos también indican que, con el aumento de las olas de calor, la probabilidad de floraciones de cianobacterias perjudiciales se convertirá en una amenaza mayor para los sistemas de agua dulce eutróficos. [51] [52] [53] Otras implicaciones del aumento de la temperatura media del aire debido al cambio climático es que podría haber una expansión de la temporada de floración de cianobacterias, que se extendería desde principios de la primavera hasta finales del otoño. [54]
Se pueden obtener estimaciones de la abundancia y densidad del bacterioplancton con una variedad de métodos que incluyen recuentos directos, citometría de flujo y conclusiones extraídas de medidas metabólicas.
Además, como se explicó en la sección sobre ciclos biogeoquímicos, el plancton es responsable del reciclaje y el movimiento de nutrientes esenciales (es decir, nitrógeno, carbono y materia orgánica orgánica), que son elementos básicos esenciales para muchos de los organismos que coexisten con el bacterioplancton en estos ecosistemas. Estos nutrientes reciclados pueden ser reutilizados por los productores primarios, lo que aumenta la eficiencia de la red alimentaria biológica y minimiza el desperdicio de energía.