En química orgánica , los arinos [1] y los bencinos [2] son una clase de especies químicas altamente reactivas derivadas de un anillo aromático mediante la eliminación de dos sustituyentes . Los arinos son ejemplos de dideshidroarenos (1,2-didehidroarenos en este caso), aunque también se conocen 1,3- y 1,4-didehidroarenos. [3] [4] [5] Los arinos son ejemplos de alquinos bajo alta tensión .
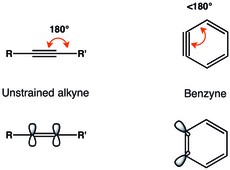
La representación alquina del bencino es la más común. Los arinos suelen describirse como compuestos que tienen un triple enlace tenso. [6]

Las restricciones geométricas del triple enlace en el bencino dan como resultado una superposición reducida de los orbitales p en el plano y, por lo tanto, un triple enlace más débil. [7] Radziszewski asignó la frecuencia vibracional del triple enlace en el bencino a 1846 cm −1 , [8] lo que indica un triple enlace más débil que en el alquino no deformado con una frecuencia vibracional de aproximadamente 2150 cm −1 . Sin embargo, el bencino se parece más a un alquino deformado que a un dirradical, como se ve a partir de la gran brecha singlete-triplete y la reactividad similar a la del alquino. [3]
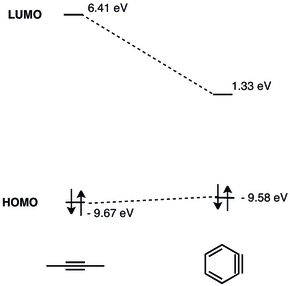
El LUMO del arino se encuentra mucho más abajo que el LUMO de los alquinos no deformados, lo que lo hace más compatible energéticamente con el HOMO de los nucleófilos. Por lo tanto, el bencino posee un carácter electrofílico y experimenta reacciones con nucleófilos. [9] En 1968 se presentó un análisis detallado del OM del bencino. [10]
Debido a su extrema reactividad, los arinos deben generarse in situ . Como es típico de otros intermediarios reactivos , el bencino debe quedar atrapado, ya que de lo contrario se dimeriza a bifenileno .
Las primeras rutas para obtener bencina implicaban la deshidrohalogenación de haluros de arilo :

Estas reacciones requieren una base fuerte y temperaturas elevadas. Los arenos 1,2-disustituidos sirven como precursores de los bencinos en condiciones más suaves. El bencino se genera por la deshalogenación del 1-bromo-2-fluorobenceno por el magnesio. [11] El ácido antranílico se puede convertir en 2-diazoniobenceno-1-carboxilato por diazotación y neutralización. Aunque es explosiva, [12] esta especie zwitteriónica es un precursor conveniente y económico del bencino. [13]

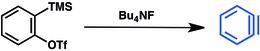
Otro método se basa en triflatos de trimetilsililarilo . [14] Este método ha tenido una amplia aplicabilidad y fue revisado en 2021. [15] El desplazamiento del fluoruro del grupo trimetilsililo induce la eliminación del triflato y la liberación de bencina:
Una reacción de Diels-Alder hexadehidro (HDDA) implica la cicloadición de 1,3-diino y alquino. [16]

La N -aminación de 1 H -benzotriazol con ácido hidroxilamina- O -sulfónico genera un intermedio que puede oxidarse a bencina con un rendimiento casi cuantitativo con acetato de plomo (IV) . [17]

Incluso a bajas temperaturas, los arinos son extremadamente reactivos. Su reactividad se puede clasificar en tres clases principales: (1) adiciones nucleofílicas, (2) reacciones pericíclicas y (3) inserción de enlaces.
Tras el tratamiento con nucleófilos básicos, los haluros de arilo desprotonan alfa al grupo saliente, lo que da como resultado la deshidrohalogenación . Los estudios de intercambio isotópico indican que para los fluoruros de arilo y, a veces, los cloruros de arilo, el evento de eliminación se produce en dos pasos, desprotonación, seguida de expulsión del nucleófilo. Por lo tanto, el proceso es formalmente análogo al mecanismo E1cb de los compuestos alifáticos. Los bromuros y yoduros de arilo, por otro lado, generalmente parecen experimentar la eliminación mediante un mecanismo E2 sin-coplanar concertado. [18] [19] El bencino resultante forma productos de adición, generalmente por adición nucleofílica y protonación. La generación del intermediario bencino es el paso lento en la reacción. [20]

Las reacciones de "acoplamiento de arino" permiten la generación de compuestos de bifenilo que son valiosos en la industria farmacéutica, la agricultura y como ligandos en muchas transformaciones catalizadas por metales. [21]

El producto metal-areno también puede agregarse a otro arino, lo que lleva a una polimerización por crecimiento en cadena . El uso de cianuro de cobre (I) como iniciador para agregarlo al primer arino produjo polímeros que contienen hasta aproximadamente 100 unidades de areno. [22]
Cuando el grupo saliente (LG) y el sustituyente (Y) están en posición orto o para, solo es posible un intermediario bencínico. Sin embargo, cuando LG está en posición meta con respecto a Y, entonces son posibles los resultados regioquímicos (A y B). Si Y es un electrón-aceptor, entonces H B es más ácido que H A , lo que da como resultado la generación del regioisómero B. Análogamente, si Y es un electrón-donante, se genera el regioisómero A, ya que ahora H A es el protón más ácido.

Hay dos posibles regioisómeros de bencino con sustituyente (Y): el triple enlace puede estar posicionado entre C2 y C3 o entre C3 y C4. Los sustituyentes orto al grupo saliente conducirán al triple enlace entre C2 y C3. Para Y y LG conducirán al regioisómero con triple enlace entre C3 y C4. El sustituyente meta puede proporcionar ambos regioisómeros como se describió anteriormente. Las adiciones nucleofílicas pueden ocurrir con regioselectividad. Aunque las explicaciones clásicas para explicar la regioselectividad se refieren a la estabilidad del carbanión después del ataque del nucleófilo, [20] esta explicación ha sido reemplazada por el modelo de distorsión del arino por Houk y Garg . [23] [24] [25] En este modelo, los sustituyentes causan distorsión geométrica de la estructura del estado fundamental del arino, lo que conduce a reacciones regioselectivas, consistentes con reacciones que proceden a través de estados de transición tempranos.
El bencino sufre una rápida dimerización para formar bifenileno. Algunas rutas para obtener bencino dan lugar a una reacción posterior especialmente rápida y de alto rendimiento. [13] [17] La trimerización da lugar a trifenileno . [26]
Los bencinos pueden sufrir reacciones de ciclización [4+2] . Cuando se generan en presencia de antraceno , se obtiene tripticeno . [11] En este método, el mecanismo concertado de la reacción de Diels-Alder entre bencino y furano se muestra a continuación. Se cree que otras cicloadiciones [4+2] de bencinos se producen mediante un mecanismo escalonado.

Un ejemplo clásico es la síntesis de 1,2,3,4-tetrafenilnaftaleno . [27] El tetrabromobenceno puede reaccionar con butillitio y furano para formar un tetrahidroantraceno [28].

Las cicloadiciones [4+2] de arinos se han aplicado comúnmente a la síntesis total de productos naturales. Sin embargo, la principal limitación de este enfoque es la necesidad de utilizar dienos restringidos, como el furano y el ciclopentadieno. [14] En 2009, Buszek y sus colaboradores sintetizaron el herbindole A mediante cicloadición [4+2] de arino. [29] El 6,7-indolino sufre una cicloadición [4+2] con ciclopentadieno para producir un producto tetracíclico complejo.

Los bencinos experimentan cicloadición [2+2] con una amplia gama de alquenos. Debido a la naturaleza electrofílica del bencino, los alquenos que tienen sustituyentes donadores de electrones funcionan mejor para esta reacción. [30]
Debido a la formación significativa de subproductos, la química del arino [2+2] rara vez se utiliza en la síntesis total de productos naturales. [14] Sin embargo, existen varios ejemplos. En 1982, Stevens y sus colaboradores informaron sobre una síntesis de taxodiona que utilizó cicloadición [2+2] entre un arino y un acetal de cetena. [31]

Mori y sus colaboradores realizaron una [2+2+2]-cociclización catalizada por paladio de arino y diino en su síntesis total de taiwaninas C. [32]

El primer ejemplo de reacción de inserción de enlace σ de arino es la síntesis de meleína en 1973. [33]

Si el bencino es 1,2-dideshidrobenceno, son posibles dos isómeros más: 1,3-dideshidrobenceno y 1,4-dideshidrobenceno. [3] Sus energías in silico son, respectivamente, 106, 122 y 138 kcal/mol (444, 510 y 577 kJ/mol). [34] Los isómeros 1,2- y 1,3- tienen estados fundamentales singlete, mientras que para el 1,4-dideshidrobenceno la brecha es menor.

Se ha estudiado la interconversión de los 1,2-, 1,3- y 1,4-dideshidrobencenos. [34] [35] Se ha postulado que se produce una conversión de 1,2- a 1,3-dideshidrobenceno en la pirólisis (900 °C) de los precursores de arino sustituidos con fenilo [34] como se muestra a continuación. Se requieren temperaturas extremadamente altas para la interconversión de bencina.

En experimentos clásicos con 1,4-dideshidrobenceno, al calentar a 300 °C, [1,6-D2]- A se equilibra fácilmente con [3,2-D2]- B , pero no se equilibra con C o D . La migración simultánea de átomos de deuterio para formar B , y el hecho de que no se forme C o D , solo se puede explicar por la presencia de un intermediario cíclico y simétrico: el 1,4-dideshidrobenceno. [36]

Se propusieron dos estados para el 1,4-didehidrobenceno: singlete y triplete, siendo el estado singlete más bajo en energía. [37] [38] El estado triplete representa dos centros radicales que no interactúan y, por lo tanto, debería abstraer hidrógenos a la misma velocidad que el radical fenilo. Sin embargo, el estado singlete está más estabilizado que el triplete y, por lo tanto, se perderá parte de la energía estabilizadora para formar el estado de transición para la escisión del hidrógeno, lo que conduce a una abstracción de hidrógeno más lenta. Chen propuso el uso de análogos del 1,4-didehidrobenceno que tienen grandes brechas de energía singlete-triplete para mejorar la selectividad de los candidatos a fármacos de enediina. [39]
La primera evidencia de la existencia de arinos provino del trabajo de Stoermer y Kahlert. En 1902 observaron que al tratar el 3-bromobenzofurano con una base en etanol se forma 2-etoxibenzofurano. Basándose en esta observación, postularon un intermediario arino. [40]

Wittig et al. invocaron un intermedio zwitteriónico en la reacción de fluorobenceno y fenillitio para dar bifenilo. [41] [42] [43] Esta hipótesis se confirmó posteriormente. [44] [45] [46] [47] [48]
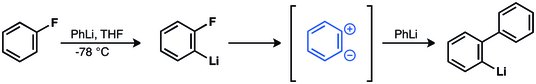
En 1953, los experimentos de etiquetado con 14 C proporcionaron un fuerte apoyo a la intermediación del bencino. [44] John D. Roberts et al. demostraron que la reacción de clorobenceno-1- 14 C y amida de potasio dio cantidades iguales de anilina con incorporación de 14 C en C-1 y C-2.

Wittig y Pohmer descubrieron que el bencino participa en reacciones de cicloadición [4+2]. [49]
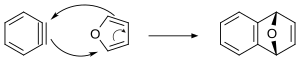
Estudios espectroscópicos aportaron evidencia adicional de la existencia del bencino. [3] El bencino se ha observado en un "contenedor molecular". [50]
En 2015, se obtuvo una imagen de una sola molécula de arino mediante STM . [51]
Los 1,3-dideshidroarenos se demostraron por primera vez en la década de 1990 cuando se generaron a partir de derivados de benceno 1,3-disustituidos, como el éster peroxi 1,3-C 6 H 4 (O 2 C(O)CH 3 ) 2 . [3]
Los avances en el estudio del 1,4-didehidrobenceno se produjeron en la década de 1960, a raíz de los estudios sobre la ciclización de Bergman . [36] Este tema se volvió de actualidad con el descubrimiento de los "citostáticos" de enediina, como la caliqueamicina , que genera un 1,4-didehidrobenceno. [52]
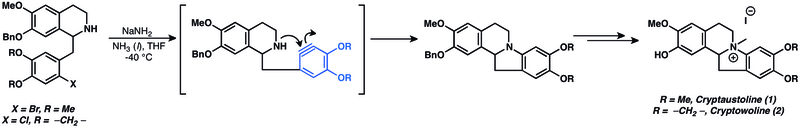
Se han preparado diversos productos naturales utilizando arinos como intermediarios. [14] Las adiciones nucleofílicas a arinos se han utilizado ampliamente en la síntesis total de productos naturales. De hecho, las adiciones nucleofílicas de arinos son algunas de las aplicaciones más antiguas conocidas de la química de arinos. [14] La adición nucleofílica a arino se utilizó en el intento de síntesis de criptoaustolina (1) y criptowolina (2). [53]
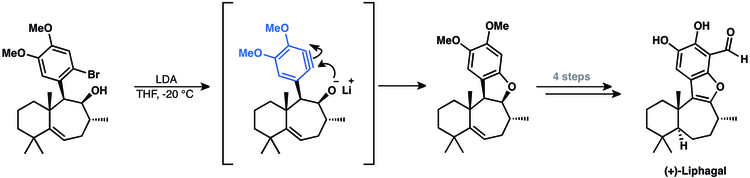
La síntesis del meroterpenoide tetracíclico (+)-liphagal implicó un intermediario arino. [54] Su enfoque empleó una ciclización arino para cerrar el anillo final del producto natural. [14]
Las reacciones multicomponentes de arinos son transformaciones potentes que permiten la formación rápida de arenos 1,2-disustituidos. A pesar de su utilidad potencial, los ejemplos de reacciones multicomponentes de arinos en la síntesis de productos naturales son escasos. [14] Se empleó una reacción de acoplamiento de arinos de cuatro componentes en la síntesis de deshidroaltenueno B. [55]

{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )