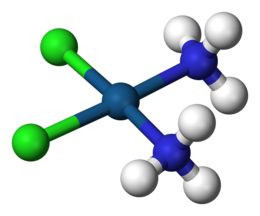
Un complejo de coordinación es un compuesto químico que consiste en un átomo o ion central , que generalmente es metálico y se denomina centro de coordinación , y un conjunto circundante de moléculas o iones unidos , que a su vez se conocen como ligandos o agentes complejantes. [1] [2] [3] Muchos compuestos que contienen metales , especialmente aquellos que incluyen metales de transición (elementos como el titanio que pertenecen al bloque d de la tabla periódica ), son complejos de coordinación. [4]
Los complejos de coordinación son tan comunes que sus estructuras y reacciones se describen de muchas maneras, a veces de manera confusa. El átomo dentro de un ligando que está unido al átomo o ion metálico central se llama átomo donante . En un complejo típico, un ion metálico está unido a varios átomos donantes, que pueden ser iguales o diferentes. Un ligando polidentado (con enlaces múltiples) es una molécula o ion que se une al átomo central a través de varios de los átomos del ligando; los ligandos con 2, 3, 4 o incluso 6 enlaces al átomo central son comunes. Estos complejos se denominan complejos quelatos ; la formación de dichos complejos se denomina quelación, complexación y coordinación.
El átomo o ion central, junto con todos los ligandos, comprenden la esfera de coordinación . [5] [6] Los átomos o iones centrales y los átomos donantes comprenden la primera esfera de coordinación.
La coordinación se refiere a los "enlaces covalentes coordinados" ( enlaces dipolares ) entre los ligandos y el átomo central. Originalmente, un complejo implicaba una asociación reversible de moléculas , átomos o iones a través de enlaces químicos débiles . En la química de coordinación, este significado ha evolucionado. Algunos complejos metálicos se forman de manera prácticamente irreversible y muchos están unidos por enlaces que son bastante fuertes. [7] [8]
El número de átomos donantes unidos al átomo o ion central se denomina número de coordinación . Los números de coordinación más comunes son 2, 4 y, especialmente, 6. Un ion hidratado es un tipo de ion complejo (o simplemente un complejo), una especie formada entre un ion metálico central y uno o más ligandos, moléculas o iones circundantes que contienen al menos un par solitario de electrones.
Si todos los ligandos son monodentados , entonces el número de átomos donantes es igual al número de ligandos. Por ejemplo, el ion hexahidrato de cobalto(II) o el ion hexaaquacobalto(II) [Co(H 2 O) 6 ] 2+ es un ion complejo hidratado que consta de seis moléculas de agua unidas a un ion metálico Co. El estado de oxidación y el número de coordinación reflejan el número de enlaces formados entre el ion metálico y los ligandos en el ion complejo. Sin embargo, el número de coordinación de Pt( en )2+
2es 4 (en lugar de 2) ya que tiene dos ligandos bidentados, que contienen cuatro átomos donadores en total.
Cualquier átomo donante cederá un par de electrones. Hay algunos átomos o grupos donantes que pueden ofrecer más de un par de electrones. Estos se denominan bidentados (ofrecen dos pares de electrones) o polidentados (ofrecen más de dos pares de electrones). En algunos casos, un átomo o un grupo ofrece un par de electrones a dos átomos o aceptores metálicos centrales similares o diferentes (mediante la división del par de electrones) en un enlace de dos electrones con tres centros . Estos se denominan ligandos puente.

Los complejos de coordinación se conocen desde el comienzo de la química moderna. Los primeros complejos de coordinación conocidos incluyen colorantes como el azul de Prusia . Sus propiedades se entendieron bien por primera vez a fines del siglo XIX, después del trabajo de 1869 de Christian Wilhelm Blomstrand . Blomstrand desarrolló lo que se conoce como la teoría de la cadena iónica compleja. Al considerar los complejos de amina metálica, teorizó que las moléculas de amoníaco compensaban la carga del ion formando cadenas del tipo [(NH 3 ) X ] X+ , donde X es el número de coordinación del ion metálico. Comparó sus cadenas teóricas de amoníaco con hidrocarburos de la forma (CH 2 ) X . [9]
Siguiendo esta teoría, el científico danés Sophus Mads Jørgensen la mejoró. En su versión de la teoría, Jørgensen afirmaba que cuando una molécula se disocia en una solución hay dos resultados posibles: los iones se unirían a través de las cadenas de amoniaco que había descrito Blomstrand o los iones se unirían directamente al metal.
No fue hasta 1893 que Alfred Werner publicó la versión más ampliamente aceptada de la teoría en la actualidad . El trabajo de Werner incluyó dos cambios importantes en la teoría de Blomstrand. El primero fue que Werner describió las dos posibilidades en términos de ubicación en la esfera de coordinación. Afirmó que si los iones formaran una cadena, esto ocurriría fuera de la esfera de coordinación, mientras que los iones que se unieran directamente al metal lo harían dentro de la esfera de coordinación. [10] Sin embargo, en uno de sus descubrimientos más importantes, Werner refutó la mayor parte de la teoría de la cadena. Werner descubrió las disposiciones espaciales de los ligandos que estaban involucrados en la formación del complejo hexacoordinado cobalto. Su teoría permite comprender la diferencia entre un ligando coordinado y un ion de equilibrio de carga en un compuesto, por ejemplo, el ion cloruro en los cloruros de cobaltamina, y explicar muchos de los isómeros previamente inexplicables.
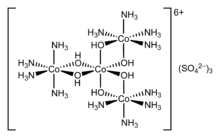
En 1911, Werner resolvió por primera vez el complejo de coordinación hexol en isómeros ópticos , derribando la teoría de que solo los compuestos de carbono podían poseer quiralidad . [11]
Los iones o moléculas que rodean al átomo central se denominan ligandos . Los ligandos se clasifican como L o X (o una combinación de ambos), dependiendo de cuántos electrones proporcionen para el enlace entre el ligando y el átomo central. Los ligandos L proporcionan dos electrones de un par de electrones solitarios , lo que da como resultado un enlace covalente coordinado . Los ligandos X proporcionan un electrón, y el átomo central proporciona el otro electrón, formando así un enlace covalente regular. Se dice que los ligandos están coordinados con el átomo. En el caso de los alquenos , los enlaces pi pueden coordinarse con átomos metálicos. Un ejemplo es el etileno en el complejo [PtCl3 ( C2H4 ) ] − ( sal de Zeise ).
En química de coordinación, una estructura se describe primero por su número de coordinación , el número de ligandos unidos al metal (más específicamente, el número de átomos donantes). Por lo general, se pueden contar los ligandos unidos, pero a veces incluso el conteo puede volverse ambiguo. Los números de coordinación normalmente están entre dos y nueve, pero no es raro que haya grandes cantidades de ligandos en el caso de los lantánidos y actínidos. El número de enlaces depende del tamaño, la carga y la configuración electrónica del ion metálico y de los ligandos. Los iones metálicos pueden tener más de un número de coordinación.
Típicamente la química de los complejos de metales de transición está dominada por interacciones entre los orbitales moleculares s y p de los átomos donantes en los ligandos y los orbitales d de los iones metálicos. Los orbitales s, p y d del metal pueden acomodar 18 electrones (ver regla de los 18 electrones ). El número de coordinación máximo para un cierto metal está relacionado con la configuración electrónica del ion metálico (para ser más específicos, el número de orbitales vacíos) y con la relación del tamaño de los ligandos y el ion metálico. Los metales grandes y los ligandos pequeños conducen a números de coordinación altos, p. ej., [Mo(CN) 8 ] 4− . Los metales pequeños con ligandos grandes conducen a números de coordinación bajos, p. ej., Pt[P(CMe 3 )] 2 . Debido a su gran tamaño, los lantánidos , actínidos y los metales de transición tempranos tienden a tener números de coordinación altos.
La mayoría de las estructuras siguen el patrón de puntos sobre una esfera (o como si el átomo central estuviera en el medio de un poliedro donde las esquinas de esa forma son las ubicaciones de los ligandos), donde la superposición de orbitales (entre el ligando y los orbitales del metal) y las repulsiones ligando-ligando tienden a conducir a ciertas geometrías regulares. Las geometrías más observadas se enumeran a continuación, pero hay muchos casos que se desvían de una geometría regular, por ejemplo, debido al uso de ligandos de diversos tipos (lo que da como resultado longitudes de enlace irregulares; los átomos de coordinación no siguen un patrón de puntos sobre una esfera), debido al tamaño de los ligandos o debido a efectos electrónicos (ver, por ejemplo, distorsión de Jahn-Teller ):
Las descripciones idealizadas de la coordinación 5, 7, 8 y 9 a menudo son geométricamente indistintas de las estructuras alternativas con ángulos LML (ligando-metal-ligando) ligeramente diferentes, por ejemplo, la diferencia entre estructuras piramidales cuadradas y bipiramidales trigonales. [12]
Para distinguir entre las coordinaciones alternativas para complejos de cinco coordenadas, Addison et al. [16] inventaron el índice geométrico τ . Este índice depende de los ángulos del centro de coordinación y varía entre 0 para la pirámide cuadrada y 1 para las estructuras bipiramidales trigonales, lo que permite clasificar los casos intermedios. Este sistema fue ampliado posteriormente a los complejos de cuatro coordenadas por Houser et al. [17] y también por Okuniewski et al. [18].
En sistemas con un bajo conteo de electrones d , debido a efectos electrónicos especiales como la estabilización de Jahn-Teller (de segundo orden) , [19] ciertas geometrías (en las que los átomos de coordinación no siguen un patrón de puntos sobre una esfera) se estabilizan en relación con las otras posibilidades, por ejemplo, para algunos compuestos, la geometría prismática trigonal se estabiliza en relación con las estructuras octaédricas para seis coordinaciones.
La disposición de los ligandos es fija para un complejo dado, pero en algunos casos es mutable mediante una reacción que forma otro isómero estable .
Existen muchos tipos de isomería en los complejos de coordinación, al igual que en muchos otros compuestos.
La estereoisomería se produce cuando los mismos enlaces están en distintas orientaciones. La estereoisomería se puede clasificar en: [20]
El isómero cis-trans se da en complejos octaédricos y planos cuadrados (pero no tetraédricos). Cuando dos ligandos son adyacentes se dice que son cis , cuando están opuestos entre sí, trans . Cuando tres ligandos idénticos ocupan una cara de un octaedro, se dice que el isómero es facial o fac . En un isómero fac , dos ligandos idénticos cualesquiera son adyacentes o cis entre sí. Si estos tres ligandos y el ion metálico están en un plano, se dice que el isómero es meridional o mer . Un isómero mer puede considerarse como una combinación de un trans y un cis , ya que contiene pares de ligandos idénticos tanto trans como cis .
La isomería óptica se produce cuando un complejo no es superponible con su imagen especular. Se denomina así porque los dos isómeros son ópticamente activos , es decir, giran el plano de la luz polarizada en direcciones opuestas. En la primera molécula mostrada, se utiliza el símbolo Λ ( lambda ) como prefijo para describir el giro de hélice hacia la izquierda formado por tres ligandos bidentados. La segunda molécula es la imagen especular de la primera, con el símbolo Δ ( delta ) como prefijo para el giro de hélice hacia la derecha. La tercera y cuarta moléculas son un par similar de isómeros Λ y Δ, en este caso con dos ligandos bidentados y dos ligandos monodentados idénticos. [21]
La isomería estructural se produce cuando los enlaces son diferentes. Se reconocen cuatro tipos de isomería estructural: isomería de ionización, isomería de solvatos o hidratos, isomería de enlace e isomería de coordinación.
Muchas de las propiedades de los complejos de metales de transición están determinadas por sus estructuras electrónicas. La estructura electrónica puede describirse mediante un modelo relativamente iónico que atribuye cargas formales a los metales y ligandos. Este enfoque es la esencia de la teoría de campos cristalinos (CFT). La teoría de campos cristalinos, introducida por Hans Bethe en 1929, ofrece un intento basado en la mecánica cuántica de comprender los complejos. Pero la teoría de campos cristalinos trata todas las interacciones en un complejo como iónicas y supone que los ligandos pueden aproximarse mediante cargas puntuales negativas.
Los modelos más sofisticados adoptan la covalencia, y este enfoque se describe en la teoría del campo de ligandos (LFT) y la teoría de orbitales moleculares (MO). La teoría del campo de ligandos, introducida en 1935 y construida a partir de la teoría de orbitales moleculares, puede manejar una gama más amplia de complejos y puede explicar complejos en los que las interacciones son covalentes . Las aplicaciones químicas de la teoría de grupos pueden ayudar a comprender la teoría del campo de ligandos o de cristales, al permitir soluciones simples basadas en la simetría para las ecuaciones formales.
Los químicos tienden a emplear el modelo más simple necesario para predecir las propiedades de interés; por esta razón, la teoría de la transformación cuántica ha sido la favorita para los debates cuando ha sido posible. Las teorías de los átomos moleculares y de los electrones lineales son más complicadas, pero ofrecen una perspectiva más realista.
La configuración electrónica de los complejos les confiere algunas propiedades importantes:

Los complejos de metales de transición suelen tener colores espectaculares causados por transiciones electrónicas por la absorción de luz. Por esta razón, a menudo se aplican como pigmentos . La mayoría de las transiciones relacionadas con complejos metálicos coloreados son transiciones d–d o bandas de transferencia de carga . En la transición ad–d, un electrón en el orbital ad del metal es excitado por un fotón a otro orbital d de mayor energía, por lo tanto, las transiciones d–d ocurren solo para complejos con orbitales d parcialmente llenos (d 1–9 ). Para complejos que tienen configuración d 0 o d 10 , la transferencia de carga aún es posible aunque las transiciones d–d no lo sean. Una banda de transferencia de carga implica la promoción de un electrón desde un orbital basado en metal a un orbital basado en ligando vacío ( transferencia de carga de metal a ligando o MLCT). También ocurre lo inverso: excitación de un electrón en un orbital basado en ligando a un orbital basado en metal vacío ( transferencia de carga de ligando a metal o LMCT). Estos fenómenos se pueden observar con la ayuda de la espectroscopia electrónica; También conocida como UV-Vis . [25] Para compuestos simples con alta simetría, las transiciones d–d se pueden asignar utilizando diagramas de Tanabe–Sugano . Estas asignaciones están ganando cada vez más apoyo en la química computacional .
Superficialmente, los complejos de lantánidos son similares a los de los metales de transición en que algunos están coloreados. Sin embargo, para los iones comunes Ln 3+ (Ln = lantánido) los colores son todos pálidos y apenas están influenciados por la naturaleza del ligando. Los colores se deben a las transiciones electrónicas 4f. Como los orbitales 4f en los lantánidos están "enterrados" en el núcleo de xenón y protegidos del ligando por los orbitales 5s y 5p, por lo tanto, no están influenciados por los ligandos en gran medida, lo que lleva a una división del campo cristalino mucho menor que en los metales de transición. Los espectros de absorción de un ion Ln 3+ se aproximan a los del ion libre, donde los estados electrónicos se describen mediante acoplamiento espín-órbita . Esto contrasta con los metales de transición, donde el estado fundamental está dividido por el campo cristalino. Las absorciones para Ln 3+ son débiles ya que las transiciones dipolares eléctricas están prohibidas por paridad ( prohibidas por Laporte ) pero pueden ganar intensidad debido al efecto de un campo de ligando de baja simetría o la mezcla con estados electrónicos superiores ( por ejemplo , orbitales d). Las bandas de absorción ff son extremadamente nítidas, lo que contrasta con las observadas para los metales de transición que generalmente tienen bandas anchas. [26] [27] Esto puede provocar efectos extremadamente inusuales, como cambios de color significativos bajo diferentes formas de iluminación.
Los complejos metálicos que tienen electrones desapareados son paramagnéticos . Esto puede deberse a un número impar de electrones en general o a la desestabilización del apareamiento de electrones. Por lo tanto, las especies monoméricas de Ti(III) tienen un "electrón d" y deben ser (para)magnéticas , independientemente de la geometría o la naturaleza de los ligandos. El Ti(II), con dos electrones d, forma algunos complejos que tienen dos electrones desapareados y otros sin ninguno. Este efecto se ilustra con los compuestos TiX 2 [(CH 3 ) 2 PCH 2 CH 2 P(CH 3 ) 2 ] 2 : cuando X = Cl , el complejo es paramagnético ( configuración de alto espín ), mientras que cuando X = CH 3 , es diamagnético ( configuración de bajo espín ). Los ligandos proporcionan un medio importante para ajustar las propiedades del estado fundamental .
En los complejos bimetálicos y polimetálicos, en los que los centros individuales tienen un número impar de electrones o que tienen un alto espín, la situación es más complicada. Si hay interacción (ya sea directa o a través de ligando) entre los dos (o más) centros metálicos, los electrones pueden acoplarse ( acoplamiento antiferromagnético , lo que da como resultado un compuesto diamagnético), o pueden potenciarse entre sí ( acoplamiento ferromagnético ). Cuando no hay interacción, los dos (o más) centros metálicos individuales se comportan como si fueran dos moléculas separadas.
Los complejos muestran una variedad de posibles reactividades: [28]
Si los ligandos alrededor del metal se eligen cuidadosamente, el metal puede ayudar en las transformaciones ( estequiométricas o catalíticas ) de moléculas o usarse como sensor.
Los complejos metálicos, también conocidos como compuestos de coordinación, incluyen prácticamente todos los compuestos metálicos. [29] El estudio de la "química de coordinación" es el estudio de la "química inorgánica" de todos los metales alcalinos y alcalinotérreos , metales de transición , lantánidos , actínidos y metaloides . Por lo tanto, la química de coordinación es la química de la mayoría de la tabla periódica. Los metales y los iones metálicos existen, al menos en las fases condensadas, solo rodeados de ligandos.
Las áreas de la química de coordinación se pueden clasificar según la naturaleza de los ligandos, en términos generales:
La mineralogía , la ciencia de los materiales y la química del estado sólido (tal como se aplican a los iones metálicos) son subconjuntos de la química de coordinación en el sentido de que los metales están rodeados de ligandos. En muchos casos, estos ligandos son óxidos o sulfuros, pero los metales están coordinados de todos modos y se aplican los principios y pautas que se analizan a continuación. En los hidratos , al menos algunos de los ligandos son moléculas de agua. Es cierto que el enfoque de la mineralogía, la ciencia de los materiales y la química del estado sólido difiere del enfoque habitual de la química de coordinación o inorgánica. Los primeros se ocupan principalmente de las estructuras poliméricas, propiedades que surgen de los efectos colectivos de muchos metales altamente interconectados. Por el contrario, la química de coordinación se centra en la reactividad y las propiedades de los complejos que contienen átomos metálicos individuales o pequeños conjuntos de átomos metálicos.
El procedimiento básico para nombrar un complejo es:
Ejemplos:
El número de coordinación de los ligandos unidos a más de un metal (ligandos puente) se indica mediante un subíndice del símbolo griego μ colocado antes del nombre del ligando. Así, el dímero del tricloruro de aluminio se describe mediante Al 2 Cl 4 (μ 2 -Cl) 2 .
Cualquier grupo aniónico puede ser estabilizado electrónicamente por cualquier catión. Un complejo aniónico puede ser estabilizado por un catión hidrógeno, convirtiéndose en un complejo ácido que puede disociarse para liberar el hidrógeno catiónico. Este tipo de compuesto complejo tiene un nombre con la letra "ic" añadida después del metal central. Por ejemplo, H 2 [Pt(CN) 4 ] tiene el nombre de ácido tetracianoplatínico (II).
La afinidad de los iones metálicos por los ligandos se describe mediante una constante de estabilidad, también llamada constante de formación, y se representa con el símbolo K f . Es la constante de equilibrio para su ensamblaje a partir del metal constituyente y los ligandos, y se puede calcular en consecuencia, como en el siguiente ejemplo para un caso sencillo:
donde: x, y, y z son los coeficientes estequiométricos de cada especie. M representa metal/ion metálico, L bases de Lewis y finalmente Z iones complejos. Las constantes de formación varían ampliamente. Valores grandes indican que el metal tiene alta afinidad por el ligando, siempre que el sistema esté en equilibrio. [31]
A veces, la constante de estabilidad se presenta en una forma diferente, conocida como constante de inestabilidad. Esta constante se expresa como la inversa de la constante de formación y se denota como K d = 1/K f . [32] Esta constante representa la reacción inversa para la descomposición de un ion complejo en sus componentes individuales de metal y ligando. Al comparar los valores de K d , cuanto mayor sea el valor, más inestable es el ion complejo.
Como resultado de la formación de estos iones complejos en soluciones, también pueden desempeñar un papel clave en la solubilidad de otros compuestos. Cuando se forma un ion complejo, puede alterar las concentraciones de sus componentes en la solución. Por ejemplo:
Si ambas reacciones ocurrieran en el mismo recipiente de reacción, la solubilidad del cloruro de plata aumentaría por la presencia de NH 4 OH, ya que la formación del complejo Diammine argentum(I) consume una parte significativa de los iones de plata libres de la solución. Según el principio de Le Chatelier , esto hace que la reacción de equilibrio para la disolución del cloruro de plata, que tiene como producto el ion plata, se desplace hacia la derecha.
Esta nueva solubilidad se puede calcular a partir de los valores de K f y K sp para las reacciones originales. La solubilidad se obtiene esencialmente combinando los dos equilibrios separados en una reacción de equilibrio combinada y esta reacción combinada es la que determina la nueva solubilidad. Por lo tanto, K c , la nueva constante de solubilidad, se denota por:
Como los metales sólo existen en solución como complejos de coordinación, se deduce que esta clase de compuestos es útil en una amplia variedad de formas.
En la química bioinorgánica y la química bioorganometálica , los complejos de coordinación cumplen funciones estructurales o catalíticas. Se estima que el 30% de las proteínas contienen iones metálicos. Entre los ejemplos se incluyen la vitamina B 12 de color intenso , el grupo hemo de la hemoglobina , los citocromos , el grupo clorina de la clorofila y la carboxipeptidasa , una enzima hidrolítica importante en la digestión. Otra enzima de iones complejos es la catalasa , que descompone el peróxido de hidrógeno de desecho de la célula . Los compuestos de coordinación sintéticos también se utilizan para unirse a proteínas y, especialmente, a ácidos nucleicos (por ejemplo, el fármaco anticancerígeno cisplatino ).
La catálisis homogénea es una de las principales aplicaciones de los compuestos de coordinación para la producción de sustancias orgánicas. Los procesos incluyen la hidrogenación , la hidroformilación y la oxidación . En un ejemplo, una combinación de tricloruro de titanio y trietilaluminio da lugar a los catalizadores Ziegler-Natta , utilizados para la polimerización de etileno y propileno para dar lugar a polímeros de gran importancia comercial como fibras, películas y plásticos.
El níquel, el cobalto y el cobre se pueden extraer mediante procesos hidrometalúrgicos que involucran iones complejos. Se extraen de sus menas como complejos de amina . Los metales también se pueden separar mediante la precipitación selectiva y la solubilidad de iones complejos. El cianuro se utiliza principalmente para la extracción de oro y plata de sus menas.
Los complejos de ftalocianina son una clase importante de pigmentos.
En un tiempo, se utilizaban compuestos de coordinación para identificar la presencia de metales en una muestra. El análisis inorgánico cualitativo ha sido reemplazado en gran medida por métodos de análisis instrumentales como la espectroscopia de absorción atómica (AAS), la espectroscopia de emisión atómica con plasma acoplado inductivamente (ICP-AES) y la espectrometría de masas con plasma acoplado inductivamente (ICP-MS).