Clase de fármaco que afecta las hormonas sexuales.
Un agonista de la hormona liberadora de gonadotropina ( agonista de GnRH ) es un tipo de medicamento que afecta las gonadotropinas y las hormonas sexuales . [1] Se utilizan para una variedad de indicaciones, incluida la medicina de fertilidad y para reducir los niveles de hormonas sexuales en el tratamiento de cánceres sensibles a las hormonas , como el cáncer de próstata y el cáncer de mama , ciertos trastornos ginecológicos como períodos abundantes y endometriosis , niveles altos de testosterona en mujeres, pubertad temprana en niños, como parte de la terapia hormonal transgénero y para retrasar la pubertad en jóvenes transgénero, entre otros usos. También se utiliza en la supresión de la ovulación espontánea como parte de la hiperestimulación ovárica controlada, un componente esencial en la FIV . Los agonistas de GnRH se administran mediante inyecciones en la grasa , como implantes colocados en la grasa y como aerosoles nasales .
Los efectos secundarios de los agonistas de GnRH están relacionados con la deficiencia de hormonas sexuales e incluyen síntomas de niveles bajos de testosterona y niveles bajos de estrógeno , como sofocos , disfunción sexual , atrofia vaginal , atrofia del pene , osteoporosis , infertilidad y disminución de las características físicas específicas del sexo . Son agonistas del receptor de GnRH y actúan aumentando o disminuyendo la liberación de gonadotropinas y la producción de hormonas sexuales por parte de las gónadas . Cuando se usan para suprimir la liberación de gonadotropinas, los agonistas de GnRH pueden reducir los niveles de hormonas sexuales en un 95% en ambos sexos. [2] [3] [4] [5]
La GnRH se descubrió en 1971 y sus análogos se introdujeron para uso médico en la década de 1980. [6] [7] Sus denominaciones comunes suelen terminar en -relin . Los análogos de GnRH más conocidos y utilizados son la leuprorelina (nombre comercial Lupron) y la triptorelina (nombre comercial Decapeptyl). Los análogos de GnRH están disponibles como medicamentos genéricos . A pesar de ello, siguen siendo muy caros.
Usos médicos
Los agonistas de GnRH son útiles en:
- Supresión de la ovulación espontánea como parte de la hiperestimulación ovárica controlada , que es un componente esencial en la fertilización in vitro (FIV). Normalmente, después de que los agonistas de GnRH han inducido un estado de hipoestrogenismo, se administra FSH exógena para estimular el folículo ovárico, seguida de gonadotropinas coriónicas humanas (hCG) para desencadenar la liberación de ovocitos . Los agonistas de GnRH que se utilizan habitualmente para este fin son: buserelina, leuprorelina, nafarelina y triptorelina. [8]
- Inducción de la maduración final tras haber realizado una hiperestimulación ovárica controlada. El uso de un agonista de GnRH para este propósito requiere el uso de un antagonista de GnRH en lugar de un agonista de GnRH para la supresión de la ovulación espontánea , porque el uso de un agonista de GnRH para ese propósito también inactiva el eje para el cual se pretende trabajar para la inducción de la maduración final.
- Tratamiento de cánceres que son hormonalmente sensibles y donde un estado hipogonadal disminuye las posibilidades de recurrencia. Por lo tanto, se emplean comúnmente en el tratamiento médico del cáncer de próstata y se han utilizado en pacientes con cáncer de mama .
- Retrasar la pubertad en individuos con pubertad precoz .
- Retrasar la pubertad en espera de decisiones de tratamiento en niños con disforia de género .
- Manejo de los trastornos femeninos que dependen de la producción de estrógenos . Las mujeres con menorragia , endometriosis , adenomiosis o fibromas uterinos pueden recibir agonistas de GnRH para suprimir la actividad ovárica e inducir un estado hipoestrogénico.
- Suprimir los niveles de hormonas sexuales en personas transgénero , especialmente mujeres transgénero .
- Casos graves de hiperandrogenismo , como en la hiperplasia suprarrenal congénita .
- Como parte del tratamiento farmacológico de los trastornos parafílicos en agresores sexuales o en hombres con alto riesgo de delinquir sexual. [9]
Las mujeres en edad reproductiva que se someten a quimioterapia citotóxica han sido tratadas previamente con agonistas de GnRH para reducir el riesgo de pérdida de ovocitos durante dicha terapia y preservar la función ovárica. Se necesitan más estudios para demostrar que este enfoque es útil.
Formularios disponibles
Los agonistas de GnRH que se han comercializado y están disponibles para uso médico incluyen buserelina , gonadorelina , goserelina , histrelina , leuprorelina , nafarelina y triptorelina . Los agonistas de GnRH que se utilizan mayoritaria o exclusivamente en medicina veterinaria incluyen la deslorelina y la fertirelina . Los agonistas de GnRH se pueden administrar mediante inyección , mediante implante o por vía intranasal en forma de aerosol nasal . Los inyectables han sido formulados para uso diario, mensual y trimestral, y hay implantes disponibles que pueden durar de un mes a un año. Con la excepción de la gonadorelina, que se utiliza como progonadotropina , todos los agonistas de GnRH aprobados se utilizan como antigonadotropinas .
Los agonistas desensibilizantes de GnRH utilizados clínicamente están disponibles en las siguientes formulaciones farmacéuticas : [10] [11] [12] [13]
Contraindicaciones
Los agonistas de GnRH son fármacos de categoría X durante el embarazo.
Efectos secundarios
Los efectos secundarios comunes de los agonistas y antagonistas de la GnRH incluyen síntomas de hipogonadismo como sofocos, ginecomastia, fatiga, aumento de peso, retención de líquidos, disfunción eréctil y disminución de la libido. La terapia a largo plazo puede provocar anomalías metabólicas, aumento de peso, empeoramiento de la diabetes y osteoporosis. Los eventos adversos raros, pero potencialmente graves, incluyen el empeoramiento transitorio del cáncer de próstata debido al aumento de testosterona con la inyección inicial de agonistas de GnRH y apoplejía hipofisaria en pacientes con adenoma hipofisario. Se han informado casos únicos de lesión hepática clínicamente aparente con algunos agonistas de GnRH (histrelina, goserelina), pero los informes no fueron muy convincentes. No hay evidencia que indique que exista sensibilidad cruzada a la lesión hepática entre los diversos análogos de GnRH a pesar de su similitud en estructura. [14]
También hay un informe que indica que los agonistas de GnRH utilizados en el tratamiento del cáncer de próstata avanzado pueden aumentar el riesgo de problemas cardíacos en un 30%. [15]
Farmacología
Los agonistas de GnRH actúan como agonistas del receptor de GnRH , el objetivo biológico de la hormona liberadora de gonadotropina (GnRH). Estos medicamentos pueden ser tanto péptidos como de moléculas pequeñas . Siguen el modelo de la neurohormona hipotalámica GnRH, que interactúa con el receptor de GnRH para provocar su respuesta biológica, la liberación de las hormonas hipofisarias, la hormona folículo estimulante (FSH) y la hormona luteinizante (LH). Sin embargo, después de la respuesta inicial de "extensidad", la estimulación continua con agonistas de GnRH desensibiliza la glándula pituitaria (al provocar una regulación negativa del receptor de GnRH) a la GnRH. La desensibilización hipofisaria reduce la secreción de LH y FSH y, por lo tanto, induce un estado de anovulación hipogonadal hipogonadotrópica, a veces denominado "pseudomenopausia" u "ooforectomía médica". [1] Los agonistas de GnRH pueden detener por completo la producción de testosterona gonadal y, por lo tanto, suprimir los niveles circulantes de testosterona en un 95% o hasta el rango castrado/femenino en los hombres. [5]
Los agonistas no se disocian rápidamente del receptor de GnRH. Como resultado, inicialmente se produce un aumento de la secreción de FSH y LH (el llamado "efecto llamarada"). Los niveles de LH pueden aumentar hasta 10 veces, [16] [17] mientras que los niveles de testosterona generalmente aumentan entre un 140 y un 200 % de los valores iniciales. [18] Sin embargo, después de la administración continua, se logra un efecto hipogonadal profundo (es decir, disminución de FSH y LH) a través de la regulación negativa del receptor mediante la internalización de los receptores. [16] Generalmente este hipogonadismo inducido y reversible es el objetivo terapéutico. Durante el brote, los niveles máximos de testosterona ocurren después de 2 a 4 días, los niveles iniciales de testosterona regresan a los 7 a 8 días y los niveles de castración de testosterona se alcanzan a las 2 a 4 semanas. [18] [16] Un estudio de 7 días de mujeres infértiles encontró que la restauración de la secreción normal de gonadotropina toma de 5 a 8 días después del cese de los agonistas exógenos de GnRH. [19]
Se pueden usar varios medicamentos para prevenir el aumento de testosterona y/o sus efectos al inicio de la terapia con agonistas de GnRH. [17] [20] [21] Estos incluyen antigonadotropinas como progestágenos como acetato de ciproterona y acetato de clormadinona y estrógenos como dietilestilbestrol , fosfestrol (difosfato de dietilestilbestrol) y fosfato de estramustina ; antiandrógenos tales como antiandrógenos no esteroides como flutamida , nilutamida y bicalutamida ; e inhibidores de la síntesis de andrógenos como ketoconazol y acetato de abiraterona . [17] [20] [21] [22] [23] [24] [25]
Niveles de testosterona durante el primer mes de terapia de privación de andrógenos en hombres con cáncer de próstata tratados con inyecciones subcutáneas de un antagonista de GnRH (degarelix) o agonista (leuprorelina). Las dosis fueron 240, luego 80 mg/mes y 7,5 mg/mes, respectivamente. [26]
Niveles de testosterona en la terapia de privación de andrógenos a largo plazo en hombres con cáncer de próstata mediante diferentes agonistas de GnRH administrados en intervalos de 3 meses (goserelina, triptorelina y leuprorelina). La línea de puntos es el umbral para el rango de castración. [27]
Química
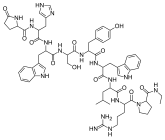
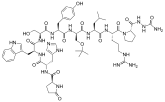
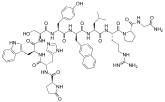
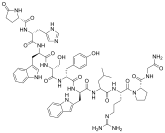
Los agonistas de GnRH se modelan sintéticamente a partir del decapéptido de GnRH natural con modificaciones específicas, generalmente sustituciones dobles y simples y típicamente en la posición 6 (sustitución de aminoácidos), 9 (alquilación) y 10 (deleción). Estas sustituciones inhiben la rápida degradación. Los agonistas con dos sustituciones incluyen: leuprorelina , buserelina , histrelina , goserelina y deslorelina . Los agentes nafarelina y triptorelina son agonistas con sustituciones simples en la posición 6.
Estructuras químicas de los agonistas de GnRH.
Usos veterinarios
Los análogos de GnRH también se utilizan en medicina veterinaria . Los usos incluyen:
- Supresión temporal de la fertilidad en perras
- Inducción de la ovulación en yeguas.
Ver también
Referencias
- ^ ab Magón N (octubre de 2011). "Agonistas de la hormona liberadora de gonadotropina: perspectivas en expansión". Revista india de endocrinología y metabolismo . 15 (4): 261–7. doi : 10.4103/2230-8210.85575 . PMC 3193774 . PMID 22028996.
- ^ Hemat RA (2 de marzo de 2003). Andropatía. Urotexto. págs.120–. ISBN 978-1-903737-08-8.
- ^ Becker KL (2001). Principios y práctica de la endocrinología y el metabolismo. Lippincott Williams y Wilkins. págs. 973–. ISBN 978-0-7817-1750-2.
- ^ Corson SL, Derman RJ (15 de diciembre de 1995). Control de fertilidad. Prensa CRC. págs. 249-250. ISBN 978-0-9697978-0-7.
- ^ ab Novara G, Galfano A, Secco S, Ficarra V, Artibani W (2009). "Impacto de la castración médica y quirúrgica sobre el nivel de testosterona sérica en pacientes con cáncer de próstata". Urología Internacional . 82 (3): 249–55. doi : 10.1159/000209352 . PMID 19440008.
- ^ Gardner DK, Simón C (26 de junio de 2017). Manual de fertilización in vitro (Cuarta ed.). Prensa CRC. págs.131–. ISBN 978-1-4987-2947-5.
- ^ Jameson JL, De Groot LJ (25 de febrero de 2015). Endocrinología: libro electrónico para adultos y pediátricos. Ciencias de la Salud Elsevier. págs. 2135–. ISBN 978-0-323-32195-2.
- ^ van Loenen AC, Huirne JA, Schats R, Hompes PG, Lambalk CB (noviembre de 2002). "Agonistas, antagonistas y concepción asistida de GnRH". Seminarios de Medicina Reproductiva . 20 (4): 349–64. doi :10.1055/s-2002-36713. PMID 12536358. S2CID 45436435.
- ^ Turner D, Briken P (enero de 2018). "Tratamiento de los trastornos parafílicos en delincuentes sexuales o hombres con riesgo de delincuencia sexual con agonistas de la hormona liberadora de hormona luteinizante: una revisión sistemática actualizada". La Revista de Medicina Sexual . 15 (1): 77–93. doi : 10.1016/j.jsxm.2017.11.013 . PMID 29289377.
- ^ Richard A. Lehne, Laura Rosenthal (25 de junio de 2014). Farmacología para la atención de enfermería - Libro electrónico. Ciencias de la Salud Elsevier. págs. 1296–. ISBN 978-0-323-29354-9.
- ^ James L. Gulley (20 de diciembre de 2011). Cancer de prostata. Publicación médica de demostraciones. págs. 503–. ISBN 978-1-936287-46-8.
- ^ Charles GD Brook, Peter Clayton, Rosalind Brown (22 de septiembre de 2011). Endocrinología clínica pediátrica de Brook. John Wiley e hijos. págs. 242–. ISBN 978-1-4443-1673-5.
- ^ Explorar Ghumman (22 de septiembre de 2015). Principios y práctica de la estimulación ovárica controlada en ART. Saltador. págs.96–. ISBN 978-81-322-1686-5.
- ^ LiverTox: información clínica y de investigación sobre lesión hepática inducida por fármacos [Internet]. Bethesda (MD): Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales; 2012-. Análogos de la hormona liberadora de gonadotropina (GnRH). [Actualizado el 20 de marzo de 2018]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK547863/
- ^ "Los investigadores sugieren que la terapia hormonal para el cáncer de próstata puede causar problemas cardíacos graves y la muerte". Noticias de ingeniería genética y biotecnología . 22 de septiembre de 2009.
- ^ abc Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA (25 de agosto de 2011). Campbell-Walsh Urology: Expert Consult Premium Edition: funciones en línea mejoradas e impresión, conjunto de 4 volúmenes. Ciencias de la Salud Elsevier. págs. 2939–. ISBN 978-1-4160-6911-9.
- ^ abc Thompson IM (2001). "Erupción asociada con la terapia con agonistas de LHRH". Reverendo Urol . 3 (Suplemento 3): T10–4. PMC 1476081 . PMID 16986003.
- ^ ab Krakowsky Y, Morgentaler A (julio de 2017). "Riesgo de aumento de testosterona en la era del modelo de saturación: un mito histórico más". Enfoque Euro Urol . 5 (1): 81–89. doi :10.1016/j.euf.2017.06.008. PMID 28753828. S2CID 10011200.
La administración inicial de agonistas de LHRH provoca de manera confiable un aumento transitorio de la T sérica, con valores máximos de T observados a los 2 a 4 días, seguidos de una reducción a los valores iniciales a los 7 a 8 días y el logro de los niveles de castración a los 2 días. –4 semanas [10]. La mayoría de los estudios demuestran un aumento en las concentraciones séricas máximas de T entre un 40% y un 100% por encima del valor inicial durante el brote de T.
- ^ Cedrin-Durnerin I, Bidart JM, Robert P, Wolf JP, Uzan M, Hugues JN (mayo de 2000). "Consecuencias sobre la secreción de gonadotropinas de una interrupción temprana de la administración de agonistas de la hormona liberadora de gonadotropinas en un protocolo a corto plazo para la fertilización in vitro". Reproducción Humana . 15 (5): 1009–14. doi :10.1093/humrep/15.5.1009. PMID 10783343.
- ^ ab Scaletscky R, Smith JA (abril de 1993). "Agudización de la enfermedad con análogos de la hormona liberadora de gonadotropina (GnRH). ¿Qué tan grave es?". Seguridad contra las drogas . 8 (4): 265–70. doi :10.2165/00002018-199308040-00001. PMID 8481213. S2CID 36964191.
- ^ ab Vis AN, van der Sluis TM, Al-Itejawi HH, van Moorselaar RJ, Meuleman EJ (enero de 2015). "Riesgo de exacerbación de la enfermedad con la terapia con agonistas de LHRH en hombres con cáncer de próstata: ¿mito o realidad?". Urol. Oncol . 33 (1): 7–15. doi :10.1016/j.urolonc.2014.04.016. PMID 25159013.
- ^ Kotake T, Usami M, Akaza H, Koiso K, Homma Y, Kawabe K, Aso Y, Orikasa S, Shimazaki J, Isaka S, Yoshida O, Hirao Y, Okajima E, Naito S, Kumazawa J, Kanetake H, Saito Y, Ohi Y, Ohashi Y (noviembre de 1999). "Acetato de goserelina con o sin antiandrógeno o estrógeno en el tratamiento de pacientes con cáncer de próstata avanzado: un ensayo controlado, aleatorizado y multicéntrico en Japón. Grupo de estudio Zoladex". Japón. J.Clin. Oncol . 29 (11): 562–70. doi : 10.1093/jjco/29.11.562 . PMID 10678560.
- ^ Shimizu TS, Shibata Y, Jinbo H, Satoh J, Yamanaka H (1995). "Fosfato de estramustina para prevenir los brotes en la terapia de depósito con análogos de la hormona liberadora de hormona luteinizante". EUR. Urol . 27 (3): 192–5. doi :10.1159/000475159. PMID 7541359.
- ^ Sugiono M, Winkler MH, Okeke AA, Benney M, Gillatt DA (2005). "Bicalutamida versus acetato de ciproterona en la prevención de brotes con terapia análoga de LHRH para el cáncer de próstata: un estudio piloto". Cáncer de próstata Enfermedad prostática . 8 (1): 91–4. doi : 10.1038/sj.pcan.4500784. PMID 15711607. S2CID 9151853.
- ^ Pokuri VK, Nourkeyhani H, Betsy B, Herbst L, Sikorski M, Spangenthal E, Fabiano A, George S (julio de 2015). "Estrategias para evitar el aumento repentino de testosterona y el brote de enfermedad en el cáncer de próstata avanzado: paradigmas de tratamiento emergentes". J Natl Compr Canc Netw . 13 (7): e49–55. doi : 10.6004/jnccn.2015.0109 . PMID 26150586.
- ^ Klotz L, Boccon-Gibod L, Shore ND, Andreou C, Persson BE, Cantor P, Jensen JK, Olesen TK, Schröder FH (diciembre de 2008). "La eficacia y seguridad de degarelix: un estudio de fase III de grupos paralelos, comparativo, aleatorizado, abierto y de 12 meses de duración en pacientes con cáncer de próstata". BJU Int . 102 (11): 1531–8. doi :10.1111/j.1464-410X.2008.08183.x. PMID 19035858.
- ^ Shim M, Bang WJ, Oh CY, Lee YS, Cho JS (julio de 2019). "Efectividad de tres agonistas diferentes de la hormona liberadora de hormona luteinizante en la castración química de pacientes con cáncer de próstata: goserelina versus triptorelina versus leuprolida". Investigación Clínica Urol . 60 (4): 244–250. doi :10.4111/icu.2019.60.4.244. PMC 6607074 . PMID 31294133.
enlaces externos
- Sitio web de Buserelin
- Uso de agonistas en la endometriosis.
- Lupron, por fabricante
- SupprelinLA, de Endo Pharmaceuticals, Inc.
- Información de uso de Zoladex en cáncer de próstata

![Niveles de testosterona durante el primer mes de terapia de privación de andrógenos en hombres con cáncer de próstata tratados con inyecciones subcutáneas de un antagonista de GnRH (degarelix) o agonista (leuprorelina). Las dosis fueron 240, luego 80 mg/mes y 7,5 mg/mes, respectivamente.[26]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/f8/Testosterone_levels_in_men_with_prostate_cancer_treated_with_GnRH_agonists_and_antagonists.png/300px-Testosterone_levels_in_men_with_prostate_cancer_treated_with_GnRH_agonists_and_antagonists.png)
![Niveles de testosterona en la terapia de privación de andrógenos a largo plazo en hombres con cáncer de próstata mediante diferentes agonistas de GnRH administrados en intervalos de 3 meses (goserelina, triptorelina y leuprorelina). La línea de puntos es el umbral para el rango de castración.[27]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/39/Testosterone_levels_in_long-term_androgen_deprivation_therapy_with_different_GnRH_agonists.png/300px-Testosterone_levels_in_long-term_androgen_deprivation_therapy_with_different_GnRH_agonists.png)