El adamantano es un compuesto orgánico con la fórmula C 10 H 16 o, más descriptivamente, (CH) 4 (CH 2 ) 6 . Las moléculas de adamantano pueden describirse como la fusión de tres anillos de ciclohexano . La molécula es rígida y virtualmente libre de tensiones. El adamantano es el isómero más estable de C 10 H 16 . La disposición espacial de los átomos de carbono en la molécula de adamantano es la misma que en el cristal de diamante . Esta similitud llevó al nombre adamantano , que se deriva del griego adamantinos (relativo al acero o al diamante ). [4] Es un sólido blanco con un olor parecido al del alcanfor . Es el diamantoide más simple .
El descubrimiento del adamantano en el petróleo en 1933 abrió un nuevo campo de la química dedicado a la síntesis y las propiedades de los compuestos orgánicos poliédricos. Los derivados del adamantano han encontrado aplicaciones prácticas como fármacos, materiales poliméricos y lubricantes térmicamente estables.
En 1924, H. Decker sugirió la existencia del adamantano, al que llamó decaterpeno . [5]
El primer intento de síntesis en laboratorio fue realizado en 1924 por el químico alemán Hans Meerwein mediante la reacción de formaldehído con malonato de dietilo en presencia de piperidina . En lugar de adamantano, Meerwein obtuvo 1,3,5,7-tetracarbometoxibiciclo[3.3.1]nonano-2,6-diona: este compuesto, posteriormente llamado éster de Meerwein, se utilizó en la síntesis de adamantano y sus derivados. [6] D. Bottger intentó obtener adamantano utilizando el éster de Meerwein como precursor. El producto, triciclo-[3.3.1.1 3,7 ], no era adamantano, sino un derivado. [7]
Otros investigadores intentaron sintetizar adamantano utilizando floroglucinol y derivados de ciclohexanona , pero también fracasaron. [8]

El adamantano fue sintetizado por primera vez por Vladimir Prelog en 1941 a partir del éster de Meerwein. [9] [10] Con un rendimiento del 0,16 %, el proceso de cinco etapas era poco práctico (simplificado en la imagen siguiente). El método se utiliza para sintetizar ciertos derivados del adamantano. [8]

El método de Prelog se perfeccionó en 1956. El rendimiento de descarboxilación se incrementó mediante la adición de la vía Hunsdiecker (11%) y la reacción de Hoffman (24%) que elevó el rendimiento total al 6,5%. [11] [12] El proceso todavía era demasiado complejo, y en 1957 Paul von Ragué Schleyer encontró un método más conveniente : primero se hidrogenó el diciclopentadieno en presencia de un catalizador (por ejemplo, dióxido de platino ) para dar triciclodecano y luego se transformó en adamantano utilizando un ácido de Lewis (por ejemplo, cloruro de aluminio ) como otro catalizador. Este método aumentó el rendimiento al 30-40% y proporcionó una fuente asequible de adamantano; por lo tanto, estimuló la caracterización del adamantano y todavía se utiliza en la práctica de laboratorio. [13] [14] El rendimiento de la síntesis de adamantano se incrementó posteriormente al 60% [15] y al 98% mediante catálisis por ultrasonidos y superácidos . [16] Hoy en día, el adamantano es un compuesto químico asequible con un costo de uno o dos dólares por gramo.

Todos los métodos anteriores producen adamantano como un polvo policristalino. Usando este polvo, se pueden cultivar cristales individuales a partir de la fase fundida, solución o vapor (por ejemplo, con la técnica de Bridgman-Stockbarger ). El crecimiento en estado fundido da como resultado la peor calidad cristalina con una extensión de mosaico en la reflexión de rayos X de aproximadamente 1°. Los mejores cristales se obtienen a partir de la fase líquida, pero el crecimiento es impracticablemente lento: varios meses para un cristal de 5 a 10 mm. El crecimiento a partir de la fase de vapor es un compromiso razonable en términos de velocidad y calidad. [17] El adamantano se sublima en un tubo de cuarzo colocado en un horno, que está equipado con varios calentadores que mantienen un cierto gradiente de temperatura (aproximadamente 10 °C/cm para adamantano) a lo largo del tubo. La cristalización comienza en un extremo del tubo, que se mantiene cerca del punto de congelación del adamantano. El enfriamiento lento del tubo, mientras se mantiene el gradiente de temperatura, cambia gradualmente la zona de fusión (velocidad ~2 mm/hora), produciendo una bola de cristal único . [18]
El adamantano fue aislado por primera vez del petróleo por los químicos checos S. Landa, V. Machacek y M. Mzourek. [19] [20] Utilizaron la destilación fraccionada del petróleo. Pudieron producir solo unos pocos miligramos de adamantano, pero notaron sus altos puntos de ebullición y fusión . Debido a la (supuesta) similitud de su estructura con la del diamante, el nuevo compuesto fue llamado adamantano. [8]
El petróleo sigue siendo una fuente de adamantano; el contenido varía entre 0,0001% y 0,03% dependiendo del yacimiento petrolífero y es demasiado bajo para la producción comercial. [21] [22]
El petróleo contiene más de treinta derivados del adamantano. [21] Su aislamiento de una mezcla compleja de hidrocarburos es posible debido a su alto punto de fusión y la capacidad de destilar con vapor de agua y formar aductos estables con tiourea .
El adamantano puro es un sólido cristalino incoloro con un olor característico a alcanfor . Es prácticamente insoluble en agua, pero fácilmente soluble en disolventes orgánicos no polares . [23] El adamantano tiene un punto de fusión inusualmente alto para un hidrocarburo . A 270 °C, su punto de fusión es mucho más alto que el de otros hidrocarburos con el mismo peso molecular, como el canfeno (45 °C), el limoneno (−74 °C), el ocimeno (50 °C), el terpineno (60 °C) o el twistano (164 °C), o que el decano , un hidrocarburo lineal C 10 H 22 (−28 °C). Sin embargo, el adamantano sublima lentamente incluso a temperatura ambiente. [24] El adamantano se puede destilar con vapor de agua . [22]

Como se deduce por difracción de electrones y cristalografía de rayos X , la molécula tiene simetría T d . Las longitudes de enlace carbono-carbono son 1,54 Å , casi idénticas a las del diamante. Las distancias carbono-hidrógeno son 1,112 Å. [3]
En condiciones ambientales, el adamantano cristaliza en una estructura cúbica centrada en las caras ( grupo espacial Fm3m, a = 9,426 ± 0,008 Å , cuatro moléculas en la celda unitaria) que contiene moléculas de adamantano desordenadas en su orientación. Esta estructura se transforma en una fase tetragonal primitiva y ordenada ( a = 6,641 Å , c = 8,875 Å ) con dos moléculas por celda, ya sea al enfriarse a 208 K o al presurizarse a más de 0,5 GPa. [8] [24]
Esta transición de fase es de primer orden y va acompañada de una anomalía en la capacidad térmica , la elasticidad y otras propiedades. En particular, mientras que las moléculas de adamantano giran libremente en la fase cúbica, están congeladas en la tetragonal; la densidad aumenta gradualmente de 1,08 a 1,18 g/cm 3 y la entropía cambia en una cantidad significativa de 1594 J/(mol·K). [17]
Las constantes elásticas del adamantano se midieron utilizando cristales individuales grandes (de un centímetro de tamaño) y la técnica de eco ultrasónico. El valor principal del tensor de elasticidad , C 11 , se dedujo como 7,52, 8,20 y 6,17 GPa para las direcciones cristalinas <110>, <111> y <100>. [18] A modo de comparación, los valores correspondientes para el diamante cristalino son 1161, 1174 y 1123 GPa. [25] La disposición de los átomos de carbono es la misma en el adamantano y el diamante; [26] sin embargo, en el sólido de adamantano, las moléculas no forman una red covalente como en el diamante, sino que interactúan a través de fuerzas de van der Waals débiles . Como resultado, los cristales de adamantano son muy blandos y plásticos. [17] [18] [27]
El espectro de resonancia magnética nuclear (RMN) del adamantano consta de dos señales de baja resolución, que corresponden a los sitios 1 y 2 (véase la imagen siguiente). Los desplazamientos químicos de RMN de 1H y 13C son respectivamente 1,873 y 1,756 ppm y 28,46 y 37,85 ppm. [28] La simplicidad de estos espectros es coherente con una alta simetría molecular.
Los espectros de masas del adamantano y sus derivados son bastante característicos. El pico principal en m / z = 136 corresponde al C
10yo+
16ion. Su fragmentación da como resultado señales más débiles como m / z = 93, 80, 79, 67, 41 y 39. [3] [28]
El espectro de absorción infrarroja del adamantano es relativamente simple debido a la alta simetría de la molécula. Las principales bandas de absorción y su asignación se indican en la tabla: [3]
* Las leyendas corresponden a los tipos de oscilaciones: δ – deformación, ν – estiramiento, ρ y ω – vibraciones de deformación fuera del plano de los grupos CH 2 .
Los derivados de adamantano con diferentes sustituyentes en cada sitio de carbono nodal son quirales . [29] Esta actividad óptica se describió en adamantano en 1969 con los cuatro sustituyentes diferentes siendo hidrógeno , bromo , metilo y carboxilo . Los valores de rotación específica son pequeños y generalmente están dentro de 1°. [30] [31]
Según las reglas de nomenclatura sistemática, el adamantano se denomina triciclo[3.3.1.1 3,7 ]decano. Sin embargo, la IUPAC recomienda utilizar el nombre "adamantano". [1]

La molécula de adamantano está compuesta únicamente de carbono e hidrógeno y tiene simetría T d . Por lo tanto, sus 16 átomos de hidrógeno y 10 de carbono pueden describirse únicamente mediante dos sitios, que están etiquetados en la figura como 1 (4 sitios equivalentes) y 2 (6 sitios equivalentes).
Los parientes estructurales del adamantano son el noradamantano y el homoadamantano, que contienen respectivamente un enlace CH 2 menos y uno más que el adamantano.
El grupo funcional derivado del adamantano es el adamantilo, formalmente denominado 1-adamantilo o 2-adamantilo según el sitio que esté conectado a la molécula original. Los grupos adamantilo son un grupo colgante voluminoso que se utiliza para mejorar las propiedades térmicas y mecánicas de los polímeros. [32] [33]
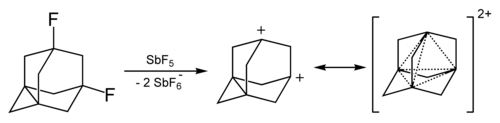
El catión adamantano se puede producir tratando el 1-fluoro-adamantano con SbF 5 . Su estabilidad es relativamente alta. [34] [35]
La dicationización del 1,3-dideshidroadamantano se obtuvo en soluciones de superácidos . También tiene una estabilidad elevada debido al fenómeno llamado "aromaticidad tridimensional" [36] u homoaromaticidad . [37] Este enlace de dos electrones de cuatro centros involucra un par de electrones deslocalizados entre los cuatro átomos de cabeza de puente.
La mayoría de las reacciones del adamantano se producen a través de los sitios de carbono 3-coordinados. Están involucrados en la reacción del adamantano con ácido sulfúrico concentrado que produce adamantanona . [38]

El grupo carbonilo de la adamantanona permite reacciones posteriores a través del sitio de unión. Por ejemplo, la adamantanona es el compuesto de partida para obtener derivados de adamantano como el 2-adamantanocarbonitrilo [39] y el 2-metil-adamantano. [40]
El adamantano reacciona fácilmente con diversos agentes bromantes, incluido el bromo molecular . La composición y la proporción de los productos de reacción dependen de las condiciones de reacción y, especialmente, de la presencia y el tipo de catalizadores . [21]
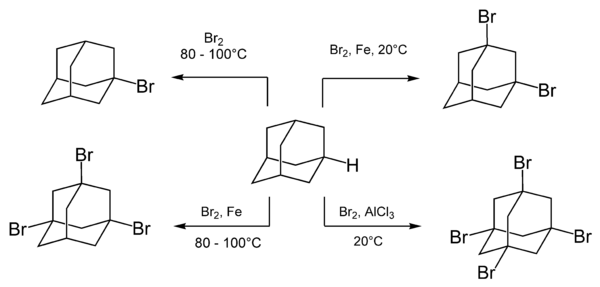
La ebullición del adamantano con bromo da como resultado un adamantano monosustituido, el 1-bromadamantano. La sustitución múltiple con bromo se logra añadiendo un catalizador de ácido de Lewis . [41]
La velocidad de bromación se acelera con la adición de ácidos de Lewis y no se modifica con la irradiación o la adición de radicales libres. Esto indica que la reacción se produce mediante un mecanismo iónico. [8]
Las primeras fluoraciones de adamantano se llevaron a cabo utilizando 1-hidroxiadamantano [42] y 1-aminoadamantano como compuestos iniciales. Más tarde, la fluoración se logró a partir del propio adamantano. [43] En todos estos casos, la reacción se llevó a cabo mediante la formación del catión adamantano que luego interactuó con nucleófilos fluorados. También se ha informado de la fluoración de adamantano con flúor gaseoso . [44]
La carboxilación de adamantano con ácido fórmico produce ácido 1-adamantanocarboxílico . [45]

El 1-hidroxiadamantano se forma fácilmente por hidrólisis del 1-bromadamantano en una solución acuosa de acetona . También se puede producir por ozonización del adamantano: [46] La oxidación del alcohol produce adamantanona .

El adamantano interactúa con el benceno en presencia de ácidos de Lewis, lo que da lugar a una reacción de Friedel-Crafts . [47] Los derivados de adamantano sustituidos con arilo se pueden obtener fácilmente a partir del 1-hidroxiadamantano. En particular, la reacción con anisol se produce en condiciones normales y no requiere un catalizador. [41]
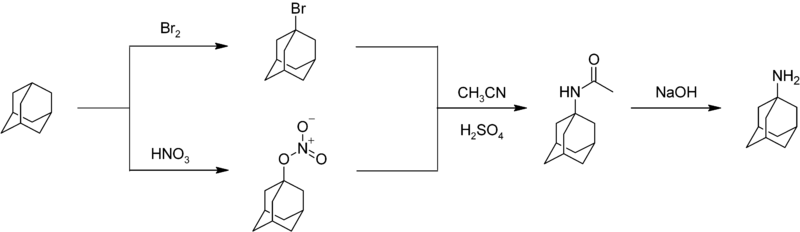
La nitración del adamantano es una reacción difícil que se caracteriza por rendimientos moderados. [48] Se puede preparar un fármaco sustituido con nitrógeno, la amantadina, haciendo reaccionar el adamantano con bromo o ácido nítrico para dar el bromuro o el nitroéster en la posición 1. La reacción de cualquiera de los compuestos con acetonitrilo produce la acetamida, que se hidroliza para dar 1-adamantilamina: [49]
El adamantano en sí tiene pocas aplicaciones, ya que es simplemente un hidrocarburo no funcionalizado . Se utiliza en algunas máscaras de grabado en seco [50] y formulaciones de polímeros .
En la espectroscopia de RMN de estado sólido , el adamantano es un estándar común para la referencia del desplazamiento químico . [51]
En los láseres de colorante , se puede utilizar adamantano para prolongar la vida útil del medio de ganancia; no se puede fotoionizar en la atmósfera porque sus bandas de absorción se encuentran en la región ultravioleta del vacío del espectro. Se han determinado energías de fotoionización para el adamantano, así como para varios diamantoides más grandes . [52]
Todas las aplicaciones médicas conocidas hasta ahora no implican adamantano puro, sino sus derivados. El primer derivado de adamantano utilizado como fármaco fue la amantadina , primero (1967) como fármaco antiviral contra varias cepas de influenza [53] y luego para tratar la enfermedad de Parkinson . [54] [55] Otros fármacos entre los derivados de adamantano incluyen adapaleno , adapromina , bromantano (bromantan), carmantadina , clodantano (chlodantan), dopamantina , gludantano (gludantane), hemantano (hymantane), idramantona (kemantane), memantina , nitromemantina , rimantadina , saxagliptina , somantadina , tromantadina y vildagliptina . Los polímeros de adamantano han sido patentados como agentes antivirales contra el VIH . [56]
Las cepas del virus de la influenza han desarrollado resistencia a los medicamentos amantadina y rimantadina, que no son eficaces contra las cepas prevalentes hasta 2016.
Recientemente se identificó al adamantano como una subunidad estructural clave en varios fármacos de diseño cannabinoides sintéticos , a saber, AB-001 y SDB-001 . [57]
El adamantano es un candidato atractivo como propulsor en los propulsores de efecto Hall porque se ioniza fácilmente, se puede almacenar en forma sólida en lugar de en un tanque de alta presión y es relativamente no tóxico. [58]
Algunos derivados de alquilo de adamantano se han utilizado como fluido de trabajo en sistemas hidráulicos . [59] Los polímeros basados en adamantano podrían encontrar aplicación para recubrimientos de pantallas táctiles , [60] y existen perspectivas para usar adamantano y sus homólogos en nanotecnología . Por ejemplo, la estructura blanda similar a una jaula del sólido de adamantano permite la incorporación de moléculas huésped, que pueden liberarse dentro del cuerpo humano al romper la matriz. [15] [61] El adamantano podría usarse como bloques de construcción moleculares para el autoensamblaje de cristales moleculares. [62] [63]
Muchas moléculas e iones adoptan estructuras de jaula similares a las del adamantano. Entre ellos se incluyen el trióxido de fósforo P 4 O 6 , el trióxido de arsénico As 4 O 6 , el pentóxido de fósforo P 4 O 10 = (PO) 4 O 6 , el pentasulfuro de fósforo P 4 S 10 = (PS) 4 S 6 y la hexametilentetramina C 6 N 4 H 12 = N 4 (CH 2 ) 6 . [64] Particularmente notoria es la tetrametilendisulfotetramina , a menudo abreviada como "tetramina", un rodenticida prohibido en la mayoría de los países por su extrema toxicidad para los humanos. El análogo de silicio del adamantano, el sila-adamantano, se sintetizó en 2005. [65] La arsenicina A es un compuesto químico organoarsénico natural aislado de la esponja marina de Nueva Caledonia Echinochalina bargibanti y es el primer heterociclo conocido que contiene múltiples átomos de arsénico. [66] [67] [68] [69]
La unión de jaulas de adamantano produce diamantoides superiores , como el diamantano (C 14 H 20 – dos jaulas de adamantano fusionadas), el triamantano (C 18 H 24 ), el tetramantano (C 22 H 28 ), el pentamantano (C 26 H 32 ), el hexamantano (C 26 H 30 ), etc. Su síntesis es similar a la del adamantano y, al igual que el adamantano, también se pueden extraer del petróleo, aunque con rendimientos incluso mucho menores.
adamantano y cubano se utilizan en la nomenclatura general y como nombres IUPAC preferidos.