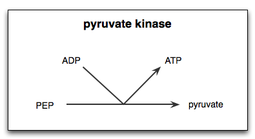
La piruvato quinasa es la enzima involucrada en el último paso de la glucólisis . Cataliza la transferencia de un grupo fosfato del fosfoenolpiruvato (PEP) al difosfato de adenosina (ADP), produciendo una molécula de piruvato y una molécula de ATP . [1] La piruvato quinasa fue nombrada inapropiadamente (de manera inconsistente con una quinasa convencional ) antes de que se reconociera que no catalizaba directamente la fosforilación del piruvato , que no ocurre en condiciones fisiológicas. [2] La piruvato quinasa está presente en cuatro isoenzimas distintas y específicas de tejido en animales, cada una de las cuales consta de propiedades cinéticas particulares necesarias para adaptarse a las variaciones en los requisitos metabólicos de diversos tejidos.
Cuatro isoenzimas de la piruvato quinasa expresadas en vertebrados: L (hígado), R (eritrocitos), M1 (músculo y cerebro) y M2 (tejido fetal temprano y la mayoría de los tejidos adultos). Las isoenzimas L y R son expresadas por el gen PKLR , mientras que las isoenzimas M1 y M2 son expresadas por el gen PKM2 . Las isoenzimas R y L difieren de M1 y M2 en que están reguladas alostéricamente. Cinéticamente, las isoenzimas R y L de la piruvato quinasa tienen dos estados de conformación distintos; uno con una alta afinidad de sustrato y otro con una baja afinidad de sustrato. El estado R, caracterizado por una alta afinidad de sustrato, sirve como la forma activada de la piruvato quinasa y es estabilizado por PEP y fructosa 1,6-bisfosfato (FBP), promoviendo la vía glucolítica. El estado T, caracterizado por una baja afinidad por el sustrato, actúa como la forma inactivada de la piruvato quinasa, unida y estabilizada por ATP y alanina , lo que provoca la fosforilación de la piruvato quinasa y la inhibición de la glucólisis. [3] La isozima M2 de la piruvato quinasa puede formar tetrámeros o dímeros. Los tetrámeros tienen una alta afinidad por la PEP, mientras que los dímeros tienen una baja afinidad por la PEP. La actividad enzimática se puede regular fosforilando tetrámeros altamente activos de PKM2 en dímeros inactivos. [4]
El gen PKM consta de 12 exones y 11 intrones . PKM1 y PKM2 son diferentes productos de empalme del gen M (PKM1 contiene el exón 9 mientras que PKM2 contiene el exón 10) y solo difieren en 23 aminoácidos dentro de un tramo de 56 aminoácidos (aa 378-434) en su extremo carboxiterminal . [5] [6] El gen PKM está regulado a través de proteínas ribonucleotídicas heterogéneas como hnRNPA1 y hnRNPA2. [7] El monómero PKM2 humano tiene 531 aminoácidos y es una cadena única dividida en dominios A, B y C. La diferencia en la secuencia de aminoácidos entre PKM1 y PKM2 permite que PKM2 sea regulado alostéricamente por FBP y que forme dímeros y tetrámeros mientras que PKM1 solo puede formar tetrámeros. [8]
Muchas enterobacterias, incluida E. coli , tienen dos isoformas de la piruvato quinasa, PykA y PykF, que son 37% idénticas en E. coli (Uniprot: PykA, PykF). Catalizan la misma reacción que en eucariotas, es decir, la generación de ATP a partir de ADP y PEP, el último paso de la glucólisis , un paso que es irreversible en condiciones fisiológicas. PykF está regulada alostéricamente por FBP, lo que refleja la posición central de PykF en el metabolismo celular. [9] La transcripción de PykF en E. coli está regulada por el regulador transcripcional global, Cra (FruR). [10] [11] [12] Se demostró que PfkB es inhibida por MgATP a bajas concentraciones de Fru-6P, y esta regulación es importante para la gluconeogénesis . [13]
La reacción de la piruvato quinasa en la glucólisis consta de dos pasos. En primer lugar, el PEP transfiere un grupo fosfato al ADP, lo que produce ATP y el enolato de piruvato. En segundo lugar, se debe añadir un protón al enolato de piruvato para producir la forma funcional de piruvato que la célula necesita. [14] Dado que el sustrato de la piruvato quinasa es un simple fosfoazúcar y el producto es un ATP, la piruvato quinasa es una posible enzima fundamental para la evolución del ciclo de la glucólisis y puede ser una de las enzimas más antiguas de toda la vida terrestre. El fosfoenolpiruvato puede haber estado presente de forma abiótica y se ha demostrado que se produce con un alto rendimiento en una vía primitiva de glucólisis de triosas. [15]
En las células de levadura, se encontró que la interacción de la piruvato quinasa de levadura (YPK) con PEP y su efector alostérico Fructosa 1,6-bisfosfato (FBP,) se vio potenciada por la presencia de Mg 2+ . Por lo tanto, se concluyó que Mg 2+ era un cofactor importante en la catálisis de PEP en piruvato por la piruvato quinasa. Además, se demostró que el ion metálico Mn 2+ tenía un efecto similar, pero más fuerte, sobre YPK que Mg 2+ . La unión de iones metálicos a los sitios de unión de metales en la piruvato quinasa mejora la velocidad de esta reacción. [16]
La reacción catalizada por la piruvato quinasa es el paso final de la glucólisis. Es uno de los tres pasos limitantes de la velocidad de esta vía. Los pasos limitantes de la velocidad son los pasos más lentos y regulados de una vía y, por lo tanto, determinan la velocidad general de la vía. En la glucólisis, los pasos limitantes de la velocidad están acoplados a la hidrólisis de ATP o a la fosforilación de ADP, lo que hace que la vía sea energéticamente favorable y esencialmente irreversible en las células. Este paso final está altamente regulado y es deliberadamente irreversible porque el piruvato es un bloque de construcción intermedio crucial para otras vías metabólicas. [17] Una vez que se produce el piruvato, ingresa al ciclo del TCA para una mayor producción de ATP en condiciones aeróbicas, o se convierte en ácido láctico o etanol en condiciones anaeróbicas.
La piruvato quinasa también actúa como enzima reguladora de la gluconeogénesis , una vía bioquímica en la que el hígado genera glucosa a partir del piruvato y otros sustratos. La gluconeogénesis utiliza fuentes distintas de los carbohidratos para proporcionar glucosa al cerebro y a los glóbulos rojos en momentos de inanición cuando se agotan las reservas directas de glucosa. [17] Durante el estado de ayuno , la piruvato quinasa se inhibe, lo que evita la "fuga" de fosfoenolpiruvato para que no se convierta en piruvato; [17] en cambio, el fosfoenolpiruvato se convierte en glucosa a través de una cascada de reacciones de gluconeogénesis . Aunque utiliza enzimas similares, la gluconeogénesis no es lo contrario de la glucólisis. Es, en cambio, una vía que evita los pasos irreversibles de la glucólisis. Además, la gluconeogénesis y la glucólisis no ocurren simultáneamente en la célula en un momento dado, ya que están reguladas recíprocamente por la señalización celular. [17] Una vez completada la vía de la gluconeogénesis, la glucosa producida se expulsa del hígado, proporcionando energía a los tejidos vitales en estado de ayuno.
La glucólisis está altamente regulada en tres de sus pasos catalíticos: la fosforilación de la glucosa por la hexoquinasa , la fosforilación de la fructosa-6-fosfato por la fosfofructoquinasa y la transferencia de fosfato de PEP a ADP por la piruvato quinasa. En condiciones de tipo salvaje, estas tres reacciones son irreversibles, tienen una gran energía libre negativa y son responsables de la regulación de esta vía. [17] La actividad de la piruvato quinasa está regulada de manera más amplia por efectores alostéricos, modificadores covalentes y control hormonal. Sin embargo, el regulador más significativo de la piruvato quinasa es la fructosa-1,6-bisfosfato (FBP), que sirve como efector alostérico para la enzima.
La regulación alostérica es la unión de un efector a un sitio de la proteína distinto del sitio activo, lo que provoca un cambio conformacional y altera la actividad de esa proteína o enzima en particular. Se ha descubierto que la piruvato quinasa se activa alostéricamente con FBP y se inactiva alostéricamente con ATP y alanina. [18] La tetramerización de la piruvato quinasa es promovida por FBP y serina, mientras que la disociación del tetrámero es promovida por L-cisteína. [19] [20] [21]
La FBP es la fuente de regulación más importante porque proviene de la vía de la glucólisis. La FBP es un intermediario glucolítico producido a partir de la fosforilación de la fructosa 6-fosfato . La FBP se une al sitio de unión alostérico en el dominio C de la piruvato quinasa y cambia la conformación de la enzima, lo que provoca la activación de la actividad de la piruvato quinasa. [22] Como intermediario presente dentro de la vía glucolítica, la FBP proporciona estimulación de retroalimentación porque cuanto mayor sea la concentración de FBP, mayor será la activación alostérica y la magnitud de la actividad de la piruvato quinasa. La piruvato quinasa es más sensible a los efectos de la FBP. Como resultado, el resto de los mecanismos reguladores sirven como modificación secundaria. [9] [23]
Los modificadores covalentes actúan como reguladores indirectos al controlar la fosforilación, desfosforilación, acetilación, succinilación y oxidación de las enzimas, lo que da como resultado la activación e inhibición de la actividad enzimática. [24] En el hígado, el glucagón y la epinefrina activan la proteína quinasa A , que actúa como un modificador covalente al fosforilar y desactivar la piruvato quinasa. Por el contrario, la secreción de insulina en respuesta a la elevación del azúcar en sangre activa la fosfoproteína fosfatasa I, lo que provoca la desfosforilación y activación de la piruvato quinasa para aumentar la glucólisis. La misma modificación covalente tiene el efecto opuesto sobre las enzimas de la gluconeogénesis. Este sistema de regulación es responsable de evitar un ciclo inútil mediante la prevención de la activación simultánea de la piruvato quinasa y las enzimas que catalizan la gluconeogénesis. [25]
Para evitar un ciclo inútil , la glucólisis y la gluconeogénesis están fuertemente reguladas para asegurar que nunca estén operando en la célula al mismo tiempo. Como resultado, la inhibición de la piruvato quinasa por el glucagón, el AMP cíclico y la epinefrina, no solo detiene la glucólisis, sino que también estimula la gluconeogénesis. Alternativamente, la insulina interfiere con el efecto del glucagón, el AMP cíclico y la epinefrina, haciendo que la piruvato quinasa funcione normalmente y que se detenga la gluconeogénesis. Además, se encontró que la glucosa inhibe y altera la gluconeogénesis, dejando intacta la actividad de la piruvato quinasa y la glucólisis. En general, la interacción entre hormonas juega un papel clave en el funcionamiento y la regulación de la glucólisis y la gluconeogénesis en la célula. [26]
La metformina, o dimetilbiguanida , es el principal tratamiento utilizado para la diabetes tipo 2. Se ha demostrado que la metformina afecta indirectamente a la piruvato quinasa a través de la inhibición de la gluconeogénesis. Específicamente, la adición de metformina está relacionada con una marcada disminución en el flujo de glucosa y un aumento en el flujo de lactato/piruvato de varias vías metabólicas. Aunque la metformina no afecta directamente la actividad de la piruvato quinasa, causa una disminución en la concentración de ATP. Debido a los efectos inhibidores alostéricos del ATP sobre la piruvato quinasa, una disminución en el ATP da como resultado una inhibición disminuida y la posterior estimulación de la piruvato quinasa. En consecuencia, el aumento en la actividad de la piruvato quinasa dirige el flujo metabólico a través de la glucólisis en lugar de la gluconeogénesis. [27]
Las proteínas ribonucleótidos heterogéneas (hnRNP) pueden actuar sobre el gen PKM para regular la expresión de las isoformas M1 y M2. Las isoformas PKM1 y PKM2 son variantes de empalme del gen PKM que difieren en un solo exón. Varios tipos de hnRNP, como hnRNPA1 y hnRNPA2, ingresan al núcleo durante las condiciones de hipoxia y modulan la expresión de manera que la PKM2 se regule positivamente. [28] Las hormonas como la insulina regulan positivamente la expresión de PKM2, mientras que hormonas como la triyodotironina (T3) y el glucagón ayudan a regular negativamente la PKM2. [29]
ChREBP es un factor de transcripción que regula la expresión de la isoenzima L de la piruvato quinasa. [30] Un módulo de detección de glucosa contiene dominios que son objetivos para la fosforilación reguladora basada en las concentraciones de glucosa y AMPc, que luego controlan su importación al núcleo. [31] También puede activarse aún más mediante la unión directa de glucosa-6-fosfato. [30] [32] Una vez en el núcleo, sus dominios de unión al ADN activan la transcripción de la piruvato quinasa. [31] Por lo tanto, la glucosa alta y el AMPc bajo provocan la desfosforilación de ChREBP , que luego regula positivamente la expresión de la piruvato quinasa en el hígado. [30]
Los defectos genéticos de esta enzima causan la enfermedad conocida como deficiencia de piruvato quinasa . En esta condición, la falta de piruvato quinasa ralentiza el proceso de glucólisis. Este efecto es especialmente devastador en células que carecen de mitocondrias , porque estas células deben utilizar la glucólisis anaeróbica como su única fuente de energía porque el ciclo del TCA no está disponible. Por ejemplo, los glóbulos rojos , que en un estado de deficiencia de piruvato quinasa, rápidamente se vuelven deficientes en ATP y pueden sufrir hemólisis . Por lo tanto, la deficiencia de piruvato quinasa puede causar anemia hemolítica no esferocítica crónica (CNSHA). [33]
La deficiencia de piruvato quinasa es causada por un rasgo autosómico recesivo. Los mamíferos tienen dos genes de piruvato quinasa, PK-LR (que codifica las isoenzimas L y R de la piruvato quinasa) y PK-M (que codifica la isoenzima M1 de la piruvato quinasa), pero solo PKLR codifica la isoenzima de los glóbulos rojos que afecta la deficiencia de piruvato quinasa. Se han identificado más de 250 mutaciones del gen PK-LR que se asocian con la deficiencia de piruvato quinasa. Las pruebas de ADN han guiado el descubrimiento de la ubicación de PKLR en el cromosoma 1 y el desarrollo de pruebas de secuenciación genética directa para diagnosticar molecularmente la deficiencia de piruvato quinasa. [34]
Las especies reactivas de oxígeno (ROS) son formas químicamente reactivas del oxígeno. En las células pulmonares humanas, se ha demostrado que las ROS inhiben la isoenzima M2 de la piruvato quinasa (PKM2). Las ROS logran esta inhibición oxidando Cys358 e inactivando PKM2. Como resultado de la inactivación de PKM2, el flujo de glucosa ya no se convierte en piruvato, sino que se utiliza en la vía de la pentosa fosfato, lo que da como resultado la reducción y desintoxicación de las ROS. De esta manera, los efectos nocivos de las ROS aumentan y causan un mayor estrés oxidativo en las células pulmonares, lo que lleva a la posible formación de tumores. Este mecanismo inhibidor es importante porque puede sugerir que los mecanismos reguladores en PKM2 son responsables de ayudar a la resistencia de las células cancerosas al estrés oxidativo y la tumorigénesis mejorada. [35] [36]
Se ha descubierto que la fenilalanina funciona como un inhibidor competitivo de la piruvato quinasa en el cerebro. Aunque el grado de actividad inhibidora de la fenilalanina es similar en las células fetales y adultas, las enzimas de las células cerebrales fetales son significativamente más vulnerables a la inhibición que las de las células cerebrales adultas. Un estudio de PKM2 en bebés con la enfermedad cerebral genética fenilcetonúrica (PKU), mostró niveles elevados de fenilalanina y una menor eficacia de PKM2. Este mecanismo inhibidor proporciona información sobre el papel de la piruvato quinasa en el daño a las células cerebrales. [37] [38]
Las células cancerosas tienen una maquinaria metabólica característicamente acelerada y se cree que la piruvato quinasa tiene un papel en el cáncer. En comparación con las células sanas, las células cancerosas tienen niveles elevados de la isoforma PKM2, específicamente el dímero de baja actividad. Por lo tanto, los niveles séricos de PKM2 se utilizan como marcadores del cáncer. El dímero de baja actividad permite la acumulación de fosfoenol piruvato (PEP), lo que deja grandes concentraciones de intermediarios glucolíticos para la síntesis de biomoléculas que eventualmente serán utilizadas por las células cancerosas. [8] La fosforilación de PKM2 por la proteína quinasa 1 activada por mitógenos (ERK2) causa cambios conformacionales que permiten que PKM2 ingrese al núcleo y regule la expresión del gen glucolítico necesario para el desarrollo del tumor. [39] Algunos estudios afirman que hay un cambio en la expresión de PKM1 a PKM2 durante la carcinogénesis. Los microambientes tumorales como la hipoxia activan factores de transcripción como el factor inducible por hipoxia para promover la transcripción de PKM2, que forma un ciclo de retroalimentación positiva para mejorar su propia transcripción. [8]
Una enzima reversible con una función similar, la piruvato fosfato diquinasa (PPDK), se encuentra en algunas bacterias y ha sido transferida a varios grupos de eucariotas anaeróbicos (por ejemplo, Streblomastix , Giardia , Entamoeba y Trichomonas ), al parecer a través de transferencia horizontal de genes en dos o más ocasiones. En algunos casos, el mismo organismo tendrá tanto piruvato quinasa como PPDK. [40]