La ribosa-fosfato difosfoquinasa (o fosforribosil pirofosfato sintetasa o ribosa-fosfato pirofosfoquinasa ) es una enzima que convierte la ribosa 5-fosfato en fosforribosil pirofosfato (PRPP). [1] [2] Está clasificada bajo EC 2.7.6.1.
La enzima está involucrada en la síntesis de nucleótidos ( purinas y pirimidinas ), cofactores NAD y NADP , y aminoácidos histidina y triptófano , [1] [2] [3] vinculando estos procesos biosintéticos a la vía de la pentosa fosfato, de la cual se deriva el sustrato ribosa 5-fosfato. La ribosa 5-fosfato es producida por la vía de derivación HMP a partir de la glucosa-6-fosfato . El producto pirofosfato de fosforribosil actúa como un componente esencial de la vía de rescate de purinas y la síntesis de novo de purinas . La disfunción de la enzima socavaría así el metabolismo de las purinas . La pirofosfoquinasa ribosa-fosfato existe en bacterias, plantas y animales, y hay tres isoformas de la pirofosfoquinasa ribosa-fosfato humana. [2] En los humanos, los genes que codifican la enzima se encuentran en el cromosoma X. [2]

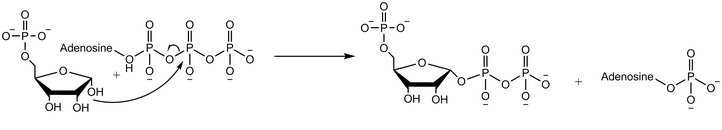
La ribosa-fosfato difosfoquinasa transfiere el grupo difosforilo del Mg-ATP (Mg2+ coordinado con ATP) a la ribosa 5-fosfato. [2] La reacción enzimática comienza con la unión de la ribosa 5-fosfato, seguida de la unión del Mg-ATP a la enzima. En el estado de transición, tras la unión de ambos sustratos, se transfiere el difosfato. La enzima primero libera AMP antes de liberar el producto pirofosfato de fosforribosilado. [4] Los experimentos con agua marcada con oxígeno 18 demuestran que el mecanismo de reacción procede con el ataque nucleofílico del grupo hidroxilo anomérico de la ribosa 5-fosfato sobre el fósforo beta del ATP en una reacción SN2 . [5]

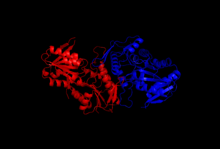
Los estudios de cristalización y difracción de rayos X dilucidaron la estructura de la enzima, que fue aislada mediante técnicas de clonación, expresión de proteínas y purificación. Una subunidad de la ribosa-fosfato difosfoquinasa consta de 318 aminoácidos; el complejo enzimático activo consta de tres homodímeros (o seis subunidades, un hexámero). La estructura de una subunidad es una lámina beta paralela de cinco cadenas (el núcleo central) rodeada por cuatro hélices alfa en el dominio N-terminal y cinco hélices alfa en el dominio C-terminal , con dos láminas beta antiparalelas cortas que se extienden desde el núcleo. [2] El sitio catalítico de la enzima se une al ATP y a la ribosa 5-fosfato. El bucle flexible (Phe92–Ser108), el bucle de unión al pirofosfato (Asp171–Gly174) y la región bandera (Val30–Ile44 de una subunidad adyacente) comprenden el sitio de unión del ATP, ubicado en la interfaz entre dos dominios de una subunidad. El bucle flexible recibe ese nombre debido a su gran variabilidad en la conformación. [6] El sitio de unión de la ribosa 5-fosfato consta de los residuos Asp220–Thr228, ubicados en el dominio C-terminal de una subunidad. [2] [6] El sitio alostérico, que se une al ADP, consta de residuos de aminoácidos de tres subunidades. [2]
El producto de esta reacción, el pirofosfato de fosforribosil (PRPP), se utiliza en numerosas vías de biosíntesis ( de novo y de rescate ). El PRPP proporciona el azúcar ribosa en la síntesis de novo de purinas y pirimidinas, utilizadas en las bases de nucleótidos que forman el ARN y el ADN . El PRPP reacciona con el orotato para formar orotidilato, que puede convertirse en uridilato (UMP). El UMP puede convertirse luego en el nucleótido trifosfato de citidina (CTP). La reacción de PRPP, glutamina y amoníaco forma 5-fosforibosil-1-amina, un precursor del inosinato (IMP), que finalmente puede convertirse en trifosfato de adenosina (ATP) o trifosfato de guanosina (GTP). El PRPP desempeña un papel en las vías de rescate de purinas al reaccionar con bases de purina libres para formar adenilato, guanilato e inosinato. [7] [8] El PRPP también se utiliza en la síntesis de NAD : la reacción del PRPP con ácido nicotínico produce el mononucleótido de ácido nicotínico intermedio. [9]
La ribosa-fosfato difosfoquinasa requiere Mg2+ para su actividad; la enzima actúa sólo sobre ATP coordinado con Mg2+. La ribosa-fosfato difosfoquinasa está regulada por fosforilación y alostérico. Es activada por fosfato e inhibida por ADP ; se sugiere que el fosfato y el ADP compiten por el mismo sitio regulador. En concentraciones normales, el fosfato activa la enzima uniéndose a su sitio regulador alostérico. Sin embargo, en concentraciones altas, se ha demostrado que el fosfato tiene un efecto inhibidor al competir con el sustrato ribosa 5-fosfato por la unión en el sitio activo. El ADP es el inhibidor alostérico clave de la ribosa-fosfato difosfoquinasa. Se ha demostrado que en concentraciones más bajas del sustrato ribosa 5-fosfato, el ADP puede inhibir la enzima de forma competitiva. La ribosa-fosfato pirofosfoquinasa también es inhibida por algunos de sus productos biosintéticos posteriores. [2] [6]
Debido a que su producto es un compuesto clave en muchas vías biosintéticas, la ribosa-fosfato difosfoquinasa está involucrada en algunos trastornos raros y enfermedades recesivas ligadas al cromosoma X. Las mutaciones que conducen a una superactividad (aumento de la actividad enzimática o desregulación de la enzima) dan como resultado una sobreproducción de purina y ácido úrico. Los síntomas de superactividad incluyen gota , pérdida auditiva neurosensorial, [10] tono muscular débil (hipotonía), coordinación muscular deteriorada (ataxia), neuropatía periférica hereditaria, [11] y trastorno del desarrollo neurológico. [12] [13] [14] Las mutaciones que conducen a la pérdida de función en la ribosa-fosfato difosfoquinasa dan como resultado la enfermedad de Charcot-Marie-Tooth y el síndrome de Arts . [15]