La deficiencia de glucosa-6-fosfato deshidrogenasa ( G6PDD ), también conocida como favismo , es la anemia por deficiencia enzimática más común en todo el mundo. [5] Es un error congénito del metabolismo que predispone a la degradación de los glóbulos rojos . [1] La mayoría de las veces, quienes se ven afectados no presentan síntomas. [3] Después de un desencadenante específico, pueden desarrollarse síntomas como piel amarillenta , orina oscura, dificultad para respirar y sensación de cansancio. [1] [2] Las complicaciones pueden incluir anemia e ictericia del recién nacido . [2] Algunas personas nunca presentan síntomas. [3]
Es un trastorno recesivo ligado al cromosoma X que da como resultado un defecto de la enzima glucosa-6-fosfato deshidrogenasa . [1] La glucosa-6-fosfato deshidrogenasa es una enzima que protege a los glóbulos rojos, que transportan oxígeno desde los pulmones a los tejidos de todo el cuerpo. Un defecto de la enzima da como resultado la descomposición prematura de los glóbulos rojos. Esta destrucción de glóbulos rojos se denomina hemólisis . [6] La descomposición de los glóbulos rojos puede ser provocada por infecciones , ciertos medicamentos, estrés o alimentos como las habas . [1] [3] Dependiendo de la mutación específica , la gravedad de la afección puede variar. [2] El diagnóstico se basa en los síntomas y está respaldado por análisis de sangre y pruebas genéticas . [2]
Las personas afectadas deben evitar los desencadenantes alimentarios, [3] en particular las habas. [7] Esto puede resultar difícil, ya que las habas pueden denominarse "alubias anchas" y se utilizan en muchos alimentos, enteras o en forma de harina. El falafel es probablemente el más conocido, pero las habas también se utilizan a menudo como relleno en albóndigas y otros alimentos. Dado que la deficiencia de G6PD no es una alergia, las reglamentaciones alimentarias de la mayoría de los países no exigen que las habas se destaquen como alérgeno en la etiqueta. [ cita requerida ]
El tratamiento de los episodios agudos puede incluir medicamentos para las infecciones, la suspensión del medicamento causante o transfusiones de sangre . [3] La ictericia en los recién nacidos puede tratarse con bilis . [2] Se recomienda que las personas se realicen una prueba de G6PDD antes de tomar ciertos medicamentos, como la primaquina . [2]
Alrededor de 400 millones de personas padecen esta enfermedad en todo el mundo. [1] Es particularmente común en ciertas partes de África, Asia, el Mediterráneo y Oriente Medio . [1] Los hombres se ven afectados con más frecuencia que las mujeres. [1] Se cree que en 2015 provocó 33.000 muertes. [4]
La mayoría de las personas con deficiencia de G6PD son asintomáticas . Cuando induce hemólisis, suele ser de corta duración. [5]
La mayoría de las personas que desarrollan síntomas son varones, debido al patrón de herencia ligado al cromosoma X , pero las mujeres portadoras pueden verse afectadas debido a una lionización desfavorable o una inactivación sesgada del cromosoma X , donde la inactivación aleatoria de un cromosoma X en ciertas células crea una población de glóbulos rojos deficientes en G6PD que coexisten con glóbulos rojos no afectados. Una mujer con un cromosoma X afectado mostrará la deficiencia en aproximadamente la mitad de sus glóbulos rojos. Sin embargo, en algunos casos, incluida la doble deficiencia del cromosoma X, la proporción puede ser mucho mayor que la mitad, lo que hace que el individuo sea casi tan sensible como los hombres. [ cita requerida ]
La degradación de los glóbulos rojos (también conocida como hemólisis ) en la deficiencia de G6PD puede manifestarse de varias maneras, incluidas las siguientes: [ cita requerida ]
El favismo es una respuesta hemolítica al consumo de habas, también conocidas como frijoles anchos. Aunque todas las personas con favismo muestran deficiencia de G6PD, no todas las personas con deficiencia de G6PD presentan favismo. Se sabe que la afección es más frecuente en bebés y niños, y la variante genética de G6PD puede influir en la sensibilidad química. [8] Aparte de esto, los detalles de la relación química entre el favismo y la G6PD no se comprenden bien. [ cita requerida ]
La deficiencia de G6PD es resultado de mutaciones en el gen G6PD. El gen G6PD contribuye a la producción de glucosa-6-fosfato deshidrogenasa . Las reacciones químicas que involucran a la glucosa-6-fosfato deshidrogenasa producen compuestos que evitan que las especies reactivas de oxígeno se acumulen hasta niveles tóxicos dentro de los glóbulos rojos. Si se produce una reducción en la cantidad de glucosa-6-fosfato deshidrogenasa o una alteración de la estructura debido a las mutaciones del gen G6PD, la enzima pierde su función protectora y conduce a la acumulación de especies reactivas de oxígeno y, por lo tanto, al daño de los glóbulos rojos. [6]
Los portadores de la mutación subyacente no muestran ningún síntoma a menos que sus glóbulos rojos estén expuestos a ciertos desencadenantes, que pueden ser de cuatro tipos principales:
Muchas sustancias son potencialmente dañinas para las personas con deficiencia de G6PD. La variación en la respuesta a estas sustancias dificulta las predicciones individuales. Los medicamentos antipalúdicos que pueden causar hemólisis aguda en personas con deficiencia de G6PD incluyen primaquina , pamaquina , cloroquina e hidroxicloroquina . [11] Existe evidencia de que otros antipalúdicos también pueden exacerbar la deficiencia de G6PD, pero solo en dosis más altas. Las personas con deficiencia de G6PD también deben evitar las sulfonamidas (como sulfanilamida , sulfametoxazol y mafenida ), tiazolesulfona, azul de metileno y naftaleno , ya que antagonizan la síntesis de folato, al igual que ciertos analgésicos (como fenazopiridina y acetanilida ) y algunos antibióticos no sulfamidas ( ácido nalidíxico , nitrofurantoína , isoniazida , dapsona y furazolidona ). [12] [13] [14] Se sabe que la henna causa crisis hemolítica en lactantes con deficiencia de G6PD. [15] La rasburicasa también está contraindicada en la deficiencia de G6PD. También se sabe que la vitamina C intravenosa en dosis altas causa hemólisis en portadores de deficiencia de G6PD; [16] [17] por lo tanto, la prueba de deficiencia de G6PD es de rutina antes de la infusión de dosis de 25 g o más.
Dos variantes (G6PD A− y G6PD Mediterranean) son las más comunes en las poblaciones humanas. G6PD A− tiene una incidencia del 10% de africanos y afroamericanos mientras que G6PD Mediterranean es prevalente en el Medio Oriente. La distribución conocida del alelo mutado se limita en gran medida a personas de origen mediterráneo (españoles, italianos, griegos, armenios, judíos sefardíes y otros pueblos semíticos). [18] Se cree que ambas variantes se derivan de un fuerte efecto protector contra la malaria por Plasmodium falciparum y Plasmodium vivax . [19] Es particularmente frecuente en la población judía kurda , donde aproximadamente 1 de cada 2 hombres tiene la enfermedad y la misma tasa de mujeres son portadoras. [10] También es común en hombres afroamericanos , saudíes , sardos , algunas poblaciones africanas y grupos asiáticos. [10]
Todas las mutaciones que causan deficiencia de G6PD se encuentran en el brazo largo del cromosoma X , en la banda Xq28. El gen G6PD abarca unas 18,5 kilobases . [13] Las siguientes variantes y mutaciones son bien conocidas y están descritas:
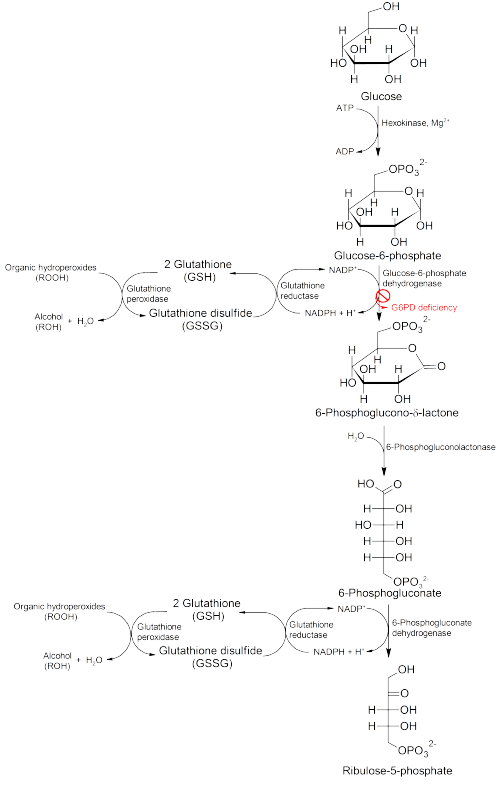
La glucosa-6-fosfato deshidrogenasa (G6PD) es una enzima de la vía de las pentosas fosfato (véase la imagen, también conocida como vía de derivación HMP). La G6PD convierte la glucosa-6-fosfato en 6-fosfoglucono-δ-lactona y es la enzima limitante de la velocidad de esta vía metabólica que suministra energía reductora a las células al mantener el nivel de la forma reducida de la coenzima nicotinamida adenina dinucleótido fosfato (NADPH). El NADPH mantiene el suministro de glutatión reducido en las células que se utiliza para eliminar los radicales libres que causan daño oxidativo . La vía también estimula la catalasa, una enzima antioxidante. [20]
La vía G6PD/NADPH es la única fuente de glutatión reducido en los glóbulos rojos ( eritrocitos ). El papel de los glóbulos rojos como transportadores de oxígeno los expone a un riesgo sustancial de sufrir daños por la oxidación de radicales libres, excepto por el efecto protector de G6PD/NADPH/glutatión. [20]
Por lo tanto, las personas con deficiencia de G6PD corren el riesgo de sufrir anemia hemolítica en estados de estrés oxidativo . El estrés oxidativo puede ser resultado de una infección y de la exposición química a medicamentos y ciertos alimentos. Las habas, por ejemplo, contienen altos niveles de vicina , divicina , convicina e isouramil , todos los cuales crean oxidantes . [21]
Cuando se consume todo el glutatión reducido restante, los oxidantes dañan posteriormente las enzimas y otras proteínas (incluida la hemoglobina ), lo que provoca enlaces cruzados y la deposición de proteínas en las membranas de los glóbulos rojos . Los glóbulos rojos dañados son fagocitados y secuestrados (retirados de la circulación) en el bazo . La hemoglobina se metaboliza a bilirrubina (causando ictericia en altas concentraciones). Los glóbulos rojos rara vez se desintegran en la circulación, por lo que la hemoglobina rara vez se excreta directamente por el riñón , pero esto puede ocurrir en casos graves, causando una lesión renal aguda . [ cita requerida ]
La deficiencia de G6PD en la vía alternativa provoca la acumulación de glucosa y, por lo tanto, un aumento de los productos finales de la glucosilación avanzada (AGE). La deficiencia también reduce la cantidad de NADPH, que es necesaria para la formación de óxido nítrico (NO). La alta prevalencia de diabetes mellitus tipo 2 e hipertensión en los afrocaribeños de Occidente podría estar directamente relacionada con la incidencia de la deficiencia de G6PD en esas poblaciones. [22]
Aunque las mujeres portadoras pueden tener una forma leve de deficiencia de G6PD (dependiendo del grado de inactivación del cromosoma X no afectado – ver Inactivación sesgada del cromosoma X ), se han descrito mujeres homocigotas; en estas mujeres existe una coincidencia de un trastorno inmunológico raro denominado enfermedad granulomatosa crónica (EGC). [ cita requerida ]
El diagnóstico generalmente se sospecha cuando pacientes de ciertos grupos étnicos (ver epidemiología) desarrollan anemia , ictericia y síntomas de hemólisis después de los desafíos de cualquiera de las causas anteriores, especialmente cuando hay antecedentes familiares positivos. [23]
Generalmente, las pruebas incluirán: [ cita requerida ]
Cuando existen suficientes motivos para sospechar la presencia de G6PD, una prueba directa para detectar la presencia de G6PD es la « prueba de la mancha fluorescente de Beutler », que ha sustituido en gran medida a una prueba más antigua (la prueba de decoloración con tinte de Motulsky). Otras posibilidades son la prueba directa del ADN y/o la secuenciación del gen de la G6PD. [24]
La prueba de la mancha fluorescente de Beutler es una prueba rápida y económica que identifica visualmente el NADPH producido por la G6PD bajo luz ultravioleta . Cuando la mancha de sangre no emite fluorescencia, la prueba es positiva; puede ser falsamente negativa en pacientes que están en proceso de hemólisis activa. Por lo tanto, solo se puede realizar 2 o 3 semanas después de un episodio hemolítico. [23]
Cuando un macrófago del bazo identifica un glóbulo rojo con un cuerpo de Heinz, elimina el precipitado y un pequeño trozo de la membrana, lo que da lugar a las características " células de mordida ". Sin embargo, si se produce una gran cantidad de cuerpos de Heinz, como en el caso de la deficiencia de G6PD, algunos cuerpos de Heinz serán visibles al observar los glóbulos rojos que se han teñido con violeta de cristal. Esta prueba fácil y económica puede llevar a una presunción inicial de deficiencia de G6PD, que puede confirmarse con las otras pruebas. [ cita requerida ]
La realización de pruebas durante y durante muchas semanas después de un episodio hemolítico dará lugar a resultados falsos negativos, ya que los glóbulos rojos deficientes en G6PD se habrán excretado y los glóbulos rojos jóvenes (reticulocitos) aún no tendrán deficiencia de G6PD. También es probable que se obtengan resultados falsos negativos después de cualquier transfusión de sangre. Por este motivo, muchos hospitales esperan 3 meses después de un episodio hemolítico antes de realizar pruebas de deficiencia de G6PD. Las mujeres deben medir su actividad de G6PD mediante un ensayo cuantitativo para evitar que las clasifiquen erróneamente en las pruebas de detección. [23]
La Organización Mundial de la Salud clasifica las variantes genéticas de G6PD en cinco clases, las primeras tres de las cuales son estados de deficiencia. [25]
La deficiencia de 6-fosfogluconato deshidrogenasa (6PGD) tiene síntomas similares y a menudo se confunde con la deficiencia de G6PD, ya que la enzima afectada está dentro de la misma vía; sin embargo, estas enfermedades no están relacionadas y pueden encontrarse en la misma persona. [ cita requerida ]
La medida más importante es la prevención: evitar los medicamentos y alimentos que causan hemólisis. La vacunación contra algunos patógenos comunes (por ejemplo, la hepatitis A y la hepatitis B ) puede prevenir los ataques inducidos por la infección. [26]
En la fase aguda de la hemólisis, pueden ser necesarias transfusiones de sangre o incluso diálisis en caso de insuficiencia renal aguda . La transfusión de sangre es una medida sintomática importante, ya que los glóbulos rojos transfundidos generalmente no presentan deficiencia de G6PD y vivirán una vida normal en la circulación del receptor. Los afectados deben evitar medicamentos como la aspirina . [ cita requerida ]
Algunos pacientes pueden beneficiarse de la extirpación del bazo ( esplenectomía ), [27] ya que se trata de un sitio importante de destrucción de glóbulos rojos. El ácido fólico debe utilizarse en cualquier trastorno que presente una alta renovación de glóbulos rojos. Aunque la vitamina E y el selenio tienen propiedades antioxidantes, su uso no disminuye la gravedad de la deficiencia de G6PD. [ cita requerida ]
Se ha demostrado que AG1, una pequeña molécula descubierta recientemente, aumenta la actividad de la enzima G6PD en las tres variantes comunes de la deficiencia. Debido a la ausencia de medicamentos para tratar la G6PD, AG1 es un precursor prometedor en el desarrollo de un tratamiento farmacológico eficaz para múltiples enzimopatías de G6PD. [28]
Las personas con deficiencia de G6PD no parecen contraer enfermedades con mayor frecuencia que otras personas, y pueden tener menos riesgo que otras personas de contraer cardiopatía isquémica y enfermedad cerebrovascular . [29] Sin embargo, un estudio reciente reveló que la deficiencia de G6PD aumenta el riesgo cardiovascular hasta en un 70%. El riesgo conferido por la deficiencia de G6PD es moderado en comparación con el impacto de los factores de riesgo cardiovascular primarios. [30] Además, una revisión publicada planteó la hipótesis de que la deficiencia de G6PD podría reducir la eficacia antiplaquetaria del clopidogrel (resistencia al clopidogrel). [31]
La deficiencia de G6PD es el segundo defecto enzimático humano más común después de la deficiencia de ALDH2 , estando presente en más de 400 millones de personas en todo el mundo. [32] La deficiencia de G6PD resultó en 4.100 muertes en 2013 y 3.400 muertes en 1990. [33] La cuenca mediterránea es donde el favismo es más común, especialmente entre los kurdos , sardos , chipriotas , griegos , egipcios y algunas poblaciones africanas, incluyendo aquellos que tienen estas ascendencias. [34] [35] [36] El favismo también ha sido documentado fuera de la cuenca mediterránea, en otras naciones de Oriente Medio y Asia Oriental como Irak, Irán, Bulgaria y China. Cerdeña tiene la frecuencia más alta reportada de favismo, con cinco casos por cada 1.000 personas. [34]
Un efecto secundario de esta enfermedad es que confiere protección contra la malaria , [37] en particular la forma de malaria causada por Plasmodium falciparum , la forma más mortal de malaria. Existe una relación similar entre la malaria y la anemia falciforme . Una teoría para explicar esto es que las células infectadas con el parásito Plasmodium son eliminadas más rápidamente por el bazo . Este fenómeno podría dar a los portadores de deficiencia de G6PD una ventaja evolutiva al aumentar su aptitud en entornos endémicos de malaria. Estudios in vitro han demostrado que el Plasmodium falciparum es muy sensible al daño oxidativo. Esta es la base de otra teoría, que es que el defecto genético confiere resistencia debido al hecho de que el huésped deficiente en G6PD tiene un nivel más alto de agentes oxidativos que, aunque generalmente tolerables por el huésped, son mortales para el parásito. [38]
La comprensión moderna de la condición comenzó con el análisis de pacientes que mostraron sensibilidad a la primaquina . [39] El descubrimiento de la deficiencia de G6PD se basó en gran medida en las pruebas de voluntarios prisioneros en la Penitenciaría Estatal de Illinois , un tipo de estudio que hoy en día se considera poco ético y no se puede realizar. Cuando a algunos prisioneros se les administró el medicamento primaquina, algunos desarrollaron anemia hemolítica , pero otros no. A pesar de estos resultados, el ejército estadounidense administró el medicamento ampliamente durante la Guerra de Corea para prevenir la infección recurrente causada por hipnozoitos de Plasmodium vivax . Se observaron numerosos casos de anemia hemolítica en soldados estadounidenses de ascendencia norteafricana y mediterránea. [40]
Después de estudiar el mecanismo a través de la prueba Cr 51 , se demostró de manera concluyente que el efecto hemolítico de la primaquina se debía a un defecto intrínseco de los eritrocitos. [41]
Tanto en la leyenda como en la mitología, el favismo se conoce desde la antigüedad. A los sacerdotes de varios cultos de la era grecorromana se les prohibía comer o incluso mencionar las legumbres, y Pitágoras tenía una regla estricta según la cual para unirse a la sociedad de los pitagóricos uno tenía que renunciar a las legumbres. [42] Esta prohibición se debía supuestamente a que las legumbres se parecían a los genitales masculinos, pero es posible que esto se debiera a la creencia de que las legumbres y los humanos fueron creados del mismo material. [43]