El cloruro de fosforilo (comúnmente llamado oxicloruro de fósforo ) es un líquido incoloro con la fórmula P O Cl 3 . Se hidroliza en aire húmedo liberando ácido fosfórico y humos de cloruro de hidrógeno . Se fabrica industrialmente a gran escala a partir de tricloruro de fósforo y oxígeno o pentóxido de fósforo . [4] Se utiliza principalmente para hacer ésteres de fosfato .

Al igual que el fosfato, el POCl 3 tiene forma tetraédrica. [6] Presenta tres enlaces P−Cl y un fuerte enlace P–O, con una energía de disociación de enlace estimada de 533,5 kJ/mol. A diferencia del caso del POF 3 , la regla de Schomaker-Stevenson predice la longitud de enlace apropiada para el enlace P–O solo si el enlace P–O se trata como un enlace doble, P=O. [ cita requerida ] Los tratamientos más modernos explican el enlace P–O apretado como una combinación de transferencia de pares solitarios del átomo de fósforo al átomo de oxígeno y un enlace posterior dativo π que produce una configuración [P + ]-[O − ] efectiva . [7]
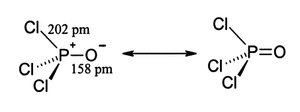
El cloruro de fosforilo existe como moléculas neutras de POCl 3 en los estados sólido , líquido y gaseoso. Esto es diferente del pentacloruro de fósforo que existe como moléculas neutras de PCl 5 en los estados gaseoso y líquido pero adopta la forma iónica [PCl 4 ] + [PCl 6 ] − (hexaclorofosfato de tetraclorofosfonio (V)) en el estado sólido. Las longitudes de enlace promedio en la estructura cristalina de POCl 3 son 1,98 Å para P–Cl y 1,46 Å para P=O. [5]
Tiene una presión crítica de 3,4 atm . [8] Con un punto de congelación de 1 °C y un punto de ebullición de 106 °C, el rango líquido de POCl 3 es bastante similar al agua. También como el agua, POCl 3 se autoioniza , debido a la formación reversible de cationes [POCl 2 ] + (cationes diclorooxofosfonio) y aniones Cl − .
El POCl3 reacciona con agua para producir cloruro de hidrógeno y ácido fosfórico :
Se han aislado intermediarios en la conversión, incluido el cloruro de pirofosforilo , O(−P(=O)Cl 2 ) 2 . [9]
Tras el tratamiento con exceso de alcoholes y fenoles , el POCl3 produce ésteres de fosfato :
Estas reacciones a menudo se realizan en presencia de un aceptor de HCl como la piridina o una amina .
El POCl3 también puede actuar como una base de Lewis , formando aductos con una variedad de ácidos de Lewis como el tetracloruro de titanio :
El aducto de cloruro de aluminio ( POCl 3 ·AlCl 3 ) es bastante estable, por lo que el POCl 3 se puede utilizar para eliminar AlCl 3 de las mezclas de reacción, por ejemplo al final de una reacción de Friedel-Crafts .
El POCl3 reacciona con bromuro de hidrógeno en presencia de catalizadores ácidos de Lewis para producir POBr3 .
El cloruro de fosforilo se puede preparar mediante muchos métodos. El químico francés Adolphe Wurtz lo describió por primera vez en 1847 al hacer reaccionar pentacloruro de fósforo con agua. [10]
El método comercial implica la oxidación del tricloruro de fósforo con oxígeno : [11]
Un método alternativo implica la oxidación del tricloruro de fósforo con clorato de potasio : [12]
La reacción del pentacloruro de fósforo ( PCl 5 ) con el pentóxido de fósforo ( P 4 O 10 ).
La reacción se puede simplificar clorando una mezcla de PCl3 y P4O10 , generando PCl5 in situ. La reacción del pentacloruro de fósforo con ácido bórico o ácido oxálico : [ 12 ]
Reducción de fosfato tricálcico con carbón en presencia de gas cloro : [13]
También se informa sobre la reacción del pentóxido de fósforo con cloruro de sodio : [13]
El cloruro de fosforilo se utiliza a escala industrial para la fabricación de ésteres de fosfato (organofosfatos). Estos tienen una amplia gama de usos, incluidos como retardantes de llama ( fosfato de difenilo de bisfenol A , TCPP y fosfato de tricresilo ), plastificantes para PVC y polímeros relacionados ( fosfato de difenilo de 2-etilhexilo ) y fluidos hidráulicos. [11] El POCl3 también se utiliza en la producción de insecticidas organofosforados.
En la industria de semiconductores, el POCl3 se utiliza como fuente segura de fósforo líquido en procesos de difusión. El fósforo actúa como dopante para crear capas de tipo n sobre una oblea de silicio.
En el laboratorio, el POCl3 es un reactivo en las deshidrataciones. Un ejemplo es la conversión de formamidas en isonitrilos (isocianuros); [14] amidas primarias en nitrilos : [15]
En una reacción relacionada, ciertas amidas sustituidas con arilo pueden ciclarse utilizando la reacción de Bischler-Napieralski .
Se cree que estas reacciones se producen a través de un cloruro de imidoilo . En ciertos casos, el cloruro de imidoilo es el producto final. Por ejemplo, las piridonas y las pirimidonas se pueden convertir en derivados clorados como las 2-cloropiridinas y las 2-cloropirimidinas, que son intermediarios en la industria farmacéutica. [16]
En la reacción de Vilsmeier-Haack , el POCl3 reacciona con amidas para producir un "reactivo de Vilsmeier", una sal de cloroiminio , que posteriormente reacciona con compuestos aromáticos ricos en electrones para producir aldehídos aromáticos tras un tratamiento acuoso. [17]
{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: otros ( enlace )