La oripavina es un opioide y el principal metabolito de la tebaína . Es el compuesto original del que se derivan una serie de opioides semisintéticos , que incluyen los compuestos etorfina y buprenorfina . Aunque su potencia analgésica es comparable a la de la morfina , no se utiliza clínicamente debido a su grave toxicidad y bajo índice terapéutico . Debido a su uso en la fabricación de opioides fuertes, la oripavina es una sustancia controlada en algunas jurisdicciones.
La oripavina posee una potencia analgésica comparable a la morfina; sin embargo, no es clínicamente útil debido a su toxicidad severa y su bajo índice terapéutico . Tanto en ratones como en ratas , las dosis tóxicas causaron convulsiones tónico-clónicas seguidas de muerte, similares a las de la tebaína . [1] La oripavina tiene un potencial de dependencia que es significativamente mayor que el de la tebaína, pero ligeramente menor que el de la morfina . [2]
De mucha mayor relevancia son las propiedades de los orvinoles, una gran familia de derivados semisintéticos de la oripavina sintetizados clásicamente mediante la reacción de Diels-Alder de la tebaína con un dienófilo apropiado seguida de una 3- O -desmetilación para obtener la oripavina puenteada correspondiente. Estos compuestos fueron desarrollados por el grupo dirigido por KW Bentley en la década de 1960, y estos compuestos de Bentley representan la primera serie de agonistas μ-opioides "superpotentes" , con algunos compuestos de la serie que son más de 10.000 veces más potentes que la morfina como analgésico. [3] [4] [5] El compuesto parental de la oripavina puenteada simple 6,14-endoetenotetrahidrooripavina ya es 40 veces más potente que la morfina, [6] pero al agregar un sustituyente de alcohol terciario ramificado en la posición C7 se obtiene una amplia gama de compuestos altamente potentes. [7]
Otros derivados notables resultan de una mayor modificación de esta plantilla, con la saturación del doble enlace 7,8 de la etorfina dando como resultado la aún más potente dihidroetorfina (hasta 12.000 veces la potencia de la morfina) y la acetilación del grupo 3-hidroxi de la etorfina dando como resultado la acetorfina (8700 veces la morfina), aunque mientras que el homólogo isopentilo de la etorfina es casi tres veces más potente, sus derivados 7,8-dihidro y 3-acetilo son menos potentes que los derivados correspondientes de la etorfina en 11.000 y 1300 veces la morfina, respectivamente. Reemplazar el grupo N -metilo por ciclopropilmetilo da como resultado antagonistas opioides como la diprenorfina (M5050, que se utiliza como antídoto para revertir los efectos de la etorfina, M99), y agonistas parciales como la buprenorfina , que se utiliza ampliamente en el tratamiento de la adicción a los opioides .
Debido a la relativa facilidad de modificación sintética de la oripavina para producir otros narcóticos (ya sea por vía directa o indirecta a través de la tebaína ), el Comité de Expertos en Farmacodependencia de la Organización Mundial de la Salud recomendó en 2003 que la oripavina se controlara en la Lista I de la Convención Única de 1961 sobre Estupefacientes . [8] El 14 de marzo de 2007, la Comisión de Estupefacientes de las Naciones Unidas decidió formalmente aceptar estas recomendaciones y colocó la oripavina en la Lista I. [9]
Hasta hace poco, la oripavina era una droga de la Lista II en los Estados Unidos por defecto como derivado de la tebaína , aunque no figuraba explícitamente en la lista. Sin embargo, como estado miembro de la Convención Única de 1961 sobre Estupefacientes , los EE. UU. estaban obligados a controlar específicamente la sustancia en virtud de la Ley de Sustancias Controladas tras su control internacional por parte de la Comisión de Estupefacientes de las Naciones Unidas. El 24 de septiembre de 2007, la DEA añadió formalmente la oripavina a la Lista II. [10]
Según la Ley de Sustancias Controladas de 1970, la oripavina tiene un ACSCN de 9330 y una cuota de fabricación para 2013 de 22 750 kg (50 160 lb).
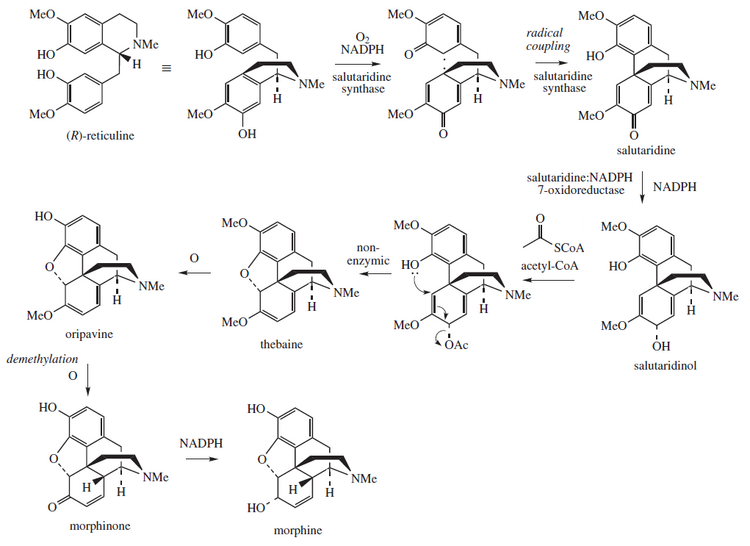
Esta molécula está relacionada biosintéticamente con el metabolismo de los derivados del morfinano , donde están implicadas la tebaína y la morfina . [11]