
Los ovillos neurofibrilares ( NFT ) son agregados intracelulares de proteína tau hiperfosforilada que se conocen comúnmente como un biomarcador primario de la enfermedad de Alzheimer . Su presencia también se encuentra en muchas otras enfermedades conocidas como tauopatías . Se sabe poco sobre su relación exacta con las diferentes patologías.
Los ovillos neurofibrilares se forman por hiperfosforilación de una proteína asociada a los microtúbulos conocida como tau , lo que hace que se agregue o agrupe en una forma insoluble. (Estas agregaciones de proteína tau hiperfosforilada también se conocen como PHF o " filamentos helicoidales apareados "). El mecanismo preciso de formación de ovillos no se entiende por completo, aunque generalmente se reconoce que los ovillos son un factor causal primario en la enfermedad neurodegenerativa. [1] [2]
Se han definido tres estados de maduración diferentes de NFT utilizando inmunotinción anti-tau y anti- ubiquitina . En la etapa 0 hay células piramidales morfológicamente normales que muestran una tinción citoplasmática difusa o granular fina con anti-tau. En otras palabras, las células están sanas con una presencia mínima de tau; en la etapa 1 algunas inclusiones alargadas delicadas se tiñen con anticuerpos tau (estos son ovillos tempranos); la etapa 2 está representada por la demostración clásica de NFT con tinción anti-tau; la etapa 3 está ejemplificada por ovillos fantasma (ovillos fuera de las células donde la neurona huésped ha muerto), que se caracterizan por una inmunotinción anti-tau reducida pero marcada anti-ubiquitina. [3]
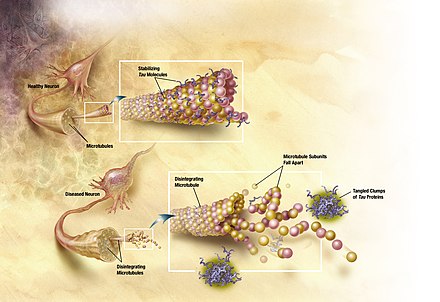
La idea tradicional es que la proteína tau se une a los microtúbulos y ayuda a su autoensamblaje, formación y estabilización. Sin embargo, cuando la proteína tau está hiperfosforilada, no puede unirse y los microtúbulos se vuelven inestables y comienzan a desintegrarse. La proteína tau no unida se agrupa en formaciones llamadas ovillos neurofibrilares. [4] De manera más explícita, las lesiones intracelulares conocidas como preovillos se desarrollan cuando la proteína tau se fosforila en exceso y en residuos de aminoácidos inadecuados . Estas lesiones, con el tiempo, se convierten en ovillos neurofibrilares interneuronales filamentosos (NFT) que interfieren con numerosas funciones intracelulares. En busca de un modelo animal confiable para las patologías relacionadas con la proteína tau, los investigadores expresaron el gen tau mutante humano P301L en ratones adultos. Este experimento resultó en la formación de ovillos neurofibrilares y formaciones de preovillos. [5] El gen tau mutante humano P301 está asociado con la demencia frontotemporal con parkinsonismo, otra tauopatía asociada con los NFT. Se encontró que el grado de patología tau dependía del tiempo y del nivel de expresión génica. [6] Los grupos que recibieron una combinación de un promotor y potenciador en el vector experimentaron un aumento de la expresión de tau, tan pronto como 3 semanas después de la inyección del vector, que se midió utilizando un Western blot . [6] Estos grupos también mostraron una mayor patología en comparación con aquellos con menor expresión del tau mutante. Además, los NFT se detectaron claramente mediante microscopía inmunoelectrónica a los 4 meses, pero no a los 2 meses. Sin embargo, tanto a los 2 como a los 4 meses, se observaron estructuras similares a preenredos, lo que sugiere que la formación de NFT no está completa a los 4 meses y continuará progresando con el tiempo. [6]
Las investigaciones preliminares indican que los depósitos de hierro debido a hemorragias , después de una lesión cerebral traumática (LCT), pueden aumentar la patología tau . Si bien la LCT no conduce rutinariamente a la formación acelerada de NFT, trabajos adicionales pueden determinar si otros componentes sanguíneos o factores no relacionados con las hemorragias están involucrados en este aumento de la patología tau inducido por la LCT. [7] Las NFT se observan más comúnmente asociadas con LCT leves repetitivos en lugar de una instancia de lesión cerebral traumática grave. [8] Por ejemplo, la enfermedad neurodegenerativa encefalopatía traumática crónica (ETC), anteriormente llamada demencia pugilística , está altamente asociada con NFT y filamentos neuropilos .
La idea de que existe un vínculo entre la exposición al aluminio y la formación de ovillos neurofibrilares ha estado circulando en la comunidad científica durante algún tiempo sin que se haya demostrado o descartado definitivamente. Recientemente, un estudio que examinó las células CA1 del hipocampo de individuos con y sin enfermedad de Alzheimer mostró que una pequeña porción de las células piramidales contienen depósitos citoplasmáticos dentro de sus somas que contienen NFT tempranos. Estos depósitos citoplasmáticos son agregados de un complejo de aluminio/tau hiperfosforilada similar a los NFT maduros. (Walton) [ especificar ] Si bien se mantiene una conexión entre el aluminio y los NFT y la EA, hay evidencia de que el aluminio no causa directamente la formación de NFT o EA. [9] Sin embargo, se afirma que la ingesta crónica de aluminio puede causar Alzheimer al alterar los microtúbulos en los filamentos. [10] [11]
Se ha demostrado que el grado de deterioro cognitivo en enfermedades como la EA se correlaciona significativamente con la presencia de ovillos neurofibrilares. [12]
Tradicionalmente se ha creído que los NFT desempeñan un papel importante en la pérdida de neuronas; son un evento temprano en patologías como la enfermedad de Alzheimer, y cuanto más NFT se forman, hay una pérdida de neuronas sustancialmente mayor. Sin embargo, se ha demostrado que hay una pérdida significativa de neuronas antes de la formación de ovillos neurofibrilares, y que los NFT representan solo una pequeña proporción (alrededor del 8,1 %) de esta pérdida de neuronas. [13] Junto con la longevidad de las neuronas que contienen NFT, es probable que algún otro factor sea el principal responsable de la mayor parte de la pérdida de neuronas en estas enfermedades, no la formación de ovillos neurofibrilares.
Actualmente no está claro si la tauopatía primaria relacionada con la edad (PART), un término que incluye algunos casos anteriormente denominados demencia con predominio de ovillos neurofibrilares (NFTPD) o demencia con solo ovillos, es una variante de la enfermedad de Alzheimer tradicional o una entidad distinta. Caracterizada por un inicio más tardío y un deterioro cognitivo más leve, la distribución de la patología NFT está más estrechamente relacionada con la que se encuentra en los centenarios que no muestran deterioro cognitivo o que este es limitado. Las NFT generalmente se limitan a las regiones alocorticales / límbicas del cerebro con una progresión limitada al neocórtex pero una mayor densidad en la región alocortical/hipocampal. Las placas generalmente están ausentes. [14] [15]
El grado de afectación del NFT en la EA se define mediante la estadificación de Braak . Las etapas I y II de Braak se utilizan cuando la afectación del NFT se limita principalmente a la región transentorrinal del cerebro. Las etapas III y IV están indicadas cuando hay afectación de regiones límbicas como el hipocampo, y V y VI cuando hay afectación neocortical extensa. Esto no debe confundirse con el grado de afectación de la placa senil , que progresa de forma diferente. [16]
Los puntajes de ovillos neurofibrilares y Braak modificados fueron más bajos en EA+DLB, sin embargo, los puntajes de NFT neocorticales muestran patrones marcadamente diferentes entre EA+DLB y Alzheimer clásico. En EA pura, los NFT se encuentran predominantemente en una frecuencia alta: En EA+DLB, se encontró que la distribución de la frecuencia de NFT era bimodal: los NFT eran frecuentes o pocos o ausentes. Además, la frecuencia de NFT neocortical en el grupo EA+DLB tendió a ser paralela a la gravedad de otros tipos de citopatología tau . [17]
Un estudio reciente buscó la correlación entre los aspectos cuantitativos de la enfermedad de Alzheimer (pérdida de neuronas, placa neurítica y carga de ovillos neurofibrilares) y la agresión que se encuentra con frecuencia en los pacientes de Alzheimer. Se descubrió que solo un aumento en la carga de ovillos neurofibrilares se asociaba con la gravedad de la agresión y la agresión crónica en los pacientes de Alzheimer. [18] Si bien este estudio indica una correlación entre la carga de ovillos neurofibrilares y la gravedad de la agresión, no proporciona un argumento causal .
Las investigaciones también han indicado que los pacientes con EA y depresión comórbida muestran niveles más altos de formación de ovillos neurofibrilares que los individuos con EA pero sin depresión. [19] La depresión comórbida aumentó las probabilidades de una etapa avanzada de la enfermedad neuropatológica incluso cuando se controló la edad, el género, la educación y la función cognitiva. [19]

Se ha demostrado que las estatinas reducen la carga de ovillos neurofibrilares en modelos de ratón, probablemente debido a sus capacidades antiinflamatorias . [20]
La quinasa dependiente de ciclina 5 (CDK5) es una quinasa que se ha planteado anteriormente como una contribución a las patologías de tau. El silenciamiento mediado por interferencia de ARN (RNAi) del gen CDK5 se ha propuesto como una nueva estrategia terapéutica contra la patología de tau, como los ovillos neurofibrilares. Se ha demostrado que la inactivación de CDK5 reduce la fosforilación de tau en cultivos neuronales primarios y en modelos de ratón. Además, este silenciamiento mostró una reducción drástica en el número de ovillos neurofibrilares. Sin embargo, en enfermedades como la enfermedad de Alzheimer , solo alrededor del 1% es hereditaria y, por lo tanto, la terapia con RNAi puede ser inadecuada para abordar las necesidades de la mayoría de quienes padecen esta enfermedad. [21]
Se ha demostrado que el litio disminuye la fosforilación de tau. [22] Se ha demostrado que el tratamiento con litio reduce la densidad de ovillos neurofibrilares en modelos transgénicos en el hipocampo y la médula espinal . A pesar de la disminución de la densidad de ovillos neurofibrilares, no se observó una mejora de los déficits motores y de memoria después del tratamiento. Además, no se han observado efectos preventivos en pacientes sometidos a tratamiento con litio. [22]
Se ha demostrado que la curcumina (como Longvida) reduce el déficit de memoria y los monómeros tau en modelos animales, sin embargo ningún ensayo clínico ha demostrado que la curcumina elimine la tau del cerebro. [23]
{{cite book}}: |journal=ignorado ( ayuda ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )