El desarrollo del sistema nervioso en los seres humanos, o desarrollo neuronal, o neurodesarrollo , involucra los estudios de embriología , biología del desarrollo y neurociencia . Estos describen los mecanismos celulares y moleculares por los cuales el complejo sistema nervioso se forma en los seres humanos, se desarrolla durante el desarrollo prenatal y continúa desarrollándose después del nacimiento.
Algunos hitos del desarrollo neuronal en el embrión incluyen:
Por lo general, estos procesos de desarrollo neurológico se pueden dividir en dos clases:
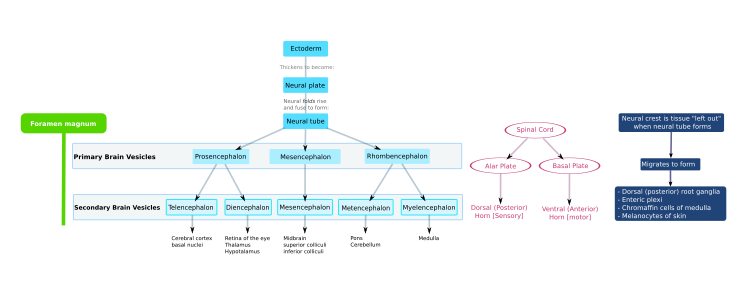
El sistema nervioso central (SNC) se deriva del ectodermo , la capa de tejido más externa del embrión. En la tercera semana del desarrollo embrionario humano aparece el neuroectodermo y forma la placa neural a lo largo del lado dorsal del embrión. La placa neural es la fuente de la mayoría de las neuronas y células gliales del SNC. Se forma un surco a lo largo del eje largo de la placa neural y, en la cuarta semana de desarrollo, la placa neural se envuelve sobre sí misma para dar lugar al tubo neural , que está lleno de líquido cefalorraquídeo (LCR). [1] A medida que el embrión se desarrolla, la parte anterior del tubo neural forma tres vesículas cerebrales primarias , que se convierten en las regiones anatómicas primarias del cerebro: el prosencéfalo ( prosencéfalo ), el mesencéfalo ( mesencéfalo ) y el rombencéfalo ( rombencéfalo ). [2] Estas vesículas simples y tempranas se agrandan y se dividen aún más en las cinco vesículas cerebrales secundarias : el telencéfalo (futura corteza cerebral y ganglios basales ), el diencéfalo (futuro tálamo e hipotálamo ), el mesencéfalo (futuro colículo ), el metencéfalo (futura protuberancia y cerebelo ) y el mielencéfalo (futura médula ). [3] La cámara central llena de LCR es continua desde el telencéfalo hasta la médula espinal y constituye el sistema ventricular en desarrollo del SNC. Debido a que el tubo neural da origen al cerebro y la médula espinal, cualquier mutación en esta etapa del desarrollo puede conducir a deformidades fatales como la anencefalia o discapacidades de por vida como la espina bífida . Durante este tiempo, las paredes del tubo neural contienen células madre neurales , que impulsan el crecimiento del cerebro a medida que se dividen muchas veces. Gradualmente, algunas de las células dejan de dividirse y se diferencian en neuronas y células gliales , que son los principales componentes celulares del SNC. [2] Las neuronas recién generadas migran a diferentes partes del cerebro en desarrollo para autoorganizarse en diferentes estructuras cerebrales. Una vez que las neuronas han alcanzado sus posiciones regionales, extienden axones .y dendritas , que les permiten comunicarse con otras neuronas a través de sinapsis . La comunicación sináptica entre neuronas conduce al establecimiento de circuitos neuronales funcionales que median el procesamiento sensorial y motor, y subyacen al comportamiento. [4]
Durante el desarrollo embrionario temprano , el ectodermo se especifica para dar lugar a la epidermis (piel) y la placa neural. La conversión del ectodermo indiferenciado en neuroectodermo requiere señales del mesodermo . Al inicio de la gastrulación, las presuntas células mesodérmicas se mueven a través del labio dorsal del blastoporo y forman una capa entre el endodermo y el ectodermo. Estas células mesodérmicas que migran a lo largo de la línea media dorsal dan lugar a una estructura llamada notocorda . Las células ectodérmicas que recubren la notocorda se desarrollan en la placa neural en respuesta a una señal difusible producida por la notocorda. El resto del ectodermo da lugar a la epidermis (piel). La capacidad del mesodermo para convertir el ectodermo suprayacente en tejido neural se denomina inducción neural.
La placa neural se pliega hacia afuera durante la tercera semana de gestación para formar el surco neural . A partir de la futura región del cuello, los pliegues neurales de este surco se cierran para crear el tubo neural . La formación del tubo neural a partir del ectodermo se denomina neurulación . La parte ventral del tubo neural se denomina placa basal ; la parte dorsal se denomina placa alar . El interior hueco se denomina canal neural . Al final de la cuarta semana de gestación, los extremos abiertos del tubo neural, llamados neuroporos, se cierran. [5]
Un labio de blastoporo trasplantado puede convertir el ectodermo en tejido neural y se dice que tiene un efecto inductivo. Los inductores neurales son moléculas que pueden inducir la expresión de genes neurales en explantos de ectodermo sin inducir también genes mesodérmicos. La inducción neural se estudia a menudo en embriones de xenopus, ya que tienen un patrón corporal simple y hay buenos marcadores para distinguir entre tejido neural y no neural. Ejemplos de inductores neurales son las moléculas noggin y chordin .
Cuando las células ectodérmicas embrionarias se cultivan a baja densidad en ausencia de células mesodérmicas, experimentan una diferenciación neuronal (expresan genes neuronales), lo que sugiere que la diferenciación neuronal es el destino predeterminado de las células ectodérmicas. En cultivos de explantos (que permiten interacciones directas entre células), las mismas células se diferencian en epidermis. Esto se debe a la acción de BMP4 (una proteína de la familia TGF-β ) que induce a los cultivos ectodérmicos a diferenciarse en epidermis. Durante la inducción neuronal, el mesodermo dorsal (notocorda) produce noggin y chordin y se difunden en el ectodermo suprayacente para inhibir la actividad de BMP4. Esta inhibición de BMP4 hace que las células se diferencien en células neuronales. La inhibición de la señalización de TGF-β y BMP (proteína morfogenética ósea) puede inducir de manera eficiente el tejido neuronal a partir de células madre pluripotentes humanas , [6] un modelo de desarrollo humano temprano.
A finales de la cuarta semana, la parte superior del tubo neural se flexiona a la altura del futuro mesencéfalo, el mesencéfalo . Por encima del mesencéfalo se encuentra el prosencéfalo (futuro prosencéfalo) y por debajo, el rombencéfalo (futuro rombencéfalo). La vesícula óptica (que con el tiempo se convertirá en el nervio óptico, la retina y el iris) se forma en la placa basal del prosencéfalo.
La médula espinal se forma a partir de la parte inferior del tubo neural. La pared del tubo neural está formada por células neuroepiteliales, que se diferencian en neuroblastos, formando la capa del manto (la materia gris). Las fibras nerviosas emergen de estos neuroblastos para formar la capa marginal (la materia blanca). La parte ventral de la capa del manto (las placas basales) forma las áreas motoras de la médula espinal, mientras que la parte dorsal (las placas alares) forma las áreas sensoriales. Entre las placas basales y alares hay una capa intermedia que contiene neuronas del sistema nervioso autónomo. [7]
En la quinta semana, la placa alar del prosencéfalo se expande para formar los hemisferios cerebrales (el telencéfalo ). La placa basal se convierte en el diencéfalo .
El diencéfalo, el mesencéfalo y el rombencéfalo constituyen el tronco encefálico del embrión. Continúa flexionándose en el mesencéfalo. El rombencéfalo se pliega hacia atrás, lo que hace que su placa alar se ensanche y forme el cuarto ventrículo del cerebro. La protuberancia y el cerebelo se forman en la parte superior del rombencéfalo, mientras que el bulbo raquídeo se forma en la parte inferior.
La neuroimagen es responsable de grandes avances en la comprensión de cómo se desarrolla el cerebro. El EEG y el ERP son procesos de imagen efectivos que se utilizan principalmente en bebés y niños pequeños, ya que son más suaves. Los bebés generalmente son evaluados con fNIRS . La resonancia magnética y la fMRI se utilizan ampliamente para la investigación del cerebro debido a la calidad de las imágenes y el análisis que se puede obtener de ellas.
Las resonancias magnéticas son útiles para analizar muchos aspectos del cerebro. La relación de transferencia de magnetización (RMT) mide la integridad mediante la magnetización. La anisotropía fraccional (AF) mide la organización mediante la difusión de moléculas de agua. Además, la difusividad media (MD) mide la fuerza de los tractos de materia blanca . [8]
Mediante la resonancia magnética estructural, se puede realizar una evaluación cuantitativa de una serie de procesos de desarrollo, incluida la definición de patrones de crecimiento [9] y la caracterización de la secuencia de mielinización. [10] Estos datos complementan la evidencia de los estudios de imágenes del tensor de difusión (ITD) que se han utilizado ampliamente para investigar el desarrollo de la materia blanca.
La fMRI pone a prueba la mentalización, que es la teoría de la mente, mediante la activación de una red. El surco temporal superior posterior (pSTS) y la unión temporoparietal (TPJ) son útiles para predecir el movimiento. En los adultos, el pSTS derecho mostró una mayor respuesta que la misma región en los adolescentes cuando se evaluó la causalidad intencional. Estas regiones también se activaron durante el ejercicio "mente en los ojos", en el que la emoción debe juzgarse en función de diferentes imágenes de ojos. Otra región clave es la corteza temporal anterior (ATC) en la región posterior. En los adultos, la ATC izquierda mostró una mayor respuesta que la misma región en los adolescentes cuando se evaluó en pruebas emocionales de mentalización. Finalmente, la corteza prefrontal medial (MPFC) y la MPFC dorsal anterior (dMPFC) se activan cuando la mente es estimulada por la psicología. [8]
La obtención de imágenes de mayor resolución ha permitido que la ecografía tridimensional ayude a identificar el desarrollo del cerebro humano durante las etapas embrionarias. Los estudios indican que en la sexta semana de gestación se forman tres estructuras primarias : el prosencéfalo , el mesencéfalo y el rombencéfalo , también conocidos como prosencéfalo, mesencéfalo y rombencéfalo, respectivamente. A partir de estas, en la séptima semana de gestación se forman cinco estructuras secundarias: el telencéfalo, el diencéfalo, el mesencéfalo, el metencéfalo y el mielencéfalo, que más tarde se convierten en los ventrículos laterales, los terceros ventrículos, el acueducto y las partes superior e inferior del cuarto ventrículo desde el telencéfalo hasta el mielencéfalo, durante la edad adulta. La ecografía tridimensional permite obtener imágenes in vivo del desarrollo ideal del cerebro, lo que puede ayudar a reconocer irregularidades durante la gestación. [11]
Mediante resonancia magnética, los estudios mostraron que mientras que la materia blanca aumenta desde la infancia (~9 años) hasta la adolescencia (~14 años), la materia gris disminuye. Esto se observó principalmente en las cortezas frontal y parietal. Las teorías sobre por qué ocurre esto varían. Una idea es que la mielinización intracortical emparejada con el aumento del calibre axonal aumenta el volumen del tejido de la materia blanca. Otra es que la reorganización sináptica ocurre a partir de la proliferación y luego la poda. [8]
El aumento y la disminución del volumen de materia gris en los lóbulos frontal y parietal alcanzó su punto máximo alrededor de los 12 años de edad. El pico para los lóbulos temporales fue alrededor de los 17 años, siendo la corteza temporal superior la última en madurar. Las regiones sensoriales y motoras maduraron primero, después de lo cual se desarrolló el resto de la corteza. Esto se caracterizó por la pérdida de materia gris y se produjo desde la región posterior a la anterior. Esta pérdida de materia gris y el aumento de materia blanca pueden ocurrir a lo largo de la vida, aunque los cambios más fuertes ocurren desde la infancia hasta la adolescencia. [8]
La migración neuronal es el método por el cual las neuronas viajan desde su lugar de origen hasta su posición final en el cerebro. Los medios de migración más comunes son la migración radial y la migración tangencial.
Las células madre neuronales proliferan en la zona ventricular del neocórtex en desarrollo . Las primeras células postmitóticas que migran desde la preplaca están destinadas a convertirse en células de Cajal-Retzius y neuronas de la subplaca . Estas células migran por translocación somal. Las neuronas que migran con este modo de locomoción son bipolares y unen el borde delantero del proceso a la piamadre . El soma es luego transportado a la superficie de la piamadre por nucleocinesis, un proceso por el cual una "jaula" de microtúbulos alrededor del núcleo se alarga y se contrae en asociación con el centrosoma para guiar al núcleo a su destino final. [12] Las fibras radiales (también conocidas como glía radial) pueden translocarse a la placa cortical y diferenciarse en astrocitos o neuronas . [13] La translocación somal puede ocurrir en cualquier momento durante el desarrollo. [14]
Las oleadas posteriores de neuronas dividen la preplaca migrando a lo largo de las fibras gliales radiales para formar la placa cortical. Cada oleada de células migratorias pasa por delante de sus predecesoras formando capas de adentro hacia afuera, lo que significa que las neuronas más jóvenes son las más cercanas a la superficie. [15] [16] Se estima que la migración guiada por la glía representa el 80-90% de las neuronas migratorias. [17]
Muchas neuronas que migran a lo largo del eje anteroposterior del cuerpo utilizan tractos axónicos existentes para migrar en un proceso llamado migración axófila. [18] Un ejemplo de este modo de migración es en las neuronas que expresan GnRH , que hacen un largo viaje desde su lugar de nacimiento en la nariz, a través del prosencéfalo y hacia el hipotálamo. [19] Muchos de los mecanismos de esta migración han sido elaborados, empezando por las señales de guía extracelulares [20] que desencadenan la señalización intracelular. Estas señales intracelulares, como la señalización de calcio , conducen a la dinámica del citoesqueleto de actina [21] y microtúbulos [22] , que producen fuerzas celulares que interactúan con el entorno extracelular a través de proteínas de adhesión celular [23] para provocar el movimiento de estas células.
La migración neurofílica se refiere a la migración de neuronas a lo largo de un axón que pertenece a un nervio diferente. La migración gliófila es la migración de la glía a lo largo de las fibras gliales. [24]
La mayoría de las interneuronas migran tangencialmente a través de múltiples modos de migración para alcanzar su ubicación apropiada en la corteza. Un ejemplo de migración tangencial es el movimiento de las células de Cajal-Retzius dentro de la zona marginal del neuroepitelio cortical. [25]
También existe un método de migración neuronal llamado migración multipolar . [26] [27] Esto se observa en células multipolares, que están abundantemente presentes en la zona intermedia cortical . No se parecen a las células que migran por locomoción o translocación somal. En cambio, estas células multipolares expresan marcadores neuronales y extienden múltiples procesos delgados en varias direcciones independientemente de las fibras gliales radiales. [26]
Los factores neurotróficos son moléculas que promueven y regulan la supervivencia neuronal en el sistema nervioso en desarrollo. Se distinguen de los metabolitos ubicuos necesarios para el mantenimiento y el crecimiento celular por su especificidad; cada factor neurotrófico promueve la supervivencia de sólo ciertos tipos de neuronas durante una etapa particular de su desarrollo. Además, se ha argumentado que los factores neurotróficos están involucrados en muchos otros aspectos del desarrollo neuronal, que van desde la guía axonal hasta la regulación de la síntesis de neurotransmisores. [28]
El neurodesarrollo en el sistema nervioso adulto incluye mecanismos como la remielinización , la generación de nuevas neuronas , glía , axones , mielina o sinapsis . La neurorregeneración se diferencia entre el sistema nervioso periférico (SNP) y el sistema nervioso central (SNC) por los mecanismos funcionales y, especialmente, la extensión y velocidad.
El sistema nervioso continúa desarrollándose durante la edad adulta hasta la muerte cerebral . [ cita(s) adicional(es) necesaria( s) ] Por ejemplo:
Las investigaciones, los tratamientos y las políticas a menudo distinguen entre cerebros "maduros" y cerebros "en desarrollo", mientras que los científicos han señalado que "la naturaleza compleja del neurodesarrollo en sí mismo plantea desafíos para establecer un punto de referencia que indique cuándo un cerebro está maduro" y que varias medidas estructurales del cerebro cambian constantemente a lo largo de la fase adulta de la vida, [34] aunque los niveles de neuroplasticidad infantil pueden no alcanzarse nuevamente [ cita requerida ] y se cree que existen varios períodos críticos y sensibles del desarrollo cerebral. [35]
El aprendizaje suele ser más eficiente en los niños y lleva más tiempo o es más difícil con la edad . Un estudio que utilizó neuroimagen identificó la rápida estimulación del neurotransmisor GABA como un importante componente explicativo potencial de por qué ocurre esto. [36] [37]
Los cerebros de los niños contienen más " sinapsis silenciosas " que están inactivas hasta que son reclutadas como parte de la neuroplasticidad y el aprendizaje o los recuerdos flexibles . [38] [39] La neuroplasticidad aumenta durante los períodos críticos o sensibles del desarrollo cerebral, principalmente en referencia al desarrollo cerebral durante el desarrollo infantil . [40]
Sin embargo, los investigadores, después de someter a participantes de mediana edad a cursos universitarios, sugieren que las diferencias percibidas en el aprendizaje según la edad pueden ser el resultado de diferencias en el tiempo, el apoyo, el entorno y las actitudes, más que una capacidad inherente. [41]
Lo que los seres humanos aprenden en las primeras etapas y lo que aprenden a aplicar, establece el rumbo de la vida o tiene un impacto desproporcionado. [42] Los adultos suelen tener una mayor capacidad para seleccionar lo que aprenden, en qué medida y cómo. Por ejemplo, los niños pueden aprender las materias y los temas dados en los programas escolares a través de la escritura a mano en la pizarra del aula , en lugar de poder elegir temas/habilidades o trabajos específicos para aprender y los estilos de aprendizaje. Por ejemplo, los niños pueden no haber desarrollado intereses consolidados, ética, interés en el propósito y las actividades significativas, conocimiento sobre los requisitos y demandas del mundo real y las prioridades.En el desarrollo temprano (antes del nacimiento y durante los primeros meses), el cerebro sufre más cambios en tamaño, forma y estructura que en cualquier otro momento de la vida. Una mejor comprensión del desarrollo cerebral durante este período crítico es importante para trazar un mapa del crecimiento normal y para investigar los mecanismos de lesión asociados con factores de riesgo de mal desarrollo, como el nacimiento prematuro. Por lo tanto, existe la necesidad de una cobertura densa de este rango de edad con un atlas que varíe con el tiempo y dependa de la edad. Estos atlas espacio-temporales pueden representar con precisión los cambios dinámicos que ocurren durante el desarrollo cerebral temprano [9] y pueden usarse como un espacio de referencia normativo.
Además, se han realizado estudios de expresión genética a gran escala en diferentes regiones cerebrales desde el inicio de la gestación hasta el envejecimiento. Este tipo de datos proporciona una perspectiva única de los cambios que se producen en el cerebro durante este largo período. Este enfoque mostró que el 86 por ciento de los genes se expresaban y que el 90 por ciento de ellos se regulaban de forma diferencial a nivel de transcripción completa o exónico en las distintas regiones cerebrales y/o en el tiempo. La mayoría de estas diferencias espaciotemporales se detectaron antes del nacimiento, con aumentos posteriores de la similitud entre los transcriptomas regionales.
Las diferencias interáreas muestran un patrón temporal de reloj de arena, que divide el desarrollo neocortical humano en tres fases principales. Durante la primera fase, en los primeros seis meses después de la concepción, la arquitectura general de las regiones cerebrales se forma en gran medida por un estallido de actividad genética, que es distinto para regiones específicas del neocórtex. A este estallido le sigue una especie de intermedio que comienza en el tercer trimestre del embarazo. Durante este período, la mayoría de los genes que están activos en regiones cerebrales específicas se silencian, excepto los genes que estimulan las conexiones entre todas las regiones del neocórtex. Luego, en la niñez tardía y la adolescencia temprana, la orquesta genética comienza de nuevo y ayuda a dar forma sutil a las regiones del neocórtex que realizan progresivamente tareas más especializadas, un proceso que continúa hasta la edad adulta. [43] [44] [45]
Los enfoques para investigar la organogénesis y el desarrollo temprano del cerebro o sistema nervioso humano incluyen:
La inaccesibilidad del tejido humano ha impedido la comprensión molecular de la formación de las capacidades cognitivas. [46] La placenta también es objeto de investigación. [56] [57] [55]
Una mejor comprensión del desarrollo podría permitir comprender mejor las enfermedades del sistema nervioso, mejorar la inteligencia y brindar una mejor protección contra los efectos nocivos de los factores identificados en el desarrollo fetal (que podrían incluir enfermedades de la madre, diversos eventos y xenobióticos ). [54] [55] [ se necesitan citas adicionales ]
La investigación ha podido realizar nuevos descubrimientos para diversas partes del cerebro gracias a las imágenes no invasivas disponibles.
En esta región se observa una mayor actividad en los adolescentes que en los adultos cuando se enfrentan a pruebas sobre tareas de mentalización, así como de intención comunicativa y personal. Disminución de la actividad desde la adolescencia hasta la edad adulta. En una tarea de mentalización que emplea animación, la corteza prefrontal medial dMPFC se estimuló más en los adultos, mientras que la corteza prefrontal medial ventral se estimuló más en los niños. Se pueden atribuir al uso de una estrategia objetiva asociada a la corteza prefrontal medial dMPFC. Las teorías sobre la disminución de la actividad desde la adolescencia hasta la edad adulta varían. Una teoría es que la estrategia cognitiva se vuelve más automática con la edad y otra es que el cambio funcional ocurre en paralelo al cambio neuroanatómico que se caracteriza por la sinaptogénesis y la poda. [8]
El MPFC es un ejemplo de una región específica que se ha comprendido mejor con las técnicas de imagen actuales. Las investigaciones actuales proporcionan muchos más hallazgos como este.
El estrés en la primera infancia se define como la exposición a circunstancias durante la infancia que abruman los recursos de afrontamiento del niño y conducen a períodos prolongados de estrés. [58] Los resultados de múltiples estudios indican que los efectos del estrés en la primera infancia sobre el cerebro en desarrollo son significativos e incluyen, entre otros, los siguientes: aumento del volumen de la amígdala, [59] [60] disminución de la actividad en las estructuras cerebrales corticales frontales y límbicas, [61] y alteraciones de las estructuras de la materia blanca. [62]
Se cree que el estrés en los primeros años de vida produce cambios en el desarrollo cerebral al interferir con la neurogénesis, la producción sináptica y la poda de sinapsis y receptores. [58] La interferencia con estos procesos podría resultar en un aumento o disminución del volumen de las regiones cerebrales, lo que podría explicar los hallazgos de que el estrés en los primeros años de vida está asociado con un aumento del volumen de la amígdala y una disminución del volumen de la corteza cingulada anterior. [59] [63]
De la literatura se han extraído varias conclusiones importantes. Las áreas cerebrales que experimentan un desarrollo posnatal significativo, como las implicadas en la memoria y la emoción, son más vulnerables a los efectos del estrés en la primera infancia. [58] [64] Por ejemplo, el hipocampo continúa desarrollándose después del nacimiento y es una estructura que se ve afectada por el maltrato infantil. [64] El estrés en la primera infancia parece interferir con la sobreproducción de sinapsis que es típica en la infancia, pero no interfiere con la poda sináptica en la adolescencia. Esto da como resultado volúmenes hipocampales más pequeños, lo que potencialmente explica la asociación entre el estrés en la primera infancia y la reducción del volumen hipocampal. [63] Esta reducción del volumen puede estar asociada con los déficits de regulación emocional observados en las personas expuestas al estrés en la primera infancia.
La amígdala es particularmente vulnerable al estrés en los primeros años de vida. [58] La amígdala también experimenta un desarrollo significativo durante la infancia, se altera estructural y funcionalmente en individuos que han experimentado estrés en los primeros años de vida y está asociada con las dificultades socioemocionales vinculadas con el estrés en los primeros años de vida.
El tipo de receptor es otro factor a tener en cuenta a la hora de determinar si una región cerebral es sensible o no a los efectos del estrés en los primeros años de vida. Las regiones cerebrales con una alta densidad de receptores de glucocorticoides son especialmente vulnerables a los efectos del estrés en los primeros años de vida, probablemente porque los glucocorticoides se unen a estos receptores durante la exposición al estrés, lo que facilita el desarrollo de respuestas de supervivencia a expensas de otras vías neuronales importantes. [64] Algunos ejemplos de regiones cerebrales con alta densidad de receptores de glucocorticoides son el hipocampo y el vermis cerebeloso. El estrés activa el eje HPA y da lugar a la producción de glucocorticoides. El aumento de la producción de glucocorticoides da lugar a una mayor activación de estas regiones cerebrales, lo que facilita el desarrollo de ciertas vías neuronales a expensas de otras.
Las anomalías en la estructura y función cerebral suelen estar asociadas a déficits que pueden persistir durante años después de que se haya eliminado el estrés y pueden ser un factor de riesgo para una psicopatología futura. [58] Las regiones cerebrales más sensibles al estrés en la primera infancia son aquellas que experimentan cambios evolutivos durante la exposición al estrés. Como resultado, el estrés altera la trayectoria evolutiva de esa región cerebral, produciendo alteraciones duraderas en la estructura y función.
Los tipos comunes de estrés en la primera infancia que se han documentado incluyen el maltrato, el abandono y el internamiento previo en instituciones. También se ha demostrado que vivir en la pobreza influye de manera similar en la función cerebral. [65]
{{cite web}}: Falta o está vacío |title=( ayuda )