La neurociencia molecular es una rama de la neurociencia que estudia conceptos de la biología molecular aplicados al sistema nervioso de los animales. El ámbito de esta materia abarca temas como la neuroanatomía molecular , los mecanismos de señalización molecular en el sistema nervioso , los efectos de la genética y la epigenética en el desarrollo neuronal, y las bases moleculares de la neuroplasticidad y las enfermedades neurodegenerativas . [1] Al igual que la biología molecular, la neurociencia molecular es un campo relativamente nuevo que es considerablemente dinámico.
En biología molecular , la comunicación entre neuronas ocurre típicamente por transmisión química a través de espacios entre las células llamados sinapsis . Los químicos transmitidos, conocidos como neurotransmisores , regulan una fracción significativa de las funciones corporales vitales. [2] Es posible localizar anatómicamente los neurotransmisores mediante técnicas de etiquetado. Es posible identificar químicamente ciertos neurotransmisores como las catecolaminas fijando secciones de tejido neural con formaldehído . Esto puede dar lugar a fluorescencia inducida por formaldehído cuando se expone a la luz ultravioleta . La dopamina , una catecolamina, se identificó en el nematodo C. elegans utilizando esta técnica. [3] La inmunocitoquímica , que implica generar anticuerpos contra entidades químicas o biológicas específicas, incluye algunas otras técnicas de interés. Un neurotransmisor específico podría ser etiquetado específicamente por anticuerpos primarios y secundarios con etiquetado radiactivo para identificar el neurotransmisor por autorradiografía . La presencia de neurotransmisores (aunque no necesariamente su ubicación) se puede observar mediante inmunocitoquímica ligada a enzimas o ensayos inmunoabsorbentes ligados a enzimas (ELISA), en los que la unión del sustrato en los ensayos enzimáticos puede inducir precipitados , fluoróforos o quimioluminiscencia . En el caso de que los neurotransmisores no se puedan identificar histoquímicamente, un método alternativo es localizarlos por sus mecanismos de captación neuronal. [1]

Las células excitables de los organismos vivos tienen canales iónicos dependientes del voltaje . Estos se pueden observar en todo el sistema nervioso en las neuronas. Los primeros canales iónicos que se caracterizaron fueron los canales iónicos de sodio y potasio por AL Hodgkin y AF Huxley en la década de 1950 al estudiar el axón gigante del género de calamares Loligo . Su investigación demostró la permeabilidad selectiva de las membranas celulares, dependiente de las condiciones fisiológicas, y los efectos eléctricos que resultan de estas permeabilidades para producir potenciales de acción . [4]
Los canales de sodio fueron los primeros canales iónicos dependientes de voltaje que se aislaron en 1984 de la anguila Electrophorus electricus por Shosaku Numa . La toxina tetrodotoxina (TTX) del pez globo , un bloqueador de los canales de sodio, se utilizó para aislar la proteína del canal de sodio uniéndola mediante la técnica de cromatografía en columna para la separación química. La secuencia de aminoácidos de la proteína se analizó mediante degradación de Edman y luego se utilizó para construir una biblioteca de ADNc que podría usarse para clonar la proteína del canal. La clonación del canal en sí permitió aplicaciones como la identificación de los mismos canales en otros animales. [1] Los canales de sodio son conocidos por trabajar en conjunto con los canales de potasio durante el desarrollo de potenciales graduados y potenciales de acción. Los canales de sodio permiten una afluencia de iones Na + en una neurona, lo que resulta en una despolarización del potencial de membrana en reposo de una neurona para conducir a un potencial graduado o potencial de acción, dependiendo del grado de despolarización. [5]
Los canales de potasio se presentan en diversas formas, están presentes en la mayoría de las células eucariotas y, por lo general, tienden a estabilizar la membrana celular en el potencial de equilibrio de potasio . Al igual que con los iones de sodio, los potenciales graduados y los potenciales de acción también dependen de los canales de potasio. Mientras que la entrada de iones de Na + en una neurona induce la despolarización celular, el eflujo de iones de K + fuera de una neurona hace que una célula se repolarice al potencial de membrana en reposo. La activación de los propios canales de iones de potasio depende de la despolarización resultante de la entrada de Na + durante un potencial de acción. [1] Al igual que con los canales de sodio, los canales de potasio tienen sus propias toxinas que bloquean la acción de las proteínas del canal. Un ejemplo de dicha toxina es el catión grande, tetraetilamonio (TEA) , pero es notable que la toxina no tiene el mismo mecanismo de acción en todos los canales de potasio, dada la variedad de tipos de canales en las especies. La presencia de canales de potasio se identificó por primera vez en moscas mutantes de Drosophila melanogaster que temblaban de forma incontrolable durante la anestesia debido a problemas en la repolarización celular que conducían a una electrofisiología anormal de neuronas y músculos. Los canales de potasio se identificaron por primera vez mediante la manipulación de la genética molecular (de las moscas) en lugar de realizar una purificación de proteínas de canal porque no se conocían ligandos de alta afinidad para los canales de potasio (como TEA) en el momento del descubrimiento. [1] [6]
Los canales de calcio son importantes para ciertas cascadas de señalización celular, así como para la liberación de neurotransmisores en las terminales axónicas . En las células excitables se encuentran distintos tipos de canales de iones de calcio. Al igual que con los canales de iones de sodio, se han aislado y clonado canales de iones de calcio mediante técnicas de purificación cromatográfica. Cabe destacar, al igual que en el caso de la liberación de neurotransmisores, que los canales de calcio pueden interactuar con proteínas intracelulares y desempeñan un papel importante en la señalización, especialmente en lugares como el retículo sarcoplásmico de las células musculares. [1]
Se pueden utilizar varios tipos de receptores para la señalización y comunicación celular, entre los que se incluyen receptores ionotrópicos y receptores metabotrópicos. Estos tipos de receptores de la superficie celular se diferencian por el mecanismo y la duración de la acción, y los receptores ionotrópicos se asocian con la transmisión rápida de señales, mientras que los receptores metabotrópicos se asocian con la transmisión lenta de señales. Los receptores metabotrópicos cubren una amplia variedad de receptores de la superficie celular con cascadas de señalización notablemente diferentes . [1] [5]
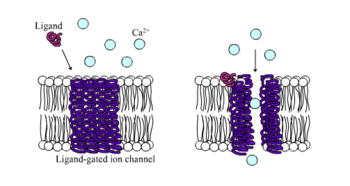
Los receptores ionotrópicos , también conocidos como canales iónicos regulados por ligando , son receptores de acción rápida que median la función neuronal y fisiológica mediante el flujo de canales iónicos con unión a ligando. Los receptores nicotínicos, GABA y glutamato se encuentran entre algunos de los receptores de la superficie celular regulados por el flujo de canales iónicos regulados por ligando. El GABA es el principal neurotransmisor inhibidor del cerebro y el glutamato es el principal neurotransmisor excitador del cerebro. [1]
Se sabe que los receptores GABA A y GABA C son ionotrópicos, mientras que el receptor GABA B es metabotrópico. Los receptores GABA A median respuestas inhibidoras rápidas en el sistema nervioso central (SNC) y se encuentran en neuronas, células gliales y células de la médula suprarrenal . Es responsable de inducir la entrada de iones Cl − en las células, reduciendo así la probabilidad de que se produzca la despolarización de la membrana tras la llegada de un potencial graduado o un potencial de acción. Los receptores GABA también pueden interactuar con ligandos no endógenos para influir en la actividad. Por ejemplo, el compuesto diazepam (comercializado como Valium) es un agonista alostérico que aumenta la afinidad del receptor por el GABA. Los mayores efectos inhibidores fisiológicos resultantes del aumento de la unión del GABA hacen del diazepam un tranquilizante o anticonvulsivo (fármacos antiepilépticos) útil. Por otra parte, los receptores GABA también pueden ser atacados disminuyendo el influjo celular de Cl − con el efecto de convulsivos como la picrotoxina . El mecanismo de acción antagónico de este compuesto no es directamente sobre el receptor GABA, pero hay otros compuestos que son capaces de inactivación alostérica, incluyendo T-butilbicicloforotionato (TBPS) y pentilentetrazol (PZT). En comparación con GABA A , los receptores GABA C tienen una mayor afinidad por GABA, es probable que tengan una actividad más duradera y es probable que sus respuestas sean generadas por concentraciones más bajas de GABA. [1]
Los receptores de glutamato ionotrópicos pueden incluir receptores NMDA , AMPA y kainato . Estos receptores reciben su nombre de agonistas que facilitan la actividad del glutamato. Los receptores NMDA son notables por sus mecanismos excitatorios para afectar la plasticidad neuronal en el aprendizaje y la memoria, así como en neuropatologías como el accidente cerebrovascular y la epilepsia. Los receptores NDMA tienen múltiples sitios de unión al igual que los receptores ionotrópicos GABA y pueden ser influenciados por coagonistas como el neurotransmisor glicina o la fenciclidina (PCP). Los receptores NMDA transportan una corriente por iones Ca 2+ y pueden ser bloqueados por iones Mg 2+ extracelulares dependiendo del voltaje y el potencial de membrana. Este influjo de Ca 2+ aumenta por los potenciales postsinápticos excitatorios (EPSP) producidos por los receptores NMDA, activando cascadas de señalización basadas en Ca 2+ (como la liberación de neurotransmisores). AMPA genera corrientes postsinápticas excitatorias más cortas y más grandes que otros receptores de glutamato ionotrópicos. [5]
Los receptores nicotínicos se unen al neurotransmisor acetilcolina (ACh) para producir un flujo de canales catiónicos no selectivo que genera respuestas postsinápticas excitatorias. La actividad de los receptores, que puede verse influida por el consumo de nicotina, produce sensaciones de euforia, relajación e inevitablemente adicción en niveles altos. [5]

Los receptores metabotrópicos son receptores de respuesta lenta en las células postsinápticas. Por lo general, estas respuestas lentas se caracterizan por cambios intracelulares más elaborados en la bioquímica. Las respuestas de captación de neurotransmisores por parte de los receptores metabotrópicos pueden dar lugar a la activación de enzimas intracelulares y cascadas que involucran segundos mensajeros, como es el caso de los receptores ligados a la proteína G. Varios receptores metabotrópicos pueden incluir ciertos receptores de glutamato, receptores muscarínicos de ACh, receptores GABA B y receptores de tirosina quinasas .
La cascada de señalización ligada a la proteína G puede amplificar significativamente la señal de un neurotransmisor en particular para producir de cientos a miles de segundos mensajeros en una célula. El mecanismo de acción por el cual los receptores ligados a la proteína G provocan una cascada de señalización es el siguiente:

Los neurotransmisores se liberan en paquetes discretos conocidos como cuantos desde la terminal axonal de una neurona hasta las dendritas de otra a través de una sinapsis . Estos cuantos se han identificado mediante microscopía electrónica como vesículas sinápticas . Dos tipos de vesículas son las vesículas sinápticas pequeñas (SSV), que tienen un diámetro de aproximadamente 40-60 nm , y las vesículas grandes de núcleo denso (LDCV), vesículas electrodensas de aproximadamente 120-200 nm de diámetro. [1] Las primeras se derivan de los endosomas y albergan neurotransmisores como la acetilcolina , el glutamato , el GABA y la glicina . Las últimas se derivan del aparato de Golgi y albergan neurotransmisores más grandes como las catecolaminas y otros neurotransmisores peptídicos . [7] Los neurotransmisores se liberan desde una terminal axonal y se unen a las dendritas postsinápticas en la siguiente procesión: [5]
La liberación de neurotransmisores depende de un suministro externo de iones Ca 2+ que ingresan a las terminales axónicas a través de canales de calcio dependientes de voltaje . La fusión vesicular con la membrana terminal y la liberación del neurotransmisor son causadas por la generación de gradientes de Ca 2+ inducidos por potenciales de acción entrantes . Los iones Ca 2+ causan la movilización de vesículas recién sintetizadas de un grupo de reserva para experimentar esta fusión de membrana. Este mecanismo de acción fue descubierto en axones gigantes de calamar. [8] La reducción de iones Ca 2+ intracelulares proporciona un efecto inhibidor directo sobre la liberación de neurotransmisores. [1] Después de que ocurre la liberación del neurotransmisor, las membranas vesiculares se reciclan a sus orígenes de producción. Los canales de iones de calcio pueden variar dependiendo de la ubicación de incidencia. Por ejemplo, los canales en una terminal axónica difieren de los canales de calcio típicos de un cuerpo celular (ya sea neuronal o no). Incluso en las terminales de los axones, los tipos de canales de iones de calcio pueden variar, como es el caso de los canales de calcio de tipo P ubicados en la unión neuromuscular . [1]
Las diferencias en la determinación del sexo están controladas por los cromosomas sexuales . La liberación de hormonas sexuales tiene un efecto significativo en los dimorfismos sexuales (diferenciación fenotípica de las características sexuales) del cerebro. Estudios recientes parecen sugerir que la regulación de estos dimorfismos tiene implicaciones para la comprensión del funcionamiento normal y anormal del cerebro. Los dimorfismos sexuales pueden estar significativamente influenciados por la expresión de genes cerebrales basados en el sexo, que varía de una especie a otra.
Se han utilizado modelos animales como roedores, Drosophila melanogaster y Caenorhabditis elegans , para observar los orígenes y/o el alcance del sesgo sexual en el cerebro frente a las gónadas productoras de hormonas de un animal. Con los roedores, los estudios sobre la manipulación genética de los cromosomas sexuales dieron como resultado un efecto en un sexo que era completamente opuesto al efecto en el otro sexo. Por ejemplo, la eliminación de un gen en particular solo dio como resultado efectos similares a la ansiedad en los machos. Con estudios en D. menlanogaster se encontró que se produjo un gran sesgo sexual en la expresión cerebral incluso después de que se eliminaran las gónadas, lo que sugiere que el sesgo sexual podría ser independiente del control hormonal en ciertos aspectos. [9]
La observación de genes con sesgo sexual tiene el potencial de tener importancia clínica para observar la fisiología cerebral y el potencial de trastornos neurológicos relacionados (ya sea directa o indirectamente). Algunos ejemplos de enfermedades con sesgo sexual en el desarrollo incluyen la enfermedad de Huntington , la isquemia cerebral y la enfermedad de Alzheimer . [9]
Muchas funciones cerebrales pueden verse influidas a nivel celular y molecular por variaciones y cambios en la expresión genética, sin alterar la secuencia de ADN de un organismo. Esto también se conoce como regulación epigenética . Ejemplos de mecanismos epigenéticos incluyen modificaciones de histonas y metilación de ADN . Se ha descubierto que tales cambios tienen una gran influencia en la incidencia de enfermedades cerebrales, enfermedades mentales y adicciones. [10] Se ha demostrado que el control epigenético está involucrado en altos niveles de plasticidad en el desarrollo temprano, lo que define su importancia en el período crítico de un organismo. [11] Algunos ejemplos de cómo los cambios epigenéticos pueden afectar al cerebro humano son los siguientes:
La excitotoxicidad es un fenómeno en el que los receptores de glutamato se activan de forma inapropiada. Puede ser causada por una transmisión sináptica excitatoria prolongada en la que los altos niveles del neurotransmisor glutamato causan una activación excesiva en una neurona postsináptica que puede resultar en la muerte de la neurona postsináptica. Después de una lesión cerebral (por ejemplo, por isquemia ), se ha descubierto que la excitotoxicidad es una causa importante de daño neuronal. Esto puede ser comprensible en el caso en el que la perfusión repentina de sangre después de un flujo sanguíneo reducido al cerebro puede resultar en una actividad sináptica excesiva causada por la presencia de un aumento de glutamato y aspartato durante el período de isquemia. [5] [13]
La enfermedad de Alzheimer es la enfermedad neurodegenerativa más común y es la forma más común de demencia en los ancianos. El trastorno se caracteriza por la pérdida progresiva de la memoria y de varias funciones cognitivas. Se ha planteado la hipótesis de que la deposición del péptido amiloide-β (40-42 residuos de aminoácidos) en el cerebro es fundamental en la incidencia de la enfermedad de Alzheimer. Se supone que la acumulación bloquea la potenciación a largo plazo del hipocampo . También es posible que un receptor para los oligómeros amiloide-β pueda ser una proteína priónica . [14]
La enfermedad de Parkinson es la segunda enfermedad neurodegenerativa más común después de la enfermedad de Alzheimer. Es una enfermedad de los ganglios basales de movimiento hipocinético causada por la pérdida de neuronas dopaminérgicas en la sustancia negra del cerebro humano. Por lo tanto, el flujo inhibitorio de salida de los ganglios basales no disminuye, y por lo tanto las neuronas motoras superiores , mediadas por el tálamo , no se activan de manera oportuna. Los síntomas específicos incluyen rigidez, problemas posturales, movimientos lentos y temblores. El bloqueo de la entrada del receptor GABA de las neuronas espinosas medianas a las células reticulatas , causa una inhibición de las neuronas motoras superiores similar a la inhibición que ocurre en la enfermedad de Parkinson. [5]
La enfermedad de Huntington es una enfermedad de los ganglios basales que afecta a los movimientos hipercinéticos y que se produce por la falta de estímulos inhibidores normales de las neuronas espinosas medianas de los ganglios basales. Esto provoca los efectos opuestos a los asociados con la enfermedad de Parkinson, incluida la activación inadecuada de las neuronas motoras superiores . Al igual que con los mecanismos GABAérgicos observados en relación con la enfermedad de Parkinson, un agonista de GABA inyectado en la pars reticulata de la sustancia negra disminuye la inhibición de las neuronas motoras superiores, lo que da lugar a movimientos motores involuntarios balísticos, similares a los síntomas de la enfermedad de Huntington. [5]